Antibiotic resistance and pulsed-field gel electrophoresis patterns of Shigella sonnei isolates
ZHANG Hong-hong1, CHEN Min2, CHEN Hong-you2, ZHANG Xi2, ZHU Lin-ying1, SU Jing-hua1, FU Hui-qin1, HUANG Hong1, ZHANG Yong-qi1, LIAN Wei-gang1, WANG Wen-qing1, YANG Ling-feng1
Pudong District Center for Disease Control and Prevention of Shanghai, Shanghai 200136, China
Abstract
Objective To understand antibiotic resistance of Shigella sonnei and establish its DNA fingerprint database in Pudong district by conducting drug resistance test and pulsed-field gel electrophoresis (PFGE) molecular subtyping. Methods The drug resistance of 34 S. sonnei isolates to 12 antibiotics was conducted by K-B method, and the molecular subtyping of the isolates was done by PFGE after the digestion of restriction enzyme XbaⅠ. Results The resistant rates of isolates to streptomycin, nalidixic acid, trimethoprim and sulfamethoxazole were 100%, and the resistant rate was 94.1% to ampicillin, 91.2% to gentamicin, 88.2% to tetracycline and 2.9% to ceftazidime and cefepime, but they were all sensitive to amoxicillin, clavulanic acid, chloramphenicol and ofloxacin. All the isolates showed 13 PFGE patterns and similarity was more than 90%. The isolates with same PFGE patterns showed same antibiotic resistance. J16X01. sh011 were the predominant PFGE patterns. The isolates with same PFGE patterns were detected in different time and place. Conclusion The antibiotic resistance of S. sonnei is becoming more serious. There were closely related pandemic clones of S. sonnei in Pudong district.
Keywords:
Shigella sonnei
pulsed-field gel electrophoresis
antibiotic resistance
molecular subtyping
宋内志贺菌耐药性及脉冲场凝胶电泳分子分型分析
章红红1, 陈敏2, 陈洪友2, 张曦2, 朱林英1, 苏靖华1, 傅慧琴1, 黄红1, 张勇琪1, 连伟刚1, 王闻卿1, 杨玲凤1
1. 上海市浦东新区疾病预防控制中心, 上海 200136;
2. 上海市疾病预防控制中心
2. 上海市疾病预防控制中心
摘要
目的 通过对宋内志贺菌菌株耐药性及脉冲场凝胶电泳(pulse-field gel electrophoresis,PFGE)分子分型分析,了解上海市浦东新区宋内志贺菌的耐药谱,并建立宋内志贺菌DNA指纹图谱数据库。 方法 运用K-B法对34株宋内志贺菌株进行12种抗生素药敏试验,同时对菌株基因组DNA经限制性内切酶XbaⅠ酶切后进行PFGE分子分型,利用BioNumerics Version 5.10分析软件对图谱进行聚类分析。 结果 34株宋内志贺菌菌株对链霉素、萘啶酸、甲氧嘧啶、复方新诺明耐药率为100%,对氨苄西林、庆大霉素、四环素耐药率分别为94.1%、91.2%和88.2%,对头孢他啶、头孢吡肟耐药率均为2.9%,对阿莫西林/克拉维酸、氯霉素、氧氟沙星为100%敏感。共获得13个PFGE带型,各带型间相似性系数在90%以上。相同PFGE带型内各菌株间药敏结果完全一致。J16X01.sh011为优势带型,不同时间、不同腹泻监测点之间存在完全相同PFGE条带。 结论 宋内志贺菌多重耐药现象日趋严重,浦东新区存在遗传谱紧密相关的宋内志贺菌流行克隆系。
内容大纲
2 结果
- 2.1 宋内志贺菌PEGE结果
- 2.2 药敏结果
- 2.2.1 34株宋内志贺菌菌株
- 2.2.2 相同PEGE条带的菌株
1 材料与方法
1.1 材料
1.1.1 研究对象
凡24 h内大便次数3次及以上,粪便性状改变者视为腹泻患者。腹泻患者来源自2011年浦东新区15个监测点(仁济、东方、南中心、七院、公利、浦南、南华、泥城、张江、潍坊、周家渡、联洋、沪东、金杨、花木)。
1.1.2 标准菌株
药敏试验标准质控菌株的大肠埃希菌ATCC25922、PFGE实验分子质量标准对照的布伦卢普沙门菌(Salmonella Braenderup,H9812),均由上海市疾病预防控制中心(CDC)微生物实验室提供。
1.1.3 主要试剂
志贺菌诊断血清(宁波天润),MH培养基(Oxoid),药敏纸片(Oxoid),蛋白酶K(Promega),限制性内切酶XbaⅠ(TaKaRa),SeaKem Gold Agarose(Cambrex),10× TBE (BIO-RAD)。均在有效期内使用。
1.1.4 主要仪器
水浴箱(37 ℃、56 ℃),56 ℃水浴摇床,菌液比浊仪(BioMerieux),PFGE(Bio-Rad CHEF Mapper),凝胶成像系统(Bio-Rad Chemic Doc XRS+),分析软件(BioNumerics Version 5.10)。
1.2 方法
1.2.1 菌株分离及鉴定
按照细菌性和阿米巴性痢疾诊断标准(WS 287 - 2008),将标本接种在SS平板上,37 ℃培养箱内培养18 h,挑取可疑菌落进行生化试验及血清分型试验。
1.2.2 药敏试验
采用美国临床和实验室标准化研究所(CLSI)推荐的K-B纸片扩散法进行药敏试验,挑取经纯化的宋内志贺菌落以及标准质控菌株ATCC25922,用生理盐水稀释并校正至0.5麦氏单位,用无菌棉签蘸取菌液,均匀涂布在MH琼脂平板表面,用纸片分配器将含药纸片贴在MH平板表面,37 ℃培养箱内培养16 h,用游标卡尺测量抑菌圈直径并记录结果。判断标准参照CLSI 2010年颁布的标准。12种药敏纸片分别为氨苄西林、阿莫西林/克拉维酸、头孢他啶、头孢吡肟、庆大霉素、链霉素、四环素、氯霉素、萘啶酸、氧氟沙星、甲氧嘧啶、复方新诺明。
1.2.3 PFGE
参照美国CDC公布的PulseNet PFGE分子分型标准化实验室操作进行,挑取经纯化的宋内志贺菌落,制备成4.2~4.5麦氏单位的细菌悬液,用蛋白酶K进行裂解,与1%的SeaKem Gold Agarose混合制成胶块。用限制性内切酶XbaⅠ对胶块及分子质量标记H9812进行酶切2 h,然后与1%的SeaKem Gold Agarose制成电泳凝胶,放入PFGE仪内,设置电泳初始脉冲时间为2.16 s,最终脉冲时间为54.17 s,电压为6 V/cm,角度为60°,电泳时间为18.5 h,循环泵循环速度为70 L/min,冷凝温度为14 ℃,进行PFGE。电泳结束后用0.03%的Gel-Red染色液染色30 min,用超纯水脱色1 h后,在凝胶成像系统内获得图像,运用BioNumerics Version 5.10分析软件对图谱进行聚类分析。
2 结果
2011年共分离到34株宋内志贺菌。其中6月1株,7月8株,8月10株,9月8株,10月4株,11月3株。病例以19~59岁的青壮年为主,最小11岁,最大74岁。病例的地理分布情况见图1。
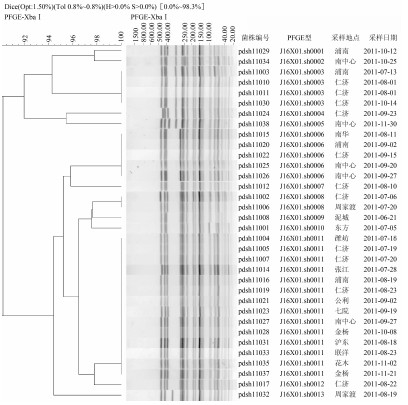
2.1 宋内志贺菌PFGE结果
34株宋内志贺菌菌株经限制性内切酶XbaⅠ酶切后进行PFGE,各菌株基因组DNA片段分离良好,运用BioNumerics Version 5.10软件进行分析,绘制出聚类树状图,见图1。菌株电泳图谱条带的数量与位置完全相同即相似性系数是100%为同一带型,有1条或以上条带差异为不同带型。34株宋内志贺菌菌株共获得13个PFGE带型。根据PulseNet命名原则对带型进行命名,J16表示宋内志贺菌,X01表示内切酶XbaⅠ,sh表示上海,13个PFGE带型标记 为J16X01.sh001-J16X01.sh013,其中J16X01.sh011型内有14株菌株,占41.2%,为优势带型。J16X01.sh003、J16X01.sh006、J16X01.sh008型内分别有4、5、2株菌株,分别占11.8%、14.7%、5.9%。其余带型内各有1株菌株。结果显示,2011年浦东新区各监测点分离得到的34株志贺菌菌株,其相似性系数在90%以上,J16X01.sh011为优势带型,不同时间、不同腹泻监测点之间存在完全相同PFGE条带。
2.2 药敏结果
2.2.1 34株宋内志贺菌菌株
对链霉素、萘啶酸、甲氧嘧啶、复方新诺明耐药率为100%,对氨苄西林、庆大霉素、四环素有较高耐药性,耐药率分别为94.1%、91.2%和88.2%,对头孢他啶、头孢吡肟有较低耐药性,耐药率均为2.9%,对阿莫西林/克拉维酸、氯霉素、氧氟沙星为100%敏感,12种抗生素的耐药性结果见表1。
图1 34株志贺菌PFGE聚类树状图
Figure 1 Dendrogram of PFGE patterns of 34 S. sonnei isolates
表1 34株宋内志贺菌药敏结果
Table 1 Drug susceptibility result of 34 S. sonnei isolates
| 药物名称 | 耐药 | 中度敏感 | 敏感 | |||||
| 株数 | 构成比(%) | 株数 | 构成比(%) | 株数 | 构成比(%) | |||
| 氨苄西林 | 32 | 94.1 | 0 | 0.0 | 2 | 5.9 | ||
| 阿莫西林/克拉维酸 | 0 | 0.0 | 0 | 0.0 | 34 | 100.0 | ||
| 头孢他啶 | 1 | 2.9 | 1 | 2.9 | 32 | 94.2 | ||
| 头孢吡肟 | 1 | 2.9 | 1 | 2.9 | 32 | 94.2 | ||
| 庆大霉素 | 31 | 91.2 | 0 | 0.0 | 3 | 8.8 | ||
| 链霉素 | 34 | 100.0 | 0 | 0.0 | 0 | 0.0 | ||
| 四环素 | 30 | 88.2 | 0 | 0.0 | 4 | 11.8 | ||
| 氯霉素 | 0 | 0.0 | 0 | 0.0 | 34 | 100.0 | ||
| 萘啶酸 | 34 | 100.0 | 0 | 0.0 | 0 | 0.0 | ||
| 氧氟沙星 | 0 | 0.0 | 0 | 0.0 | 34 | 100.0 | ||
| 甲氧嘧啶 | 34 | 100.0 | 0 | 0.0 | 0 | 0.0 | ||
| 复方新诺明 | 34 | 100.0 | 0 | 0.0 | 0 | 0.0 | ||
2.2.2 相同PFGE条带的菌株
J16X01.sh003、J16X01.sh006、J16X01.sh008、J16X01.sh011型内各菌株药敏结果完全一致。
3 讨论
本研究中药敏结果显示氨苄西林、第一代喹诺酮类药中的萘啶酸、氟喹诺酮类药中的氧氟沙星、复方新诺明耐药率分别为94.1%、100%、0%和100%,提示氧氟沙星在治疗宋内志贺菌感染中表现有较高抗菌活性。此结果与国内的报道相似[3],但较韩国报道的氨苄西林41%耐药率有所不同[2]。与质粒R不介导对氧氟沙星等氟喹诺酮类药物的耐药性的研究结论一致 。本研究数据显示浦东新区宋内志贺菌出现多重耐药现象,与10年前上海报道的菌株耐药性相比较[5],目前耐药情况更趋严重,萘啶酸、甲氧嘧啶、复方新诺明、氨苄西林、四环素均出现高耐药率,与韩国报道的结果相类似[2],可能与宋内志贺菌存在有多个质粒传播的耐药基因有关[6]。实验数据显示菌株对头孢他啶、头孢吡肟耐药性较低,但我们必须注意到原本敏感的菌株可能会在使用三代头孢菌素治疗3~4 d时产生耐药性,一般抗菌药物压力越大,产生耐药基因的速度越快[5],因此需要重复进行药敏实验。CLSI警告氨基糖苷类药物可能在体外表现有抗菌活性,但在临床上无抗感染作用,本次研究数据显示即使在体外实验中,链霉素与庆大霉素均表现为极高耐药性,其中链霉素100%耐药的结果与韩国报道一致[2]。
国外有报道可通过PFGE的结果对菌株的敏感与耐药进行区分[7],笔者的研究发现J16X01.sh003、J16X01.sh006、J16X01.sh008、J16X01.sh011型内各菌株间药敏结果完全一致,因此,PFGE可以用于耐药菌株的同源性分析。
本次研究的菌株为浦东新区2011年6月下旬至11月底的腹泻散发患者分离株,尽管实验结果显示J16X01.sh011为优势带型,但所有菌株的聚类相似性系数大于90%,提示浦东新区存在遗传谱系紧密相关的宋内志贺菌流行克隆系。
根据聚类分析判断原则,带型相似性系数在100%的菌株可能为聚集性或暴发菌株,成都市曾报道运用PFGE技术对两起细菌性痢疾暴发进行研究[8]。本次研究中带型为J16X01.sh003中pdsh11010、pdsh11011分离自仁济医院2011年8月1日的腹泻患者肛拭,相同时间、相同地点、相同PFGE带型,提示可能为一起暴发事件。J16X01.sh011中pdsh11004、pdsh11005、pdsh11007分离自地理位置邻近的2家医院,3个腹泻患者就诊的时间分别相差1 d,相近日期、相邻地点、相同PFGE带型,提示可能为一起聚集性病例事件。但由于缺乏相同PFGE带型的食品分离株,因此不能为流行病学调查提供完整的食物中毒证据链,这方面将有待于进一步的提高。Brian等[9]认为由于菌株可能来源于同一克隆系的原因,PFGE有时不能区分同一地区一段时间内的散发病例,如J16X01.sh011型内14株菌株,分离自7-11月,缺乏流行病学调查资料仅单纯从实验室角度,难以判断这些菌株中哪些为暴发菌株,因此对于聚类相似性系数为100%的菌株的病例应及时进行流行病学调查与分析,以便获得因水或食品或其他共同暴露因素,以此对宋内志贺菌进行溯源,并对传播源进行及时控制。
本研究结果为浦东新区宋内志贺菌的分子溯源研究提供了基础, 充分发挥分子分型技术的优势与运用,建立以实验室为基础的监测体系,通过流行病学调查与实验室监测的更有效结合,将极大提高该区腹泻病监测的能级和效率。
参考文献
[1] Mandomando I,Jaintilal D,Pons MJ,et al. Antimicrobial susceptibility and mechanisms of resistance in Shigella spp and Salmonella spp isolated from children under five years of age with diarrhea in rural Mozambique[J]. Antimicrob Agents Chemother,2009,53(6):2450-2454.
[2] Yu H,Wang XH,Ye YZ,et al. Detection of TEM-type β-lactamase gene and antimicrobial resistance in Shigella flexneri isolated from children[J]. Chinese Journal of Infection and Chemotherapy,2005,5(5):304-306.(in Chinese)
俞蕙,王晓红,叶颖子,等. 儿童福氏志贺菌TEM 型β内酰胺酶耐药基因及其耐药性检测[J]. 中国抗感染化疗杂志,2005,5(5):304-306.
[3] Zhang GY,Yu DS,Wang P. Epidemic Shigella in Gansu province,2005-008[J]. Chinese Journal of Natural Medicine,2010,12(4):271-273. (in Chinese)
张广业,于德山,汪鹏. 甘肃省2005-2008年志贺菌检测分析[J]. 中国自然医学杂志,2010,12(4):271-273.
[4] Qian HM,Zhuang L,Dong C,et al. Analysis on the serotype and antimicrobial resistance of Shigella spp during 2008-2009 in Jiangsu province[J]. Jiangsu Journal of Preventive Medicine,2010,21(4):15-17. (in Chinese)
钱慧敏,庄菱,董晨,等. 江苏省2008-2009 年志贺菌菌型分布及耐药性分析[J]. 江苏预防医学,2010,21(4):15-17.
[5] Zhang HP,Chen QY. Pathogenic detection of Shigella from diarrhea children[J]. China Tropical Medicine,2005,5(7):1537,1587. (in Chinese)
张慧萍,陈群英. 腹泻儿童志贺菌病原学检测分析[J]. 中国热带医学,2005,5(7):1537,1587.
[6] Wang Y,Zhang L,Su WL,et al. Distribution and drug resistance of enteric pathogenic bacteria in some areas of Beijing[J]. Journal of Preventive Medicine of Chinese People's Liberation Army,2007,25(2):94-97. (in Chinese)
王勇,张凌,苏文莉,等. 北京部分地区肠道病原菌的分布及耐药状况[J]. 解放军预防医学杂志,2007,25(2):94-97.
[7] Hu LF,Li X. Detection of Shigella producing beta-lactamases and analysis of their gene types[J]. Acta Universitatis Medicinalis Anhui,2007,42(1):87-90. (in Chinese)
胡立芬,李旭. 产β-内酰胺酶痢疾杆菌检测及其基因分析[J]. 安徽医科大学学报,2007,42(1):87-90.
[8] Shen LZ,Xu F,Yu LL,et al. Serotyping and drug resistance of Shigella circulated in Wenzhou, Zhejiang province[J]. Disease Surveillance,2009,24(5):334-336. (in Chinese)
沈丽珍,徐斐,余玲玲,等.浙江省温州地区志贺菌流行菌株的血清分型及耐药性分析[J]. 疾病监测,2009,24(5):334-336.
[9] Zhang GX,Zhang CL,Shen LM,et al. The epidemic characteristics of Bacillary dysentery and drug resistance of Shigella[J]. Chinese Journal of Zoonoses,2011,27(12):1122-1125. (in Chinese)
张国祥,张传领,沈利蒙,等.细菌性痢疾流行特点及志贺菌耐药性研究[J]. 中国人兽共患病学报,2011,27(12):1122-1125.
[10] Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing[S].Twenty-First informational supplement.CLSI documents M100-S21.Wayne,PennsyIvania: Clin Laboratory Standards Institute,2011.
[2] Yu H,Wang XH,Ye YZ,et al. Detection of TEM-type β-lactamase gene and antimicrobial resistance in Shigella flexneri isolated from children[J]. Chinese Journal of Infection and Chemotherapy,2005,5(5):304-306.(in Chinese)
俞蕙,王晓红,叶颖子,等. 儿童福氏志贺菌TEM 型β内酰胺酶耐药基因及其耐药性检测[J]. 中国抗感染化疗杂志,2005,5(5):304-306.
[3] Zhang GY,Yu DS,Wang P. Epidemic Shigella in Gansu province,2005-008[J]. Chinese Journal of Natural Medicine,2010,12(4):271-273. (in Chinese)
张广业,于德山,汪鹏. 甘肃省2005-2008年志贺菌检测分析[J]. 中国自然医学杂志,2010,12(4):271-273.
[4] Qian HM,Zhuang L,Dong C,et al. Analysis on the serotype and antimicrobial resistance of Shigella spp during 2008-2009 in Jiangsu province[J]. Jiangsu Journal of Preventive Medicine,2010,21(4):15-17. (in Chinese)
钱慧敏,庄菱,董晨,等. 江苏省2008-2009 年志贺菌菌型分布及耐药性分析[J]. 江苏预防医学,2010,21(4):15-17.
[5] Zhang HP,Chen QY. Pathogenic detection of Shigella from diarrhea children[J]. China Tropical Medicine,2005,5(7):1537,1587. (in Chinese)
张慧萍,陈群英. 腹泻儿童志贺菌病原学检测分析[J]. 中国热带医学,2005,5(7):1537,1587.
[6] Wang Y,Zhang L,Su WL,et al. Distribution and drug resistance of enteric pathogenic bacteria in some areas of Beijing[J]. Journal of Preventive Medicine of Chinese People's Liberation Army,2007,25(2):94-97. (in Chinese)
王勇,张凌,苏文莉,等. 北京部分地区肠道病原菌的分布及耐药状况[J]. 解放军预防医学杂志,2007,25(2):94-97.
[7] Hu LF,Li X. Detection of Shigella producing beta-lactamases and analysis of their gene types[J]. Acta Universitatis Medicinalis Anhui,2007,42(1):87-90. (in Chinese)
胡立芬,李旭. 产β-内酰胺酶痢疾杆菌检测及其基因分析[J]. 安徽医科大学学报,2007,42(1):87-90.
[8] Shen LZ,Xu F,Yu LL,et al. Serotyping and drug resistance of Shigella circulated in Wenzhou, Zhejiang province[J]. Disease Surveillance,2009,24(5):334-336. (in Chinese)
沈丽珍,徐斐,余玲玲,等.浙江省温州地区志贺菌流行菌株的血清分型及耐药性分析[J]. 疾病监测,2009,24(5):334-336.
[9] Zhang GX,Zhang CL,Shen LM,et al. The epidemic characteristics of Bacillary dysentery and drug resistance of Shigella[J]. Chinese Journal of Zoonoses,2011,27(12):1122-1125. (in Chinese)
张国祥,张传领,沈利蒙,等.细菌性痢疾流行特点及志贺菌耐药性研究[J]. 中国人兽共患病学报,2011,27(12):1122-1125.
[10] Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing[S].Twenty-First informational supplement.CLSI documents M100-S21.Wayne,PennsyIvania: Clin Laboratory Standards Institute,2011.