Detection of Mycoplasma penetrans and expression of NF-κBp65 in tumor tissue in laryngocarcinoma patients
SHEN Dan-dan1, FEI Hong-jun2, ZHOU Li-ping1
Department of Laboratory Medicine of Wenzhou Medical College, Wenzhou 325000, Zhejiang, China
Abstract
Objective To detect Mycoplasma penetrans(Mpe) from laryngocarcinoma patients, understand the condition of lymphatic metastasis and the expression of NF-κBp65 in tumor tissue and explore the correlation between Mpe infection and the occurrence of laryngocarcinoma, between lymphatic metastasis and the expression of NF-κBp65 in tumor tissue. Methods Mpe detection was conducted for 93 laryngocarcinoma patients and 40 controls by isolation culture and nPCR, the Mpe-positive samples were confirmed by electron microscope. And the condition of lymphatic metastasis and the expression of NF-κBp65 in tumor tissue of Mpe-positive and Mpe-negative patients were analyzed. Results The Mpe infection rate of laryngocarcinoma patients was significantly higher than control group(P<0.05). The lymphatic metastasis rate of Mpe-positive group was significantly higher than Mpe-negative group(P<0.05), the expression of NF-κBp65 in Mpe-positive group was significantly higher than Mpe-negative group(P<0.05). Mycoplasma with three-layer membrane structure were seen in Mpe-positive tumor tissue by electron microscope. Conclusion Positive correlation existed between Mpe infection and the occurrence of laryngocarcinoma and between lymphatic metastasis and the expression of NF-κBp65 in tumor tissue.
喉癌患者穿通支原体检出及其肿瘤组织NF-κBp65表达
沈丹丹1, 费红军2, 周丽萍1
1. 温州医学院检验医学院,浙江 温州 325000;
2. 浙江省宁波天一技术学院
2. 浙江省宁波天一技术学院
摘要
目的 喉癌患者穿通支原体的检出,及其淋巴转移和肿瘤组织NF-κBp65表达分析,试图探讨穿通支原体感染与喉癌的发生、淋巴转移及其肿瘤组织NF-κBp65的表达之间相关性。 方法 采用分离培养和巢式聚合酶链反应检测93例喉癌和40例对照组中穿通支原体的存在,阳性标本进一步电镜确认,并对阳性和阴性患者进行淋巴转移及其肿瘤组织NF-κBp65表达分析。 结果 喉癌患者穿通支原体感染率明显高于非肿瘤组(P<0.05),穿通支原体阳性组患者淋巴结转移率明显高于穿通支原体阴性组(P<0.05),穿通支原体阳性组NF-κBp65表达显著高于穿通支原体阴性组(P<0.05)。电镜观察见穿通支原体阳性肿瘤组织中3层膜结构的穿通支原体。 结论 穿通支原体感染与喉癌的发生、淋巴转移及其肿瘤组织NF-κBp65表达呈正相关。
内容大纲
-
1 材料与方法
- 1.1 组织与血液标本来源
- 1.2 标准菌株
- 1.3 分离培养基
- 1.4 试剂
- 1.5 支原体分离培养及鉴定
- 1.6 电镜观察
- 1.7 免疫组化法测定NF-κB65表达
- 1.8 统计学分析
- 2.1 支原体检出结果
- 2.2 喉癌患者淋巴结转移
- 2.3 电镜观察结果
- 2.4 喉癌组织NF-κB表达分析
1 材料与方法
1.1 组织与血液标本来源 93份喉癌、20份声带息肉标本取自宁波市李惠利医院2006 - 2007年手术切除的组织及其血液,20名健康人血液标本取自同一医院体检人群。
1.2 标准菌株
已知对照菌株穿通支原体(Mpe,ATCC55252)、发酵支原体(Mf,ATCC19989)、肺炎支原体(MP,ATCC15531)及解脲支原体(Uu,ATCC27618)均由东南大学医学院流行病学教研室赵季文教授惠赠。
1.3 分离培养基
改良的SP4液体培养基:70 ml PPLO基础培养基中无菌加入25%新鲜酵母浸出液10 ml,小牛血清20 ml,1%酚红0.4 ml,20万U/ml青霉素1 ml,50%葡萄糖2 ml,1%精氨酸1 ml,调至最适pH值。固体培养基:加1.5 g琼脂于70 ml PPLO基础培养基中,高压冷却后无菌加入25%鲜酵母浸出液10 ml,小牛血清20 ml,1%酚红0.4 ml,20万U/ml青霉素1 ml,50%葡萄糖2 ml, 1%精氨酸1 ml,调至最适pH值。
1.4 试剂
兔抗人NF-κBp65抗体、SABC试剂盒:购于武汉博士德公司;穿通支原体、发酵支原体 巢式-聚合酶链反应(nested Polymerase Chain Reaction,nPCR)试剂盒:无锡克隆遗传技术研究所提供。
1.5 支原体分离培养及鉴定
无菌操作取手术切除的喉癌和息肉组织约1 mm3左右,剪成碎末后过滤除菌,取滤液0.2 ml接种于2 ml改良SP4液体培养基中;取患者和正常人血清0.2 ml接种于2 ml改良SP4液体培养基中,分别置5% CO2,37 ℃孵箱中培养,逐日观察。发现液体由红变黄、澄清,则判为“可疑阳性”,分别取0.1 ml转种于改良SP4固体培养基和普通固体培养基中,置5% CO2,37 ℃孵箱培养1~3 d,镜下观察,在改良SP4固体培养基发现典型油煎蛋样菌落,而普通固体培养基中无菌落出现,则可排除细菌L型,并与同时接种的标准菌株对照,可能为Mp、Uu、Mf和Mpe,经生化反应试验予以初筛排除Mp和Uu。
采用支原体nPCR试剂盒进一步鉴别Mpe和Mf。严格按说明书操作:取阳性培养液500 μl,离心(10 000 r/min)5 min,吸弃上清液,加裂解液A 50 μl、裂解液B 2 μl,混匀,置55 ℃水浴1 h,转95 ℃以上保温10 min,离心(15 000 r/min)30 s,上清液为第1次扩增的模板。第1次扩增完毕后,每管加H2O 200 μl混匀,即为第2次扩增的模板。PCR扩增条件为:93 ℃预变性2 min,然后按93 ℃ 30 s→55 ℃ 30 s→72 ℃ 60 s,循环35个周期,最后一个循环的72 ℃延长至5 min。PCR产物于2%琼脂糖凝胶电泳30 min,若凝胶成像系统内出现410 bp或272 bp荧光条带,则确认为Mpe或Mf扩增阳性菌株。
1.6 电镜观察
取2例经证实Mpe阳性的喉癌组织,按常规制作电镜标本,电镜下观察[6]。
1.7 免疫组化法测定NF-κB65表达
取93例喉癌患者组织标本按常规包埋蜡块,采用免疫组化SABC法测定NF-κBp65表达情况,具体操作步骤:石蜡切片常规脱蜡水化;3%H2O2 室温封闭5~10 min,蒸馏水洗3次;微波修复,冷却后PBS洗1~2次;5%BSA封闭室温20 min,甩去多余液体,不洗;加一抗(1 ∶ 100)4 ℃过夜,PBS洗2 min×3次;二抗20~37 ℃ 20 min,PBS洗2 min×3次;加试剂SABC 20~37 ℃ 20 min,PBS洗5 min×4次;DAB显色,苏木素复染,常规脱水、透明、封片,镜下观察。结果判定,NF-κBp65表达阳性以细胞质或细胞质和细胞核同时着棕黄色或黄褐色为阳性,阳性表达水平采用染色强度评分乘以阳性细胞面积评分的积分表示。染色强度评分为,0级:阴性染色,与背景颜色一致;1级:弱阳性,淡黄色;2级:阳性,黄色;3级:强阳性,棕黄色。阳性细胞面积评分为,0级:阳性细胞占<10%;1级:阳性细胞占10%~25%;2级:阳性细胞占26%~50%;3级:阳性细胞占51%~75%;4级:阳性细胞占76%~100%。每张切片分别从上下左右和中间观察5个不连续的高倍视野(×400),均值为该切片的积分值。两者定性积分表达≤3为阴性表达(-),4~6为弱阳性(+),7~9为阳性(+ +),10~12为强阳性(+ + +)。
1.8 统计学分析
所有数据应用SPSS 14.0统计软件包进行分析,根据资料类型进行χ2检验。以 P<0.05为差异有统计学意义。
2 结果
2.1 支原体检出结果 经支原体分离培养和nPCR鉴定,93例喉癌患者Mpe感染阳性25例(33株Mpe),肿瘤组织和血液中分别检出Mpe(18,19.35%;15,16.13%),其中8例喉癌患者的肿瘤组织和血液中同时分离到Mpe,10例喉癌者的肿瘤组织和7例喉癌患者的血液中分别分离到Mpe。分别与息肉患者组织(0,0%)以及健康人血液(0,0%)比较(P<0.05),提示喉癌患者Mpe感染率明显高于非肿瘤组,见表1,培养阳性菌株Mpe nPCR结果见图1。
表1 Mpe分离检出结果
Table 1 Results of Mpe isolation
| 组别 | 例数 | Mpe 阳性例数 | 构成比 (%) | P值 |
| A.喉癌肿瘤组织 | 93 | 18 | 19.35 | 0.022(1) |
| B.喉癌患者血液 | 93 | 15 | 16.13 | 0.043(2) |
| C.息肉患者息肉组织 | 20 | 0 | 0.00 | |
| D.健康对照血液 | 20 | 0 | 0.00 | |
| 合计 | 226 | 33 | 14.60 |
图1 阳性培养菌株穿通支原体nPCR扩增结果
Figure 1 Result of nPCR amplification of Mpe in positive samples 注:M:DNA Marker; 1为穿通支原体阳性对照; 2为发酵支原体阳性对照; 3为穿通支原体阴性对照; 4、5、7、8、10、11、12、14为穿通支原体培养阳性标本; 6、9、13为穿通支原体培养阴性标本。
2.2 喉癌患者淋巴结转移
93例喉癌患者中,Mpe-阳性组患者淋巴结转移率与Mpe-阴性组比较差异有统计学意义(χ2=5.572,P=0.018),结果见表2。提示Mpe感染阳性患者中淋巴结转移率明显高于Mpe感染阴性喉癌患者。
表2 淋巴结转移比较
Table 2 Comparison of lymphatic metastasis
| 组别 | 例数 | 淋巴转移 阳性例数 | 构成比 (%) | P值 |
| Mpe-阳性组 | 25 | 14 | 56.00 | 0.018 |
| Mpe-阴性组 | 68 | 20 | 29.41 | |
| 合计 | 93 | 34 | 36.56 |
2.3 电镜观察结果
Mpe阳性的2例喉癌组织标本在电镜下观察,结果显示喉癌细胞中见3层膜结构的Mpe颗粒,结果见图2.1、2.2。
2.4 喉癌组织NF-κB表达分析
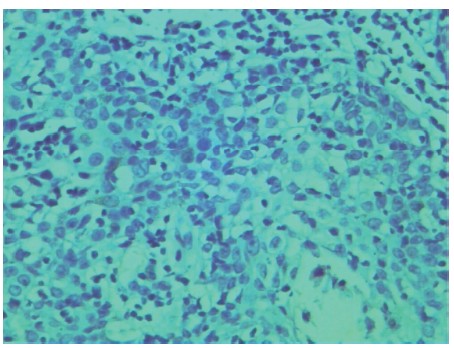
NF-κBp65表达阳性以细胞质或细胞质和细胞膜同时着棕黄色或黄褐色为阳性,见图3.1、3.2,阳性表达水平采用染色强度评分乘以阳性细胞面积评分的积分表示,二者定性积分表达在+ +以上记为NF-κBp65阳性表达。93例喉癌患者中,Mpe-阳性组NF-κBp65阳性率与Mpe-阴性组比较差异有统计学意义(χ2=11.722,P=0.001),提示Mpe感染阳性喉癌患者的肿瘤组织NF-κBp65阳性表达显著高于Mpe感染阴性的喉癌患者,见表3。
表3 肿瘤组织NF-κBp65表达比较
Table 3 Comparison of expression of NF-κBp65 in tumor tissue
| 组别 | 例数 | NF-κBp65 表达阳性 (+ +~+ + +) | 构成比 (%) | NF-κBp65 表达阴性 (-~+) | 构成比 (%) | P值 |
| Mpe-阳性组 | 25 | 18 | 72.00 | 7 | 28.00 | 0.001 |
| Mpe-阴性组 | 68 | 22 | 32.35 | 46 | 67.65 | |
| 合计 | 93 | 40 | 43.01 | 53 | 56.99 |
图2.1 Mpe阳性喉癌组织中见3层膜结构Mpe,伴随肿瘤组织溶解(×30 000)
Figure 2.1 A three-layer membrane structure Mpe in Mpe positive laryngocarcinoma tissue accompanied by tumor tissue dissolution(×30 000)
图2.2 Mpe阳性喉癌组织,溶解的肿瘤细胞间隙介质中见2个3层膜结构Mpe颗粒(×30 000)
Figure 2.2 Two three-layer membrane structure Mpe particles in dissolved intercellular space of Mpe positive laryngocarcinoma tissue(×30 000)
3 讨论
目前,关于喉癌发生、发展的生物因素研究尚处于探索阶段,有报道认为人乳头状瘤病毒(HPV) 和EB病毒与喉癌的发生、发展有关 。目前普遍认为,慢性持续性支原体感染, 会抑制细胞凋亡,引起 细胞转化。
Wang等[11]首先检测证实Mpe与Kaposi
图3.1 阳性喉癌组织NF-κBp65表达强阳性(×400)
Figure 3.1 NF-κBp65 strong positive expression in Mpe positive laryngocarcinoma tissue(×400)
图3.2 喉癌组织NF-κBp65阴性表达对照(×400)
Figure 3.2 Negative expression of NF-κBp65 in laryngocarcinoma tissue(×400)
肉瘤的形成密切相关,近年来研究也证实Mpe感染动物细胞后不但能引起细胞形态改变、染色体畸变,并在裸鼠体内形成瘤,提示Mpe存在致癌潜能[12]。本实验采用分离培养的方法对喉癌患者的肿瘤组织和血液标本进行穿通支原体的分离培养检测,电镜下证实肿瘤组织中3层膜穿通支原体颗粒,阳性的肿瘤组织高度溶解。
核转录因子NF-κB与肿瘤的发生和发展有着密切的联系,研究发现在很多可能与病毒相关的肿瘤中[13],NF-κB表达和活化水平均提高。支原体的慢性持续感染导致的炎症与肿瘤的发生有关,激活NF-κB也许是一个重要机制,进而激活癌基因和某些促癌细胞因子的表达,以及与抑制细胞的凋亡。Luo等[14]报道,内毒素可以激活肿瘤细胞的NF-κB信号通路,所产生的炎症因子通过上调TNF的表达而促进肿瘤的发生。支原体虽无细胞壁而无内毒素,但支原体有一种暴露在其表面能与周围环境各种成分不断相互作用而能影响机体免疫系统的脂质相关膜蛋白(Lipid-associated membrance proteins,LAMPs),LAMPs能诱导NF-κB的激活[15]。我们实验显示支原体感染阳性喉癌患者的肿瘤组织NF-κBp65表达程度高于非穿通支原体感染喉癌患者(P<0.05),提示穿通支原体感染与NF-κBp65的表达呈正相关,癌基因核转录因子NF-κBp65作为NF-κB家族的重要成员,在喉癌中的表达及临床意义仍有待进一步探讨[16]。
本研究从喉癌患者的肿瘤组织和血液中分离到穿通支原体,并在电镜下证实穿通支原体不但能侵入肿瘤组织,导致肿瘤组织的炎症、坏死,溶解,而且穿通支原体能在患者血液中存在,造成菌血症。我们的研究提示喉癌患者穿通支原体感染率明显高于声带息肉患者和健康体检者。此结果与我们从胃癌、膀胱移行癌和子宫颈癌穿通支原体感染率明显高于非肿瘤患者一致 。Ushio等[17]发现感染了支原体的细胞比未感染支原体的细胞在体内有更强的转移能力,Feng等[18]研究证实Mpe不但能阻止细胞凋亡,促进胚胎细胞恶性转化,而且具有促进肿瘤细胞浸润转移的作用。这与本研究中穿通支原体阳性患者中淋巴结转移明显高于穿通支原体阴性喉癌患者(P<0.05)相一致。以上提示穿通支原体感染与喉癌的发生、淋巴转移及其肿瘤组织NF-κBp65表达呈正相关。然而,肿瘤的发生、发展影响因素复杂,并非单一因子,穿通支原体感染与肿瘤的发生、发展及其分子机制有待进一步证实 。
参考文献
[1] Lo SC, Hayes MM, Wang BY-H, et al. Newly discovered mycoplasma isolated from patients infected with HIV[J]. Lancet,1991,338:1415-1418.
[2] Tsai S, Wear DJ, Shih JW, et al. Mycoplasmas and oncogenesis: persistent infection and multistage malignant transformation[J]. Proc Natl Acad Sci USA,1995,92(22):10197-10201.
[3] Zhang B, Shih JW, Wear DJ, et al. High-level expression of H-ras and c-myc oncogenes in mycoplasma-mediated malignant cell transformation[J].Proc Soc Exp Biol Med,1997,214(4):359-366.
[4] Liping Zhou, Xiushu Wen, Yanying Zhu, et al. Mycoplasma penetrans were isolated from blood and tumor tissue of cancer patients[J]. US Chinese J Lymphol Oncol,2007,6(3):129-136.
[5] Zhou LP, Yu ZX, Lan SH, et al. Isolation, identification and ultrastructural observation of Mycoplasma penetrans from blood and tissue specimens of cancer patients[J]. National Medical Journal of China,2006,86(26):1862-1864.(in Chinese) 周丽萍,余志贤,蓝升红,等. 肿瘤患者血液和肿瘤组织中穿通支原体的分离与鉴定及其电镜观察[J]. 中华医学杂志,2006,86(26):1862-1864.
[6] Zhu YY, Zhou LP, Zhang Q, et al. Isolation of Mycoplasma penetrans from blood and tissue specimens of patients with cervical cancer[J]. Chinese Journal of Zoonoses,2007,23(6):537-543.(in Chinese) 朱燕英,周丽萍,张乾,等.穿通支原体在宫颈癌患者血液和肿瘤组织中的分离检出[J]. 中国人兽共患病学报,2007,23(6):537-543.
[7] Brenner C, Neyrolles O, Blanchard A. Mycoplasmas and HIV infection: from epidemiology to their interaction with immune cells[J].Front Biosci,1996,1:e42-54.
[8] Wang SF, Zhou TL, Zhou LP.In vitro drug susceptibility test of Mycoplasma penetrans isolated from cancer patients[J].Disease Surveillance,2009,24(8):603-605.(in Chinese) 王赛芳,周铁丽,周丽萍.分离自肿瘤患者穿通支原体体外药物敏感性试验[J].疾病监测,2009,24(8):603-605.
[9] Morshed K, Polz-Dacewicz M, Rajtar B, et al.The prevalence of E6/E7 HPV type 16 in laryngeal cancer and in normal mucosa[J]. Pol Merkur Lekarski,2005,19(111):291-293.
[10] Liu Bao-Guo, Lu Zhe-Ming, Li Yong, et al. Detcetion of human papillomvairus L1-16 and-18 DNA andepstein barr virus DNA in laryngeal carcinoma[J].Chin J Can Res,2005,17(2):121-126.
[11] Wang RY, Shih JW, Weiss SH, et al. Mycoplama penetrans infection in male homosexuals with AIDS: high seroprevalence and association with Kaposi's sarcoma [J].Clin Infect Dis,1993,17(4):724-729.
[12] Zhang B, Shin JW, Wear DJ, et al. High-level expression of H-ras and C-myc oncogenes in mycoplasma mediated malignant cell transformation [J]. Proc Soc Exp Biol Med,1997, 214(4):359-366.
[13] Nakayama H, Ikebe T, Beppu M,et al. High expression levels of nuclear factor kappa B,I kappa B kinase alpha and Akt kinase in squamous cell carcinoma of the oral cavity[J].Cancer,2001,92(12):3037.
[14] Luo JL, Maeda S, Hsu LC,et al. Inhibition of NF-kappa B in cancer cells converts inflammation-induced tumor growth mediated by TNF alpha to TRAIL-mediated tumor regression[J].Cancer Cell,2004,6(3):297-305.
[15] Zeng YH,Wu YM,Zhang WB,et al.Activation of nuclear factorκB and induction of inducible nitric oxide sythase by lipid-associated memblance proteins isolated from Mycoplasma penetrans[J]. Chin Med J,2004,117(7):997-1001.
[16] Logunov DY, Scheblyakov1 DV, Zubkova OV, et al.Mycoplasma infection suppresses p53, activates NF-kappaB and cooperates with oncogenic Ras in rodent fibroblast transformation[J]. Oncogene,2008,27(33):4521-4531.
[17] Ushio S, Iwaki K, Taniai M, et al. Metastasis-promoting activity of a novel molecule,Ag 243-5, derived from mycoplasma, and the complete nucleotide sequence[J].Microbiol Immunol,1995,39(6):393-400.
[18] Feng SH, Tsai S, Lo SC. Mycoplasmal infections prevent apoptosis and induce malignant transformation of interleukin-3-dependent 32D Hematopoietic cells [J]. Mol Cellul Biol,1999,19:7995-8002.
[2] Tsai S, Wear DJ, Shih JW, et al. Mycoplasmas and oncogenesis: persistent infection and multistage malignant transformation[J]. Proc Natl Acad Sci USA,1995,92(22):10197-10201.
[3] Zhang B, Shih JW, Wear DJ, et al. High-level expression of H-ras and c-myc oncogenes in mycoplasma-mediated malignant cell transformation[J].Proc Soc Exp Biol Med,1997,214(4):359-366.
[4] Liping Zhou, Xiushu Wen, Yanying Zhu, et al. Mycoplasma penetrans were isolated from blood and tumor tissue of cancer patients[J]. US Chinese J Lymphol Oncol,2007,6(3):129-136.
[5] Zhou LP, Yu ZX, Lan SH, et al. Isolation, identification and ultrastructural observation of Mycoplasma penetrans from blood and tissue specimens of cancer patients[J]. National Medical Journal of China,2006,86(26):1862-1864.(in Chinese) 周丽萍,余志贤,蓝升红,等. 肿瘤患者血液和肿瘤组织中穿通支原体的分离与鉴定及其电镜观察[J]. 中华医学杂志,2006,86(26):1862-1864.
[6] Zhu YY, Zhou LP, Zhang Q, et al. Isolation of Mycoplasma penetrans from blood and tissue specimens of patients with cervical cancer[J]. Chinese Journal of Zoonoses,2007,23(6):537-543.(in Chinese) 朱燕英,周丽萍,张乾,等.穿通支原体在宫颈癌患者血液和肿瘤组织中的分离检出[J]. 中国人兽共患病学报,2007,23(6):537-543.
[7] Brenner C, Neyrolles O, Blanchard A. Mycoplasmas and HIV infection: from epidemiology to their interaction with immune cells[J].Front Biosci,1996,1:e42-54.
[8] Wang SF, Zhou TL, Zhou LP.In vitro drug susceptibility test of Mycoplasma penetrans isolated from cancer patients[J].Disease Surveillance,2009,24(8):603-605.(in Chinese) 王赛芳,周铁丽,周丽萍.分离自肿瘤患者穿通支原体体外药物敏感性试验[J].疾病监测,2009,24(8):603-605.
[9] Morshed K, Polz-Dacewicz M, Rajtar B, et al.The prevalence of E6/E7 HPV type 16 in laryngeal cancer and in normal mucosa[J]. Pol Merkur Lekarski,2005,19(111):291-293.
[10] Liu Bao-Guo, Lu Zhe-Ming, Li Yong, et al. Detcetion of human papillomvairus L1-16 and-18 DNA andepstein barr virus DNA in laryngeal carcinoma[J].Chin J Can Res,2005,17(2):121-126.
[11] Wang RY, Shih JW, Weiss SH, et al. Mycoplama penetrans infection in male homosexuals with AIDS: high seroprevalence and association with Kaposi's sarcoma [J].Clin Infect Dis,1993,17(4):724-729.
[12] Zhang B, Shin JW, Wear DJ, et al. High-level expression of H-ras and C-myc oncogenes in mycoplasma mediated malignant cell transformation [J]. Proc Soc Exp Biol Med,1997, 214(4):359-366.
[13] Nakayama H, Ikebe T, Beppu M,et al. High expression levels of nuclear factor kappa B,I kappa B kinase alpha and Akt kinase in squamous cell carcinoma of the oral cavity[J].Cancer,2001,92(12):3037.
[14] Luo JL, Maeda S, Hsu LC,et al. Inhibition of NF-kappa B in cancer cells converts inflammation-induced tumor growth mediated by TNF alpha to TRAIL-mediated tumor regression[J].Cancer Cell,2004,6(3):297-305.
[15] Zeng YH,Wu YM,Zhang WB,et al.Activation of nuclear factorκB and induction of inducible nitric oxide sythase by lipid-associated memblance proteins isolated from Mycoplasma penetrans[J]. Chin Med J,2004,117(7):997-1001.
[16] Logunov DY, Scheblyakov1 DV, Zubkova OV, et al.Mycoplasma infection suppresses p53, activates NF-kappaB and cooperates with oncogenic Ras in rodent fibroblast transformation[J]. Oncogene,2008,27(33):4521-4531.
[17] Ushio S, Iwaki K, Taniai M, et al. Metastasis-promoting activity of a novel molecule,Ag 243-5, derived from mycoplasma, and the complete nucleotide sequence[J].Microbiol Immunol,1995,39(6):393-400.
[18] Feng SH, Tsai S, Lo SC. Mycoplasmal infections prevent apoptosis and induce malignant transformation of interleukin-3-dependent 32D Hematopoietic cells [J]. Mol Cellul Biol,1999,19:7995-8002.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 沈丹丹 | |
| 费红军 | |
| 周丽萍 | |
| PubMed | |
| Article by SHEN Dan-dan | |
| Article by FEI Hong-jun | |
| Article by ZHOU Li-ping | |