Relationship between expressions of Cyclooxygenase 2 and Melanoma-associated antigen 1 in gastric adenocarcinoma patients and its impact on prognosis
YANG Xiao-feng1, LIANG Ting2
Department of Emergency Surgery, Linyi People's Hospital, 276001, Shandong, China
Abstract
Objective To detect the expressions of Cyclooxygenase 2(COX-2) and Melanoma-associated antigen 1(MAGE-1) in resected tumor tissues of gastric adenocarcinoma patients and analyze their relationship and the impact on the 5 year survival of the patients. Methods Immunohistochemistry was used to analyze the COX-2 and MAGE-1 expressions in 67 tumor samples resected from gastric adenocarcinoma patients. Statistical analysis was conducted by chi-square test. Results COX-2 was over-expressed in 55.2% of the patients, MAGE-1 was over-expressed in 46.3% of the patients. Over expression of COX-2 was a factor to reduce the 5-year survival rate while the over expression of MAGE-1 was not an influence factor. There was no correlation between COX-2 expression and MAGE-1expression (P=0.156). Conclusion Both COX-2 and MAGE-1were over-expressed in gastric adenocarcinoma tissues, COX-2 over expression was significantly related with low 5-year survival rate.
Keywords:
Cyclooxygenase 2
melanoma-associated antigen 1
gastric adenocarcinoma
immunohistochemistry
环氧合酶2同黑色素瘤抗原-1蛋白在胃癌患者表达的相关性和预后影响分析
杨晓峰1, 梁婷2
1. 山东省临沂市人民医院急诊外科,山东 临沂276001;
2. 江苏省南京市江宁区东山街道社区卫生服务中心
2. 江苏省南京市江宁区东山街道社区卫生服务中心
摘要
目的 检测环氧合酶-2(Cyclooxygenase-2,COX-2)和黑色素瘤抗原-1(Melanoma-associated antigen 1,MAGE-1)蛋白在胃腺癌切除组织中的表达情况及相关性分析, 以及对胃腺癌患者5年生存率的预后影响。 方法 用免疫组织化学方法对67例胃腺癌切除组织中COX-2和MAGE-1蛋白表达进行统计, 利用SPSS 19.0软件进行预后和相关性的χ2分析。 结果 COX-2表达阳性率为55.2%,MAGE-1表达阳性率为46.3%,分析结果显示COX-2蛋白高表达(阳性)是降低胃癌患者5年生存率的影响因素,MAGE-1高表达(阳性)不是降低胃癌患者5年生存率的影响因素,COX-2 表达同MAGE-1表达没有相关性(P=0.156)。 结论 COX-2蛋白和MAGE-1蛋白在胃腺癌组织中均有较高表达, 但COX-2高表达明显影响胃腺癌患者的5年生存率,尚不能得出MAGE-1蛋白高表达影响胃腺癌患者的5年生存率的结论。
胃癌是最常见的消化道肿瘤,在我国恶性肿瘤死亡率中占首位, 而胃恶性肿瘤中胃腺癌占95%,研究胃癌患者生存时间的影响因素, 对于提高胃癌的诊疗水平, 延长患者的生存时间有现实意义。对调节致癌的表达因子的研究可以为临床诊断和预后提供有用的信息,环氧合酶-2(Cyclooxygenase-2,COX-2)在免疫调节和癌变中发挥重要作用[1],近期的研究表明,COX-2催化生成的前列腺素可以激活、控制涉及细胞凋亡、侵袭转移,增殖和血管生成的信号通路[2],日本学者Oshima及其同事发现在转基因小鼠的胃中,COX-2可以促进肿瘤生成,同时,COX-2抑制剂则会导致小鼠中胃癌腺瘤生长受到抑制 ,近期的其他研究结果也表明COX-2可能是胃癌的标志物。黑色素瘤抗原(Melanoma Antigen,MAGE) 是新近发现的能被细胞毒T 淋巴细胞(CTL) 识别的人类少数肿瘤特异性抗原之一,黑色素瘤相关抗原基因-1(Melanoma-associated antigen 1,MAGE- 1)最初是从mz-2人黑色素瘤细胞系中分离出来的[4],多项研究已经表明MAGE-1基因在胃癌中高表达 ,这表明MAGE-1可作为抗肿瘤免疫治疗的靶向目标。目前, 国内尚未见有关COX-2和MAGE-1蛋白表达相关性及对胃癌患者5年生存率影响的报道,在2001 - 2011年,笔者对自1998年1月至2005年12月在山东省临沂市人民医院进行胃癌切除手术患者的切除组织进行COX-2、MAGE-1基因表达水平的相关检测,以及同患者5年生存率相关性初步分析,为胃癌患者进行免疫治疗和预后提供理论依据。
1 材料与方法
1.1 材料和患者 67例胃癌手术后切除的组织样本均来自1998年1月至2005年12月间在山东省临沂市人民医院接受胃癌切除手术的患者,这些样本在术后均经病理检测证实为胃腺癌。其中男性38例,女性29例,患者中位年龄为55.2岁(年龄 42~70岁),对这些患者的中位随访时间为61.2个月(随访时间范围为58~65个月),试验经临沂市人民医院伦理委员会批准后进行。
1.2 样本处理
将适量大小的手术样本经4%甲醛固定后石蜡包埋备用,选取经H & E染色后确定为胃癌组织的样本,共收集有效样本67例,4 μm连续切片后,每例样本分别取样3份进行免疫组化分析。
1.3 免疫组化
上述组织块切取4 μm厚度的切片后37 ℃干燥12~24 h,经二甲苯,梯度酒精脱去石蜡,再在0.3%柠檬酸缓冲液中进行抗原标记,为阻止非特异性结合位点,切片在正常小牛血清内处理15 min,通过含有过氧化氢和1.6%的磷酸盐缓冲液洗的甲醇灭活内源性过氧化物酶的活性。
兔抗人COX-2 多克隆抗体(SC-7951)为美国SantaCruz公司产品, 免疫组化试剂盒(SP法) 为北京中山公司产品。切片常规脱蜡入水, 微波抗原修复,COX-2 多抗按1 ∶ 200比例稀释,以下操作按试剂盒说明进行, 最后DAB 显色, 常规复染封片。用已知的阳性切片作阳性对照, 以PBS代替COX-2 多抗作阴性对照。在光学显微镜下观察, 阳性反应呈棕褐色。以细胞浆和/或细胞膜呈现棕黄色颗粒者为阳性细胞, 每例切片至少计数8个400倍视野, 计数阳性细胞占所有细胞的百分数, 按阳性细胞数分为:阳性细胞数<5%(-),>5%(+)。
兔抗人MAGE-1多克隆抗体(ab21472)为英国Abcam公司产品,免疫组化试剂盒(SP法) 为北京中山公司产品。将切片在小鼠抗MAGE-1多克隆抗体(Abcam Inc., Cambridge, MA, USA)以1 ∶ 100稀释比例PBS缓冲液(含1%牛血清白蛋白)中4 ℃培养24 h,以PBS代替MAGE-1一抗作阴性对照。经PBS洗脱后,同生物素抗鼠抗体IgG, A,M 溶液(Nichirei Co., Tokyo, Japan)室温培养30 min,SP法免疫组化,最后Mayer苏木精染色。在光学显微镜下观察, 阳性反应呈棕褐色。以细胞浆和/或细胞膜呈现棕黄色颗粒者为阳性细胞,每例切片至少计数8个400倍视野,计数阳性细胞占所有细胞的百分数,按阳性细胞数分为:阳性细胞数<10%(-),>10%(+)。
1.4 统计学分析
利用SPSS 19.0软件对COX-2蛋白和MAGE-1蛋白表达对5年生存率的影响和2种蛋白的相关性进行χ2分析。
2 结果
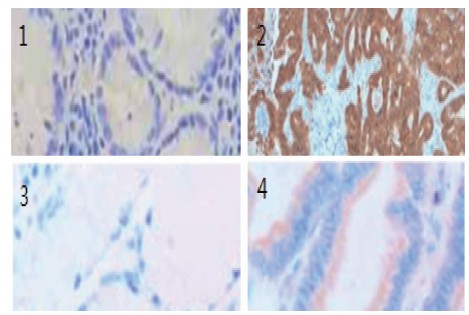
2.1 免疫组化分析结果 67例检测的胃腺癌样本中,COX-2表达阳性率为55.2%,MAGE-1表达阳性率为46.3%。癌组织及癌旁组织两种蛋白COX-2、MAGE-1的组化结果见图1。
图1 癌组织及癌旁组织两种蛋白COX-2、MAGE-1的免疫组化结果
Figure 1 Immunohistochemical result of COX-2 and MAGE-1 in cancer tissue and paracancerous tissue 注:1.癌旁组织MAGE-1的免疫组化结果(苏木精×200); 2. 癌组织MAGE-1的免疫组化结果(苏木精×200); 3. 癌旁组织COX-2的免疫组化结果(DAB×400) ; 4. 癌组织COX-2的免疫组化结果(DAB×400)。
2.2 生存分析
结果见表1,COX-2表达阳性患者5年生存率为18.9%,表达阴性患者5年生存率为43.3%,统计分析结果(P<0.05)证明COX-2蛋白高表达(阳性)是降低胃癌患者5年生存率的影响因素, MAGE-1表达阳性的患者5年生存率为29%,阴性患者的5年生存率则达到50%,此次试验不能得出MAGE-1高表达(阳性)是降低胃癌患者5年生存率的影响因素(P>0.05)。
表1 COX-2和MAGE-1对67例胃癌患者5年生存率的影响
Table 1 Impact of COX-2 and MAGE-1 on 5 year survival rate of 67 gastric cancer patients
| 标记物 | 表达结果 | 5年生存人数 | χ2 检验 | P 值 |
| COX-2(+) | 37 | 7 | 4.72 | 0.03 |
| COX-2(-) | 30 | 13 | ||
| MAGE-1(+) | 31 | 9 | 3.04 | 0.08 |
| MAGE-1(-) | 36 | 18 |
2.3 相关性分析
对COX-2和MAGE-1蛋白表达的相关性分析结果见表2,经χ2检验后发现COX-2 表达同MAGE-1表达没有相关性(r=0.132,P=0.156)。
表2 COX-2 表达同MAGE-1表达的相关性
Table 2 Correlation between COX-2 expression and MAGE-1 expression
| 检测变量 | 样本量 | COX- 2表达阳性例数 | r值 | P值 |
| MAGE-1(+) | 31 | 20 | 0.132 | 0.156 |
| MAGE-1(-) | 36 | 17 |
3 讨论
近年的研究结果显示结肠、肺、胃和食管癌的COX-2 表达显著增高 ,我们的研究证明了COX-2高表达是胃癌预后的一个重要影响因素,这与国外的相关研究结果一致 ,MAGE-1蛋白在非胃腺癌组织中的表达为阴性,同原癌基因和生长相关基因的激活方式类似,启动子Cp G岛甲基化激活后MAGE-1蛋白开始表达[10],同时Suzuki等[11]的研究结果表明Ⅰ期胃癌患者的组织样本经免疫组织化学分析MAGE-1蛋白无表达,而另一方面,Kuwahara等[12]利用RT-PCR技术检测47例早期胃癌患者MAGE-1 基因的阳性表达率达到17%,Ogata等[13]对于不同分期胃癌患者MAGE-1蛋白的总阳性率达44.9%,而我们检测出的MAGE-1蛋白表达阳性率为46.3%,这些结果的差异可能是免疫组化和PCR分析的灵敏性不同造成的,我们在研究中对67例胃癌标本COX-2和MAGE-1蛋白的表达相关性进行了分析,同时对这2种蛋白表达情况对胃腺癌患者5年生存影响进行了分析,结果表明:COX-2高表达影响胃腺癌患者的5年生存率,而MAGE-1蛋白高表达则没有对胃腺癌患者的5年生存率造成影响,同时COX-2蛋白的表达同MAGE-1蛋白表达没有相关性。
参考文献
[1] Mann JR, DuBois RN. Cyclooxygenase-2 and gastrointestinal cancer[J]. Cancer,2004,10(3):145-152.
[2] Wang D, Dubois RN. Prostaglandins and cancer[J]. Gut,2006,55(1):115-122.
[3] Oshima H, Oshima M, Inaba KT,et al. Hyperplastic gastric tumors induced by activated macrophages in COX-2/mPGES-1 transgenic mice[J]. EMBO J,2004,23(7):1669-1678.
[4] van der Bruggen P, Traversari C, Chomez P, et al. A gene encoding an antigen recognized by cytolytic T lymphocytes on a human melanoma[J]. Science,1991,254(5038):1643-1647.
[5] Itoh K, Hayashi A, Nakao M, et al. Human tumor rejection antigens MAGE[J]. J Biochem,1996,119(3):385-390.
[6] Lucas S, De Smet C, Arden KC, et al. Identification of a new MAGE gene with tumor-specific expression by representational difference analysis[J]. Cancer Res,1998,58(4):743-752.
[7] Wang D, Dubois RN. The role of COX-2 in intestinal inflammation and colorectal cancer[J]. Oncogene,2010,29(6):781-788.
[8] Mrena J, Wiksten JP, Kokkola A, et al. COX-2 is associated with proliferation and apoptosis markers and serves as an independent prognostic factor in gastric cancer. Tumour biology:the journal of the International Society for Oncodevelopmental[J]. Biol Med,2010,31(1):1-7.
[9] Zhu KX, Li YM, Li X, et al. Study on the association of COX-2 genetic polymorphisms with risk of gastric cancer in high incidence Hexi area of Gansu province in China[J]. Mol Biol Rep,2011,38(1):649-655.
[10] Goodman JI, Watson RE. Altered DNA methylation:a secondary mechanism involved in carcinogenesis[J]. Annu Rev Pharmacol Toxicol,2002,42:501-525.
[11] Suzuki S, Sasajima K, Sato Y, et al. MAGE-A protein and MAGE-A10 gene expressions in liver metastasis in patients with stomach cancer[J]. Br J Cancer,2008,99(2):350-356.
[12] Kuwahara A, Katano M, Nakamura M, et al. Expression of melanoma antigen-encoding gene-1 predicts lymph node involvement in early gastric carcinomas[J]. Dig Dis Sci,2001,46(2):262-267.
[13] Ogata K, Aihara R, Mochiki E, et al. Clinical significance of melanoma antigen-encoding gene-1(MAGE-1) expression and its correlation with poor prognosis in differentiated advanced gastric cancer[J]. Ann Surgic Oncol,2011,18(4):1195-1203.
[2] Wang D, Dubois RN. Prostaglandins and cancer[J]. Gut,2006,55(1):115-122.
[3] Oshima H, Oshima M, Inaba KT,et al. Hyperplastic gastric tumors induced by activated macrophages in COX-2/mPGES-1 transgenic mice[J]. EMBO J,2004,23(7):1669-1678.
[4] van der Bruggen P, Traversari C, Chomez P, et al. A gene encoding an antigen recognized by cytolytic T lymphocytes on a human melanoma[J]. Science,1991,254(5038):1643-1647.
[5] Itoh K, Hayashi A, Nakao M, et al. Human tumor rejection antigens MAGE[J]. J Biochem,1996,119(3):385-390.
[6] Lucas S, De Smet C, Arden KC, et al. Identification of a new MAGE gene with tumor-specific expression by representational difference analysis[J]. Cancer Res,1998,58(4):743-752.
[7] Wang D, Dubois RN. The role of COX-2 in intestinal inflammation and colorectal cancer[J]. Oncogene,2010,29(6):781-788.
[8] Mrena J, Wiksten JP, Kokkola A, et al. COX-2 is associated with proliferation and apoptosis markers and serves as an independent prognostic factor in gastric cancer. Tumour biology:the journal of the International Society for Oncodevelopmental[J]. Biol Med,2010,31(1):1-7.
[9] Zhu KX, Li YM, Li X, et al. Study on the association of COX-2 genetic polymorphisms with risk of gastric cancer in high incidence Hexi area of Gansu province in China[J]. Mol Biol Rep,2011,38(1):649-655.
[10] Goodman JI, Watson RE. Altered DNA methylation:a secondary mechanism involved in carcinogenesis[J]. Annu Rev Pharmacol Toxicol,2002,42:501-525.
[11] Suzuki S, Sasajima K, Sato Y, et al. MAGE-A protein and MAGE-A10 gene expressions in liver metastasis in patients with stomach cancer[J]. Br J Cancer,2008,99(2):350-356.
[12] Kuwahara A, Katano M, Nakamura M, et al. Expression of melanoma antigen-encoding gene-1 predicts lymph node involvement in early gastric carcinomas[J]. Dig Dis Sci,2001,46(2):262-267.
[13] Ogata K, Aihara R, Mochiki E, et al. Clinical significance of melanoma antigen-encoding gene-1(MAGE-1) expression and its correlation with poor prognosis in differentiated advanced gastric cancer[J]. Ann Surgic Oncol,2011,18(4):1195-1203.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 杨晓峰 | |
| 梁婷 | |
| PubMed | |
| Article by YANG Xiao-feng | |
| Article by LIANG Ting | |