1. West China School of Public Health Sichuan University, Chengdu 610041, Sichuan, China;
2. State Key Laboratory for Communicable Disease Control and Prevention, Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
Establishment and application of pulsed-field gel electrophoresis assay to screen plasmid from bacteria
GUAN Hong1,2, QIN Tian2, ZHOU Hai-jian2, REN Hong-yu2, DUAN Yong-xiang2, XU Xin2, SHAO Zhu-jun2
Abstract
Objective Based on conventional pulsed-field gel electrophoresis(PFGE),we established a modified assay to screen plasmids of bacteria and applied it in the screening of Legionella plasmids. Methods L. dumoffii strains with and without plasmid were used for the optimization of the treatment parameters, cell suspension density, content of proteinase K and its action time, wash times were adjusted, then the best conditions were chosen. Results Compared with conventional PFGE assay, the procedure of our assay was without restriction digestion. Intact plasmid DNA and chromosome DNA could therefore be kept in the agarose plug without being denatured and breakage. Plasmid DNA and chromosome DNA can be separated by the electrophoresis. Conclusion Modified PFGE processes is more accurate and rapid than conventional assay and could be applied in the screening of plasmids of bacteria.
利用脉冲场凝胶电泳筛选质粒方法的建立和应用
关红1,2, 秦天2, 周海建2, 任红宇2, 段永翔2, 许欣2, 邵祝军2
1. 四川大学公共卫生学院医学检验教研室,四川 成都 610041;
2. 中国疾病预防控制中心传染病预防控制所传染病预防控制国家重点实验室,北京 102206
2. 中国疾病预防控制中心传染病预防控制所传染病预防控制国家重点实验室,北京 102206
摘要
目的 改良及优化常规脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE)方法,建立基于PFGE技术筛选细菌质粒方法,并用于军团菌质粒的筛选。 方法 使用含有质粒的杜莫氏军团菌及其质粒消除株对常规PFGE方法进行条件优化,调整细菌菌悬液浓度,蛋白酶K用量及作用时间,胶块清洗时间和次数,胶块不经过酶切直接进行PFGE,染色成像后选择能形成条带清晰脱尾较少的最优条件。 结果 去除常规PFGE方法中酶切步骤并优化裂解和清洗条件能使细菌DNA完整保留在胶块中,经过PFGE后,质粒DNA和染色体DNA在琼脂糖凝胶上能被很好的区分。 结论 该方法较常规方法更为快速可靠,可用于细菌质粒图谱的快速筛选。
内容大纲
-
1 材料与方法
2 结果
- 2.1 PFGE用于质粒检测的验证
- 2.2 PFGE检测质粒条件的优化
- 2.3 改良PFGE方法用于军团菌质粒筛选的应用
细菌质粒图谱的建立,通常是基于细菌质粒的提取和琼脂糖凝胶电泳分析技术。目前实验室常采用质粒提取方法包括:氯化铯密度梯度离心法、碱裂解法、煮沸法,及基于碱裂解法的商品化试剂盒等,但是这些提取方法存在一些问题。首先,对于一种细菌,判断细菌含有质粒与否以及质粒数量至关重要,且并非所有细菌都含有质粒结构,尤其对大量细菌进行质粒研究时,需要质粒检测方法具有较高的敏感性、可靠性,并且易于操作;其次,目前提取质粒的方法多关注小质粒提取,并不适合大质粒的提取;此外,碱裂解等质粒提取方法会导致质粒DNA变性或断裂,使得低拷贝质粒和大质粒的提取和确认变得困难[1]。
针对以上质粒研究中存在的现实问题,笔者在前期对于杜莫氏军团菌(Legionella dumoffii)66 kb大质粒[2]的研究以及脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE)用于军团菌分子分型研究的基础上 ,使用TEX-KL杜莫氏军团菌作为模式菌建立PFGE筛选检测质粒的技术方法,并应用于军团菌属细菌质粒的筛选。现报道如下。
1 材料与方法
1.1 菌株来源 TEX-KL杜莫氏军团菌(ATCC 33343)含有一个66.5 kb 的质粒pLD-TEX-KL和一个126.5 kb的质粒pLDTK;TEX-KL杜莫氏军团菌pLD-TEX-KL质粒消除菌株,标记为L.dumoffii P-。8株不同血清群的军团菌菌株均为本实验室保藏菌株。沙门菌Braenderup血清型菌株H9812作为PFGE分子质量标准[5]。
1.2 主要材料和设备
脉冲场凝胶电泳仪(Bio Rad CHEF DRⅢ system,美国);凝胶成像仪(Bio Rad Gel Doc XR,美国);比浊仪(bioMerieux DENSIMAT,法国);XbaⅠ(TaKaRa,大连);AscⅠ(New England Biolabs,Ipswich,美国) ;SeaKem@ Gold agarose(Lonza, Rockland, 美国);质粒提取试剂盒(Qiagen,德国);5×TBE(Tiangen,中国)。
1.3 方法
基于传统PFGE方法步骤,本方法对胶块制备的菌悬液浓度、细胞裂解蛋白酶K浓度、细胞裂解时间、酶切步骤和上样电泳5个方面进行改良。
1.3.1 质粒提取
杜莫氏军团菌于BCYE平板上生长18~24 h后,接种于200 ml BYE液体培养基内,37 ℃振荡培养过夜。低温5000 r/min离心10 min收集细菌,根据质粒提取试剂盒说明说提取质粒。
1.3.2 PFGE胶块制备方法改良
改良方法参考本实验室报道的军团菌PFGE分型方法[3]。刮取BCYE平板上过夜培养的新鲜菌株,均匀悬浮于1 ml细胞悬浮液(CSB),在比浊仪上调整至不同的菌悬液浓度(菌悬液浓度=5.5、6.0、6.5、7.0、7.5)。取400 μl菌悬液,加入蛋白酶K使其终浓度为0.5 mg/ml,再加入400 μl 56 ℃预热的l%Seakem Gold:1%SDS胶,混匀加入模具制备胶块。细胞裂解液(CLB)内加入蛋白酶K(终浓度=0.10、0.15、0.20、0.25 mg/ml),将已凝固胶块加入5 ml该溶液,水浴摇床(54 ℃,170 r/min)裂解(裂解时间T=2、2.5、3.0和3.5 h)。倒掉细胞裂解液,水浴摇床(50 ℃,170 r/min)条件下,使用50 ℃预热纯水(15 ml)清洗胶块2次(10 min/次),50 ℃预热TE(15 ml)清洗胶块4次(15 min/次)。
制备含质粒的PFGE胶块,取200 μl质粒,加入200 μl 56 ℃预热的l%Seakem Gold:1%SDS胶,加入模具内制成含有质粒的胶块。 常规军团菌胶块的制备参考本实验室报道的军团菌PFGE分型方法[3]。
1.3.3 酶切方法改良
改良方法制备的PFGE胶块不经酶切步骤直接电泳。
对常规杜莫氏军团菌的胶块和含质粒的胶块,切2 mm宽胶块置于1.5 ml的离心管中,加入200 μl酶切缓冲液,37 ℃水浴中孵育15 min。吸出缓冲液,每管加入200 μl含AscⅠ酶(20 U)的酶切液,37 ℃水浴4 h。
1.3.4 加样方法改良和电泳
对改良方法制备的含杜莫氏军团菌的胶块和含质粒的胶块,切下4 mm厚的胶块,在200 μl 0.5×TBE室温孵育5 min后,放置在梳齿上倒入150 ml 1% Seakem Gold电泳胶封置。
对含质粒的胶块和常规方法制备的含杜莫氏军团菌的胶块,取出离心管,吸出酶切液,加入200 μl 0.5×TBE缓冲液室温平衡5 min,将胶块放置在梳齿上,倒入150 ml 1% SeaKem Gold电泳胶封置。
在CHEF DR Ⅲ电泳仪中进行PFGE。电泳参数为6.8~54.2 s,19 h。电泳结束后染色,在读胶仪中成像,并转换成TIFF图像格式保存。
2 结果
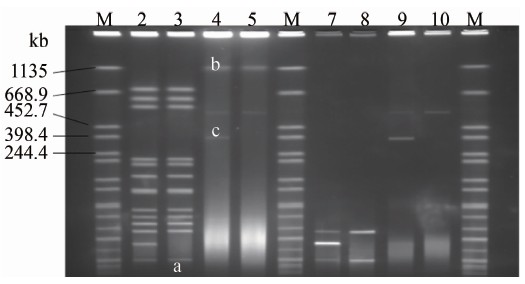
2.1 PFGE用于质粒检测的验证 如图1所示,2~5泳道为含有pLD-TEX-KL质粒和该质粒缺失的杜莫氏军团菌全菌的胶块,分别经过酶切与不酶切两种处理方式后的电泳图谱。2、3泳道为L.dumoffii和L.dumoffii P-两株菌全菌通过常规方法制备的胶块,分别使用AscⅠ酶切后电泳,两者有一个条带的差异(a);4、5泳道为2株菌通过本方法制备的胶块未经酶切直接电泳的图谱,有一个条带差异(c)且条带的分子质量较大;由此推断,a和c即为经过酶切和未经酶切两种状态的pLD-TEX-KL质粒DNA。
7~10泳道为pLD-TEX-KL质粒和该质粒缺失的杜莫氏军团菌所提取的质粒所制备的胶块,分别经过酶切与不酶切两种处理方式后电泳。7、8泳道分别为含有L.dumoffii和L.dumoffii P-两株菌质粒的胶块经AscⅠ酶切后电泳形成的图谱;9、10泳道分别为含有2株菌质粒的胶块未经酶切形成的图谱。9、10泳道图谱与4、5泳道图谱(全菌不酶切)对应、但缺少最上方一个约1135 kb条带的电泳图谱,推断最上方条带即为细菌完整的染色体条带。对比7、8与9、10泳道发现,不酶切的质粒电泳时保持环状,电泳速度较慢,故呈现出比其真实片段大的分子量,66 kb的环状质粒pLD-TEX-KL电泳位置约在沙门菌H9812线状分子360 kb左右;对比2、3和4、5泳道,可知较大的质粒pLDTK有2个酶切位点,较小质粒pLD-TEX-KL有1个酶切位点,两者经酶切后在普通全菌酶切图谱上只能发现1个质粒的差别。
图1 杜莫氏军团菌酶切图谱和质粒图谱
Figure 1 Electrophoresis profile of L.dumoffii strains and their plasmids 注:2:L.dumoffii菌株全菌DNA经AscⅠ酶切; 3:L.dumoffii P-菌株全菌DNA经AscⅠ酶切; 4:L.dumoffii菌株全菌DNA未经酶切; 5:L.dumoffii P-菌株全菌DNA未经酶切; 7:L.dumoffii质粒DNA经AscⅠ酶切; 8:L.dumoffii P-质粒DNA经AscⅠ酶切; 9:L.dumoffii质粒DNA未经酶切; 10:L.dumoffii P-质粒DNA未经酶切;M:H9812; a、c:质粒pLD-TEX-KL; b:质粒pLDTK。
2.2 PFGE检测质粒条件的优化
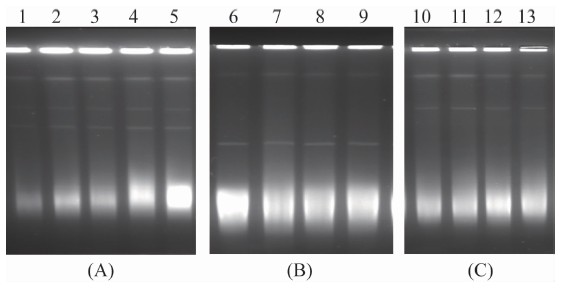
如图2所示,使用不同模式菌对菌悬液浓度、蛋白酶K含量、细胞裂解时间三个条件进行优化。图2(A)中,菌悬液浓度A=5.5、6.0、6.5、7.0、7.5各条件中,菌悬液浓度越高质粒条带越清晰,但泳道下方拖 尾情况也随之加重;图2(B)中,菌悬液浓度A=6.0条件下,蛋白酶K含量C=0.10、0.15、0.20、0.25 mg/ml,可见蛋白酶K含量的改变对拖尾情况改善并不明显;图2(C)中,菌悬液浓度A=6.0,蛋白酶K含量C=0.15 mg/ml条件下,细胞裂解时间T=2、2.5、3.0和3.5 h,可见延长细胞裂解时间对拖尾略有改善,但时间过久则影响质粒条带的亮度。
通过对比,最终选择菌悬液浓度A=6.0,细胞裂解液蛋白酶K含量 C=0.15 mg/ml, 水浴裂解
图2 PFGE检测质粒条件的优化
Figure 2 Optimization of plasmid screening by pulsed-field gel electrophoresis 注:(A)1~5泳道条件CSB蛋白酶K含量=0.10 mg/ml,细胞裂解时间T=2 h,菌悬液浓度A=5.5、6.0、6.5、7.0、7.5; (B)6~9泳道条件细胞裂解时间T=2 h,菌悬液浓度A=6.0,CSB蛋白酶K含量=0.10、0.15、0.20、0.25 mg/ml; (C)10~13泳道条件菌悬液浓度A=6.0,CSB蛋白酶K含量=0.15 mg/ml,细胞裂解时间T=2、2.5、3.0和3.5 h。(A)、(B)、(C)各泳道均为全菌DNA未经酶切处理后电泳条带。
该条件制备的胶块脉冲场电泳后能形成条带清晰,拖尾较少的图谱。改良后方法与常规PFGE方法区分见表1。
2.3 改良PFGE方法用于军团菌质粒筛选的应用
如图3所示,应用改良PFGE筛选本实验室保存的军团菌属不同血清型的军团菌,质粒条带清晰且区分良好。可见军团菌所含质粒基本为大质粒。泳道1所含4个大质粒中较小的两个分子质量相差较小,即使通过19 h电泳后两条带依然相距不远。
图3 改良PFGE方法筛选军团菌标准菌株电泳图谱
Figure 3 Electrophoresis profile of Legionella strains by modified PFGE assay 注:1: L.bozemanii(ATCC 33217); 2: L.quinlivanii(ATCC 43830); 3: L.rubrilucens(ATCC 35304); 4: L.jamestowniensis(ATCC 35298); 5: L.dumoffii(ATCC 33279); 6: L.longbeachae(ATCC 33484); 7: L.feeleii(ATCC 35849); M:H9812。
表1 常规PFGE方法与改良方法的区别
Table 1 Comparison of reagents and conditions between conventional and modified assays
| 方法比较 | 菌悬液浓度(A) | 蛋白酶K浓度(mg/ml) | 细胞裂解条件 | 酶切 | 胶条厚度(mm) |
| 常规方法 | 3.8~4.4 | 0.10 | 54 ℃ 水浴摇床(170 r/min)内孵育2 h | AscⅠ (20 U),37 ℃,4 h | 2 |
| 改良方法 | 5.8~6.3 | 0.15 | 54 ℃ 水浴摇床(170 r/min)内孵育2.5 h | 不酶切,200 μl 0.5×TBE内室温孵育5 min | 4 |
3 讨论
常见的质粒提取验证包括3个步骤:细胞裂解、提取质粒DNA、去除杂质,普通琼脂糖电泳验证。最常见的碱变性法,是根据共价闭合环状质粒DNA与线性染色体DNA片段之间在拓扑学上的差异而发展出来的。碱变性法在提取过程中局部极端pH值的变化[6](高于pH 12.5)和机械混匀可能会将染色体DNA和质粒DNA打断形成较小的DNA片段[7]。这种方法对大质粒提取较为困难,受损的质粒DNA和染色体小片段易影响结果判断。此外,普通琼脂糖电泳对大片段尤其是分子质量差别较小的大片段的分离效果远不如PFGE。而应用PFGE方法将细菌包埋于琼脂块中,蛋白酶裂解细胞后将
细胞碎片等杂质冲洗掉,完整保留了染色体和质粒DNA,不存在DNA断裂形成的杂带。本方法将完整的细菌DNA视为分子质量较大的“片段”即染色体DNA和分子质量较小的“片段”即质粒DNA,电泳将其分离形成质粒图谱。PFGE时间长,对大片段的分离效果好,质粒筛选更为准确。
本方法适用于质粒的筛选确认,尤其是对大质粒、低拷贝质粒及未知菌株质粒的筛查具有优势。前期有文章报道,TEX-KL杜莫氏军团菌通过碱裂解法大量抽提质粒、氯化铯密度梯度离心法浓缩质粒、普通琼脂糖凝胶电泳检测,发现一个66 kb的质粒即质粒pLD-TEX-KL[2]。但全基因组测序显示该菌同时携带一个126.5 kb的大质粒[8]。根据本方法发现该菌电泳泳道上有2条清晰的质粒条带,即该菌携带2个大小不同的质粒,与全基因组测序结果一致。
本研究通过对菌悬液浓度的调整发现,浓度较低时质粒条带相对较浅不易观察,而浓度过高则易产生拖尾影响判断,最终选择菌悬液浓度A=6.0。随菌悬液浓度的增加,蛋白酶K对菌体蛋白质的裂解效率可能有所下降造成蛋白裂解不完全,而形成拖尾现象。因此,蛋白酶K的用量和作用时间相应提高。而图2显示,过高的蛋白酶浓度和过长的作用时间又导致DNA降解、质粒条带变浅现象,故选择应用条件为蛋白酶K浓度0.15 mg/ml、54 ℃ 水浴摇床(170 r/min)内孵育2.5 h。
军团菌现已报道的质粒均为60 kb以上大质粒,因此本方法应用于军团菌质粒筛选的电泳时间设为19 h有利于大质粒的分离观察,而对于质粒分子质量较小的菌种则可 适当减少脉冲时间。本方法 可同时进行含有大肠埃希菌V517的胶块电泳,建立线性回归方程以估算目标菌株的质粒大小。但目前尚不能根据沙门菌H9812的线性DNA片段计算质粒分子质量,有待进一步研究。常规PFGE方法一般需2 d时间完成实验,第3天结果观察,而本方法省略常规方法第2天长达3~4 h的限制性内切酶酶切步骤,将实验时间从2天缩短到8 h以内。同时,相比于传统质粒提取、琼脂糖电泳验证实验,本方法步骤比较简便,更适用于大规模未知质粒筛查和质粒谱的建立。PFGE是细菌分子分型的常用方法,其应用限制性内切酶将细菌DNA消化成大小不等的片段,经电泳将片段分离得到酶切图谱。质粒pLD-TEX-KL是接合性质粒,可在细菌间转移,该类质粒的丢失与获得都将造成酶切图谱的变化。PFGE用于质粒的筛选,对于PFGE用于菌株的聚类分析是一个很好的补充和说明。PFGE作为一种分辨力强的分型方法在军团菌分子分型中广泛应用,具有良好的实验室基础。本方法对军团菌质粒的筛选快速准确,适用于一般实验室。
参考文献
[1] Hu CS, Zhang QL, Lu YX, et al. A continuous cell alkaline lysis, neutralization, and clarification combination process for production of plasmid pUDKHGF [J]. Biotechnol Appl Biochem,2011,58(3):162-165.
[2] Qin T, Iida KI, Hirakawa H, et al. Conjugative plasmid PLDTEXKL promoters growth of host bacterium Legionella dumoffii at low temperatures[J]. Arch Microbiol,2009,191(6):543-551.
[3] Zhou HJ, Ren HY, Zhu BQ, et al. Optimization of PulsedField Gel Electrophoresis for Legionella pneumophila Subtyping[J]. Appl Environ Microbiol,2010,76(5):1334-1340.
[4] Qin T, Ren HY, Zhou HJ, et al. Molecular typing of Legionella pneumophila isolates from China with pulsedfield gel electrophoresis [J]. Chinese Journal of Epidemiology,2011,32(3):285-289.(in Chinese)秦天,任红宇,周海健,等. 中国嗜肺军团菌分离株脉冲场凝胶电泳分型分析以及数据库的建[J]. 中华流行病学杂志,2011,32(3):285-289.
[5] Hunter SB, Vauterin P, LambertFair MA, et al. Establishment of a universal size standard strain for use with the PulseNet standardized pulsedfield gel electrophoresis protocols: converting the national databases to the new size standard[J]. J Clin Microbiol,2005,43(3):1045-1050.
[6] Birnboim HC, Doly J. A rapid alkaline extraction procedure for screening recombinant plasmid DNA[J]. Nucleic Acids Res,1979,7(6):1513-1523.
[7] Cai Y, Rodriguez S, Hebel H. DNA vaccine manufacture: scale and quality[J]. Expert Rev Vaccines,2009,8(9):1277-1291.
[8] Qin T, Cui YJ, Cen ZH, et al. Genome announcements draft genome sequences of two Legionella dumoffii Strains, TEXKL and NY23[J]. J Bacteriol March,2012,194(5):1251-1252.
[2] Qin T, Iida KI, Hirakawa H, et al. Conjugative plasmid PLDTEXKL promoters growth of host bacterium Legionella dumoffii at low temperatures[J]. Arch Microbiol,2009,191(6):543-551.
[3] Zhou HJ, Ren HY, Zhu BQ, et al. Optimization of PulsedField Gel Electrophoresis for Legionella pneumophila Subtyping[J]. Appl Environ Microbiol,2010,76(5):1334-1340.
[4] Qin T, Ren HY, Zhou HJ, et al. Molecular typing of Legionella pneumophila isolates from China with pulsedfield gel electrophoresis [J]. Chinese Journal of Epidemiology,2011,32(3):285-289.(in Chinese)秦天,任红宇,周海健,等. 中国嗜肺军团菌分离株脉冲场凝胶电泳分型分析以及数据库的建[J]. 中华流行病学杂志,2011,32(3):285-289.
[5] Hunter SB, Vauterin P, LambertFair MA, et al. Establishment of a universal size standard strain for use with the PulseNet standardized pulsedfield gel electrophoresis protocols: converting the national databases to the new size standard[J]. J Clin Microbiol,2005,43(3):1045-1050.
[6] Birnboim HC, Doly J. A rapid alkaline extraction procedure for screening recombinant plasmid DNA[J]. Nucleic Acids Res,1979,7(6):1513-1523.
[7] Cai Y, Rodriguez S, Hebel H. DNA vaccine manufacture: scale and quality[J]. Expert Rev Vaccines,2009,8(9):1277-1291.
[8] Qin T, Cui YJ, Cen ZH, et al. Genome announcements draft genome sequences of two Legionella dumoffii Strains, TEXKL and NY23[J]. J Bacteriol March,2012,194(5):1251-1252.