Etiology and molecular epidemiology of Vibrio parahaemolyticus in Pudong, Shanghai
ZHANG Hong-hong1, ZHU Lin-ying1, PAN Li-feng1, CHEN Hong-you2, SU Jing-hua1, FU Hui-qin1, HUANG Hong1, SUN Qiao1, FU Yi-fei1, WANG Wen-qing1, LI Jian2, LIAN Wei-gang1, YANG Ling-feng1
Pudong New District Center for Disease Control and Prevention, Shanghai, Shanghai 200136, China
Abstract
Objective To understand the etiological and molecular epidemiological characteristics of Vibrio parahaemolyticus in Pudong new district. Methods Serotyping was conducted for 505 V. parahaemolyticus isolates by using slide serum agglutination test. The drug susceptibility of the isolates to 12 antibiotics was performed by using K-B method. PFGE molecular subtyping was done after the genome DNA digested by restriction enzyme NotI. PFGE pattern clustering analysis was conducted by using BioNumerics Version 6.64. Results The serotyping of 117 of 505 isolates failed. Serotype O3:K6 was predominant in isolates from food poisoning samples (69.14%) and samples from sporadic infection cases (61.87%). No predominant serotype was detected in food samples collected in routine surveillance. In these isolates, 502 (99.41%) were resistant to ampicillin. And in these isolates, 221 PFGE patterns were detected, the PFGE typing failed for 26 isolates. No predominant PFGE pattern was detected in food samples from routine surveillance and the PFGE patterns of these isolates differed with those of the isolates from food poisoning samples and sporadic infection samples. The isolates from food poisoning samples and sporadic infection samples shared the same predominant PFGE patterns. The PFGE patterns of the isolates which were resistant to ≥2 antibiotics differed with those of other isolates. The isolates with same PFGE pattern shared same serotype. Same PFGE patterns were detected in different time or at different surveillance sites. Conclusion No multi-drug resistant isolate of V. parahaemolyticus was detected in Pudong. There were clustering of the infection, but the isolates from these infections had far genetic distance with the isolates from routine surveillance.
Keywords:
Vibrio parahaemolyticus
pulse-field gel electrophoresis
molecular subtyping
serotyping
drug resistance
上海市浦东新区副溶血弧菌病原学与分子流行病学特征分析
章红红1, 朱林英1, 潘丽峰1, 陈洪友2, 苏靖华1, 傅慧琴1, 黄红1, 孙乔1, 傅益飞1, 王闻卿1, 黎健2, 连伟刚1, 杨玲凤1
1. 浦东新区疾病预防控制中心, 上海 浦东 200136;
2. 上海市疾病预防控制中心
2. 上海市疾病预防控制中心
摘要
目的 了解上海市浦东新区副溶血弧菌病原学与分子流行病学特征。 方法 运用玻片凝集法对505株副溶血弧菌菌株进行血清学分型,运用K-B纸片法对菌株进行12种抗生素药敏试验,同时对菌株基因组DNA经限制性内切酶NotⅠ酶切后进行脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)分子分型,利用BioNumerics Version 6.64 分析软件对图谱进行聚类分析,初步建立PFGE分子分型数据库。 结果 505株菌株中有117株血清型未能分型,O3:K6为患者分离株中的优势血清型,其中69.14%(56/81)的食物中毒分离株和61.87%(185/299)的散发病例分离株血清型为O3:K6型;监测食品分离株血清型分布呈现多样性,无优势菌株。99.41%(502/505)菌株对氨苄西林耐药。505株菌株共获得221个不同的PFGE带型,有26株PFGE未能分型。监测食品分离株的PFGE呈现遗传多样性,无优势带型,并且与散发及食物中毒患者分离株的PFGE带型不同。食物中毒与散发病例分离株的优势带型相同。耐2种或以上抗生素的菌株与其他菌株的PFGE型不相同,相同PFGE带型内的菌株血清型相同,不同时间、不同腹泻监测点之间存在完全相同PFGE条带。 结论 浦东新区未出现多重耐药菌株,存在多起疑似聚集性病例事件,但与监测食品分离株的遗传谱系关系较远。
内容大纲
1 材料与方法
1.1 材料 1.1.1 菌株
实验菌株共505株,分离自浦东新区2010-2011年的散发病例299株、食物中毒81株、监测食品样本125株,其中2010年有318株菌(散发病例151株,食物中毒62株,监测食品105株),2011年有187株(散发病例148株,食物中毒19株,监测食品20株)。散发病例分离株来源于浦东新区19个腹泻监测点(仁济、东方、南中心、七院、公利、浦南、浦人医、泥城、沪东、金杨、花木、机场镇、大团、祝桥、周浦、高东、潍坊、航头、三林),食物中毒分离株来源于食品与药品监督所(FDA)送检的食物中毒标本,监测食品分离株来源于3个监测点(世博、临江、沪东)。作为PFGE实验分子质量标准对照的布伦卢普沙门菌(Salmonella braenderup,H9812)和药敏质控菌株大肠埃希菌ATCC25922,由上海市疾病预防控制中心(CDC)微生物实验室提供。
1.1.2 主要试剂
MH琼脂(OXOID), 药敏纸片(OXOID), O 抗原、 K 抗原诊断血清(日本生研株式会社), 蛋白酶K(Promega),限制性内切酶NotⅠ、XbaⅠ(TaKaRa),SeaKem Gold Agarose(Cambrex),10× TBE(BIO-RAD)。均在有效期内按试剂说明使用。
1.1.3 主要仪器
水浴箱(37 ℃、56 ℃),56 ℃水浴摇床,菌液比浊仪(BioMerieux),脉冲场凝胶电泳仪(Bio-Rad CHEF Mapper), 凝胶成像系统(Bio-Rad Chemic Doc XRS+),BioNumerics分析软件(BioNumerics Version 6.64)。
1.2 方法
1.2.1 菌株分离及鉴定
按照《食品卫生微生物学检验 副溶血性弧菌检验》(GB/T 4789.7-2008)和《感染性腹泻诊断标准》(WS 271-2007)进行。标本放入碱性蛋白胨水增菌液,37 ℃培养8 h后分离至科玛嘉弧菌显色平板上,37 ℃培养18~24 h,挑取紫红色菌落进行革兰染色、氧化酶试验,将可疑菌落制备成0.5麦氏单位的细菌悬液,用API-20NE进行系统生化鉴定,为副溶血弧菌。
1.2.2 O抗原检测
在3%氯化钠营养琼脂上挑取副溶血弧菌放入1 ml的3%氯化钠溶液中,制成浓厚的细菌悬液,121 ℃ 2 h后离心15 min(4000 r/min),弃上清液,再加入3%氯化钠溶液混匀,离心15 min(4000 r/min),弃上清液,重复2次后,进行O抗原血清玻片凝集试验。同时应用3%氯化钠溶液做自然凝集对照试验。
1.2.3 K抗原检测
在3%氯化钠营养琼脂上挑取少量副溶血弧菌,用K多价和单因子血清做血清玻片凝集试验。同时应用3%氯化钠溶液做自然凝集对照试验。
1.2.4 药敏试验
采用CLSI推荐的Kirby-Bauer法,12种药敏纸片分别为氨苄西林(Ampicillin,AMP)、阿莫西林/克拉维酸(Amoxycillin/clavulanic acid, AMC)、头孢噻肟(Cefotaxime, CTX)、头孢他啶(Ceftazidime,CAZ)、头孢吡肟(Cefepime, FEP)、阿米卡星(Amikacin, AK)、庆大霉素(Gentamicin, CN)、四环素(Tetracycline,TE)、环丙沙星(Ciprofloxacin, CIP)、左氧氟沙星(Levofloxacin, LEV)、氯霉素(Chloramphenicol, C)、复方新诺明(Sulphamethoxazole/trimethoprim, SXT)。
1.2.5 PFGE
参照美国CDC公布的PulseNet PFGE分子分型标准化实验室操作[2],进行胶条的制备、胶条中细菌的裂解、裂解后的洗涤,用NotⅠ进行酶切,分子质量标记H9812用 XbaⅠ酶切,脉冲10~35 s,电泳18 h,用0.03%的Gel-Red染色30 min,用超纯水脱色1 h,成像仪内获得凝胶图像,运用BioNumerics Version 6.64分析软件对图谱进行聚类分析。
2 结果
2.1 血清学鉴定结果 所有菌株均未出现自凝现象, 505株菌株中有117株未能分型,其中5株菌株“O”群未能分型,112株“K”型未能定型,分别占散发病例、食物中毒、监测食品分离株的7.69%(23/299)、9.88%(8/81)和68.80%(86/125)。505株副溶血弧菌血清型分布情况见表1。
表1 505株副溶血弧菌血清型分布情况(1)
Table 1 Serotype of 505 V. parahaemolyticus isolates
| 血清型 | 2010年 | 2011年 | 合计 | |||||
| 散发病例 | 食物中毒 | 监测食品 | 散发病例 | 食物中毒 | 监测食品 | |||
| O3 ∶ K6 | 88 | 46 | 1 | 97 | 10 | 242 | ||
| O4 ∶ K8 | 18 | 3 | 3 | 24 | ||||
| O1 ∶ K56 | 16 | 1 | 17 | |||||
| O3 ∶ K29 | 7 | 2 | 9 | |||||
| O1 ∶ K36 | 6 | 3 | 3 | 2 | 14 | |||
| O1 ∶ KUT | 4 | 1 | 16 | 4 | 2 | 27 | ||
| O4 ∶ K68 | 3 | 1 | 2 | 6 | ||||
| O4 ∶ K9 | 2 | 2 | 9 | 4 | 17 | |||
| O11 ∶ KUT | 2 | 2 | 6 | 1 | 1 | 12 | ||
| O10 ∶ KUT | 1 | 2 | 16 | 2 | 1 | 22 | ||
| OUT ∶ K3 | 1 | 1 | 2 | |||||
| O1 ∶ K25 | 1 | 1 | 2 | |||||
| O3 ∶ K51 | 1 | 1 | ||||||
| O8 ∶ KUT | 1 | 1 | 2 | |||||
| O8 ∶ K41 | 1 | 9 | 10 | |||||
| O3 ∶ KUT | 9 | 3 | 3 | 4 | 19 | |||
| O8 ∶ K21 | 2 | 2 | ||||||
| O2 ∶ K33 | 1 | 1 | ||||||
| O2 ∶ KUT | 6 | 1 | 7 | |||||
| O3 ∶ K7 | 2 | 1 | 1 | 4 | ||||
| O4 ∶ K13 | 1 | 1 | ||||||
| O4 ∶ K55 | 1 | 1 | ||||||
| O5 ∶ K15 | 1 | 1 | 2 | |||||
| O5 ∶ KUT | 10 | 1 | 2 | 13 | ||||
| O1 ∶ K32 | 2 | 2 | ||||||
| O1 ∶ K33 | 1 | 1 | ||||||
| O1 ∶ K37 | 2 | 2 | ||||||
| O10 ∶ K24 | 1 | 1 | ||||||
| O11 ∶ K5 | 1 | 1 | ||||||
| O11 ∶ K61 | 2 | 2 | ||||||
| O2 ∶ K28 | 3 | 3 | ||||||
| O2 ∶ K3 | 6 | 1 | 7 | |||||
| O3 ∶ K31 | 1 | 1 | ||||||
| O3 ∶ K45 | 1 | 1 | ||||||
| O3 ∶ K5 | 1 | 1 | ||||||
| O3 ∶ K56 | 1 | 1 | ||||||
| O4 ∶ K29 | 1 | 1 | ||||||
| O4 ∶ K34 | 1 | 2 | 3 | |||||
| O4 ∶ K63 | 1 | 1 | 2 | |||||
| O4 ∶ KUT | 5 | 3 | 8 | |||||
| O5 ∶ K17 | 1 | 2 | 3 | |||||
| O5 ∶ K30 | 1 | 1 | ||||||
| O6 ∶ KUT | 2 | 2 | ||||||
| O8 ∶ K20 | 1 | 1 | ||||||
| O8 ∶ K70 | 1 | 1 | ||||||
| OUT ∶ KUT | 2 | 1 | 3 | |||||
| 合计 | 151 | 62 | 105 | 148 | 19 | 20 | 505 | |
2.1.1 监测食品分离株
监测食品分离株的血清型分布均呈现多样性,O3 ∶ K6型仅为1株。2010年居前2位的血清型别为O2 ∶ K3(5.71%)和O2 ∶ K28(2.86%),O3 ∶ K7、O1 ∶ K37、O11 ∶ K61和O4 ∶ K34(1.90%)血清型并列第3位;2011年O5 ∶ K17(10.00%)血清型占首位,O1 ∶ K25、O3 ∶ K7、O2 ∶ K3和O3 ∶ K56(5.00%)血清型并列第2位。
2.1.2 食物中毒分离株
69.13%(56/81)的分离株为O3 ∶ K6型,2010年居前3位的血清型别为O3 ∶ K6(74.19%)、O4 ∶ K8(4.84%)和O1 ∶ K36(4.84%),2011年为O3 ∶ K6(52.63%)、O4 ∶ K9(21.05%)和O1 ∶ K36(10.53%)。2年中均出现的血清型为O3 ∶ K6、O1 ∶ K36和O4 ∶ K9。
2.1.3 散发病例分离株
61.87%(185/299)的分离株为O3 ∶ K6型,2010年居前3位的血清型别为O3 ∶ K6(58.28%)、O4 ∶ K8(11.92%)和O1 ∶ K56(10.60%),2011年为O3 ∶ K6(65.54%)、O4 ∶ K9(6.08%)和O8 ∶ K41(6.08%)。2年中均出现的血清型为O3 ∶ K6、O4 ∶ K8、O1 ∶ K56、O3 ∶ K29、O1 ∶ K36、O4 ∶ K8和O4 ∶ K9。2010-2011年患者分离株的优势血清型为O3 ∶ K6型。
2.2 药敏结果
见表2,表3。505株菌株对氨苄西林的耐药率为99.14%(502/505),对其余抗生素均有较高敏感性。2010年分离株的耐药率与2011年相似,但2011年的分离株对阿米卡星、庆大霉素、环丙沙星的敏感率低于2010年。耐2种或以上抗生素的菌株有8株,其中1株(监测食品)对氨苄西林、四环素、环丙沙星耐药,为多重耐药菌株,7株对氨苄西林、阿米卡星耐药。
2.3 副溶血弧菌PFGE分子分型结果
505株菌株经限制性内切酶NotⅠ酶切后进行PFGE,所获得片段的分子质量介于20~700 kb,其中26株菌株未能分型(散发病例9株,食物中毒16株,监测食品1株),其他各菌株(包括“O”、“K”抗原未能鉴定的菌株)基因组DNA片段分离良好。相似性系数为100%的是同一带型,有1条或以上条带差异为不同带型。479株菌株共获得221个PFGE带型,分别标记为K16N11.PD0001—K16N11.PD0221。
2.3.1 监测食品分离株
可分型的124株监测食品分离株共获得120个带型,其中4个型各有2株菌株,其余各型均分别只有1株菌株,无优势带型,呈现遗传多样性,并且未得到与散发病例或食物中毒分离株相同的PFGE带型。在5株与当年散发病例或食物中毒来源的具有相同 血清型的菌株中,食
表2 2010年副溶血弧菌药敏结果
Table 2 Results of drug susceptibility test of V. parahaemolyticus isolates in 2010
| 抗生素 | 散发病例 | 食物中毒 | 监测食品 | |||||||||||||||||||||||
| 耐药 | 中等敏感 | 敏感 | 耐药 | 中等敏感 | 敏感 | 耐药 | 中等敏感 | 敏感 | ||||||||||||||||||
| 株数 | 构成比(%) | 株数 | 构成比(%) | 株数 | 构成比(%) | 株数 | 构成比(%) | 株数 | 构成比(%) | 株数 | 构成比(%) | 株数 | 构成比(%) | 株数 | 构成比(%) | 株数 | 构成比(%) | |||||||||
| AMP | 151 | 100.00 | 0 | 0.00 | 0 | 0.00 | 62 | 100.00 | 0 | 0.00 | 0 | 0.00 | 103 | 98.10 | 0 | 0.00 | 2 | 1.90 | ||||||||
| AMC | 0 | 0.00 | 0 | 0.00 | 151 | 100.00 | 0 | 0.00 | 0 | 0.00 | 62 | 100.00 | 0 | 0.00 | 0 | 0.00 | 105 | 100.00 | ||||||||
| ATX | 0 | 0.00 | 3 | 1.32 | 148 | 98.68 | 0 | 0.00 | 0 | 0.00 | 62 | 100.00 | 0 | 0.00 | 0 | 0.00 | 105 | 100.00 | ||||||||
| CAZ | 0 | 0.00 | 0 | 0.00 | 151 | 100.00 | 0 | 0.00 | 0 | 0.00 | 62 | 100.00 | 0 | 0.00 | 0 | 0.00 | 105 | 100.00 | ||||||||
| FEP | 0 | 0.00 | 0 | 0.00 | 151 | 100.00 | 0 | 0.00 | 0 | 0.00 | 62 | 100.00 | 0 | 0.00 | 0 | 0.00 | 105 | 100.00 | ||||||||
| AK | 0 | 0.00 | 23 | 15.23 | 128 | 84.77 | 0 | 0.00 | 11 | 17.74 | 51 | 82.26 | 0 | 0.00 | 2 | 1.90 | 103 | 98.10 | ||||||||
| CN | 0 | 0.00 | 6 | 3.97 | 145 | 96.03 | 0 | 0.00 | 1 | 1.61 | 61 | 98.39 | 0 | 0.00 | 1 | 0.95 | 104 | 99.05 | ||||||||
| TE | 0 | 0.00 | 0 | 0.00 | 151 | 100.00 | 0 | 0.00 | 0 | 0.00 | 62 | 100.00 | 1 | 0.95 | 0 | 0.00 | 104 | 99.05 | ||||||||
| CIP | 0 | 0.00 | 24 | 15.89 | 127 | 84.11 | 0 | 0.00 | 4 | 6.45 | 58 | 93.55 | 1 | 0.95 | 0 | 0.00 | 104 | 99.05 | ||||||||
| LEV | 0 | 0.00 | 1 | 0.66 | 150 | 99.34 | 0 | 0.00 | 0 | 0.00 | 62 | 100.00 | 0 | 0.00 | 1 | 0.95 | 104 | 99.05 | ||||||||
| C | 0 | 0.00 | 0 | 0.00 | 151 | 100.00 | 0 | 0.00 | 0 | 0.00 | 62 | 100.00 | 0 | 0.00 | 0 | 0.00 | 105 | 100.00 | ||||||||
| SXT | 0 | 0.00 | 0 | 0.00 | 151 | 100.00 | 0 | 0.00 | 0 | 0.00 | 62 | 100.00 | 0 | 0.00 | 1 | 0.95 | 104 | 99.05 | ||||||||
表3 2011年副溶血弧菌药敏结果
Table 3 Results of drug susceptibility test of V. parahaemolyticus isolates in 2011
| 抗生素 | 散发病例 | 食物中毒 | 监测食品 | |||||||||||||||||||||||
| 耐药 | 中等敏感 | 敏感 | 耐药 | 中等敏感 | 敏感 | 耐药 | 中等敏感 | 敏感 | ||||||||||||||||||
| 株数 | 构成比(%) | 株数 | 构成比(%) | 株数 | 构成比(%) | 株数 | 构成比(%) | 株数 | 构成比(%) | 株数 | 构成比(%) | 株数 | 构成比(%) | 株数 | 构成比(%) | 株数 | 构成比(%) | |||||||||
| AMP | 147 | 99.32 | 1 | 0.68 | 0 | 0.00 | 19 | 100.00 | 0 | 0.00 | 0 | 0.00 | 20 | 100.00 | 0 | 0.00 | 0 | 0.00 | ||||||||
| AMC | 0 | 0.00 | 0 | 0.00 | 148 | 100.00 | 0 | 0.00 | 0 | 0.00 | 19 | 100.00 | 0 | 0.00 | 0 | 0.00 | 20 | 100.00 | ||||||||
| ATX | 0 | 0.00 | 2 | 1.35 | 146 | 98.65 | 0 | 0.00 | 0 | 0.00 | 19 | 100.00 | 0 | 0.00 | 0 | 0.00 | 20 | 100.00 | ||||||||
| CAZ | 0 | 0.00 | 0 | 0.00 | 148 | 100.00 | 0 | 0.00 | 0 | 0.00 | 19 | 100.00 | 0 | 0.00 | 0 | 0.00 | 20 | 100.00 | ||||||||
| FEP | 0 | 0.00 | 0 | 0.00 | 148 | 100.00 | 0 | 0.00 | 0 | 0.00 | 19 | 100.00 | 0 | 0.00 | 0 | 0.00 | 20 | 100.00 | ||||||||
| AK | 5 | 3.38 | 107 | 72.30 | 36 | 24.32 | 0 | 0.00 | 15 | 78.95 | 4 | 21.05 | 2 | 10.00 | 10 | 50.00 | 8 | 40.00 | ||||||||
| CN | 0 | 0.00 | 78 | 52.70 | 70 | 47.30 | 0 | 0.00 | 9 | 47.37 | 10 | 52.63 | 0 | 0.00 | 7 | 35.00 | 13 | 65.00 | ||||||||
| TE | 0 | 0.00 | 2 | 1.35 | 146 | 98.65 | 0 | 0.00 | 0 | 0.00 | 19 | 100.00 | 0 | 0.00 | 0 | 0.00 | 20 | 100.00 | ||||||||
| CIP | 0 | 0.00 | 51 | 34.46 | 97 | 65.54 | 0 | 0.00 | 6 | 31.58 | 13 | 68.42 | 0 | 0.00 | 4 | 20.00 | 16 | 80.00 | ||||||||
| LEV | 0 | 0.00 | 2 | 1.35 | 146 | 98.65 | 0 | 0.00 | 0 | 0.00 | 19 | 100.00 | 0 | 0.00 | 0 | 0.00 | 20 | 100.00 | ||||||||
| C | 0 | 0.00 | 0 | 0.00 | 148 | 100.00 | 0 | 0.00 | 0 | 0.00 | 19 | 100.00 | 0 | 0.00 | 0 | 0.00 | 20 | 100.00 | ||||||||
| SXT | 0 | 0.00 | 0 | 0.00 | 148 | 100.00 | 0 | 0.00 | 0 | 0.00 | 19 | 100.00 | 0 | 0.00 | 1 | 5.00 | 19 | 95.00 | ||||||||
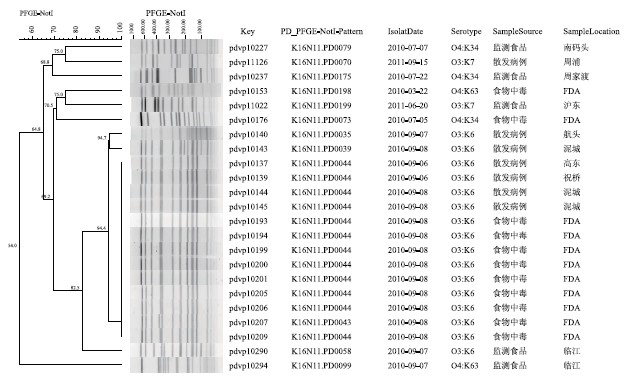
品分离株K16N11.PD0058(O3 ∶ K6)与患者分离株K16N11.PD0038、K16N11.PD0039、K16N11.PD0040等其他共25个(共241株O3 ∶ K6型菌株) PFGE带型相似性系数为82.6%,与相邻时间发生的食物中毒及散发病例分离株K16N11.PD0035、K16N11.PD0039、K16N11.PD0044之间的相似性系数亦为82.6%。食品分离株K16N11.PD0199(O3 ∶ K7)与患者分离株K16N11.PD0070(O3 ∶ K7)相似性系数为64.8%,食品分离株K16N11.PD0079、K16N11.PD0175(O4 ∶ K34)与患者分离株K16N11.PD0073(O4 ∶ K34)相似性系数为64.8%,食品分离株K16N11.PD0099(O4 ∶ K63)与患者分离株K16N11.PD0198(O4 ∶ K63)相似性系数为54.0%,提示这些监测食品与患者分离株间遗传关系较远,见图1。
2.3.2 食物中毒分离株
2010-2011年共发生20起食物中毒事件,其中2010年15起,2011年5起,PFGE带型分布情况见表4,食物中毒分离株与相邻日期的散发病例分离株在分子分型水平上不具相关性。K16N11.PD0044为优势带型。2起食物中毒事件(见表4中序号14、16)同时在患者与疑似食品中分离到副溶血弧菌,但PFGE带型不相同,提示疑
图1 相同血清型的食品、患有分离株PFGE聚类树状图
Figure 1 PFGE pattern of NotI-digested V. parahaemolyticus isolates
表4 食物中毒分离菌株型别分布情况(1)
Table 4 Serotype of the food-poisoning isolates
| 食物中毒事件 | 菌株数 | 患者分离株 | 食品分离株 | PFGE型别(K16.N11) | 血清型别 |
| 2010-03-22 | 2 | 2 | 0 | PD0034,PD0198 | O4 ∶ K8,O4 ∶ K63 |
| 2010-05-24 | 2 | 2 | 0 | PD0016 | O1 ∶ K36 |
| 2010-06-15 | 2 | 2 | 0 | PD0044 | O3 ∶ K6 |
| 2010-06-28 | 6 | 6 | 0 | PD0053,PD0044 | O3 ∶ K6 |
| 2010-06-30 | 12 | 12 | 0 | /,PD0062 | O3 ∶ K6 |
| 2010-07-05 | 1 | 0 | 1 | PD0073 | O4 ∶ K34 |
| 2010-07-11 | 5 | 5 | 0 | PD0044 | O3 ∶ K6 |
| 2010-07-13 | 4 | 4 | 0 | PD0044 | O3 ∶ K6 |
| 2010-07-27 | 2 | 2 | 0 | PD0022,PD0036 | O4 ∶ K8,O3 ∶ K6 |
| 2010-08-22 | 2 | 2 | 0 | PD0002 | O4 ∶ K9 |
| 2010-08-26 | 1 | 1 | 0 | PD0044 | O3 ∶ K6 |
| 2010-08-31 | 2 | 2 | 0 | PD0044 | O3 ∶ K6 |
| 2010-09-05 | 1 | 0 | 1 | PD0095 | O11 ∶ KUT |
| 2010-09-08 | 18 | 17 | 1 | PD0044,PD0131,PD0067,PD0016,PD0019,PD0043,PD0032,PD0155,/ | O3 ∶ K6,O1 ∶ KUT,O11 ∶ KUT,O1 ∶ K36, O4 ∶ K8,O10 ∶ KUT,O4 ∶ K68 |
| 2010-09-13 | 2 | 2 | 0 | / | O3 ∶ K6 |
| 2011-06-12 | 3 | 2 | 1 | PD0157, PD0190, PD0124 | O3 ∶ KⅣ, O3 ∶ KUT |
| 2011-07-25 | 2 | 2 | 0 | PD0016 | O1 ∶ K36 |
| 2011-08-05 | 2 | 2 | 0 | PD0044 | O3 ∶ K6 |
| 2011-09-13 | 2 | 2 | 0 | PD0044 | O3 ∶ K6 |
| 2011-10-04 | 6 | 6 | 0 | PD0043 | O3 ∶ K6 |
似食品不是引起此次食物中毒的传染源。有30%(6/20)的食物中毒事件,分离株中的PFGE带型有2个或以上,提示感染来源自不同的遗传株系。K16N11.PD0044、K16N11.PD0016、K16N11.PD0043 型在2年中各引起2起或以上的食物中毒事件,提示浦东新区存在被这些株系污染的传染源。
2.3.3 散发病例分离株
24.08%(72/299)的散发病例分离株PFGE型别是K16N11.PD0044,为优势带型。2010年散发病例分离株中占前2位的PFGE带型为K16N11.PD0044和K16N11.PD0036,K16N11.PD0013和K16N11.PD0038带型并列第3位,2011年前3位的优势带型为K16N11.PD0044、K16N11.PD0038和K16N11.PD0054。两年都出现K16N11.PD0044、K16N11.PD0036和K16N11.PD0038这3个带型,且型内均含有多株菌株,提示浦东新区长期存在着这3个株系的传染源。在相同或不同的时间、腹泻监测点之间存在完全相同的PFGE带型,提示存在多起疑似聚集性病例事件,见表5。相同PFGE带型内的菌株血清型相同,但相同血清型可以有多个PFGE型别。
表5 2010-2011年散发病例分离株PFGE型分布情况
Table 5 Distribution of PFGE pattern of isolates from sporadic patients during 2010-2011
| PFGE型别(K16N11.) | 血清型别 | 菌株数 | 采样地点 | 首次出现时间 | 最后出现时间 |
| PD0044 | O3 ∶ K6 | 39 | 金杨,泥城,机场镇,周浦,公利,大团,祝桥,高东,潍坊 | 2010-05-17 | 2010-09-26 |
| PD0036 | O3 ∶ K6 | 12 | 公利,南中心,金杨,航头,祝桥,大团,机场镇 | 2010-06-23 | 2010-09-08 |
| PD0013 | O1 ∶ K56 | 10 | 金杨,高东,大团,泥城 | 2010-07-28 | 2010-07-28 |
| PD0038 | O3 ∶ K6 | 10 | 航头,周浦,泥城,潍坊,祝桥,大团 | 2010-07-20 | 2010-08-23 |
| PD0053 | O3 ∶ K6 | 7 | 机场镇,公利,泥城,金杨 | 2010-07-02 | 2010-07-20 |
| PD0045 | O3 ∶ K6 | 5 | 祝桥,泥城,航头 | 2010-07-12 | 2010-08-16 |
| PD0039 | O3 ∶ K6 | 5 | 大团,泥城,金杨 | 2010-07-05 | 2010-09-08 |
| PD0027 | O4 ∶ K8 | 5 | 南中心,高东,祝桥,潍坊,泥城 | 2010-07-15 | 2010-09-14 |
| PD0011 | O3 ∶ K29 | 4 | 金杨,高东,泥城 | 2010-07-28 | 2010-07-28 |
| PD0016 | O1 ∶ K36 | 4 | 泥城,金杨,祝桥 | 2010-05-10 | 2010-08-23 |
| PD0021 | O4 ∶ K8 | 4 | 祝桥,金杨 | 2010-06-29 | 2010-07-02 |
| PD0019 | O4 ∶ K68 | 3 | 泥城 | 2010-07-20 | 2010-08-17 |
| PD0048 | O3 ∶ K6 | 3 | 公利,大团 | 2010-08-23 | 2010-09-21 |
| PD0130 | O1 ∶ KUT | 3 | 泥城 | 2010-07-29 | 2010-07-29 |
| PD0002 | O4 ∶ K9 | 2 | 金杨,泥城 | 2010-05-07 | 2010-08-31 |
| PD0008 | O3 ∶ K29 | 2 | 高东,祝桥 | 2010-07-09 | 2010-07-09 |
| PD0012 | O1 ∶ K56 | 2 | 机场镇,泥城 | 2010-08-16 | 2010-09-19 |
| PD0014 | O1 ∶ K56 | 2 | 南中心 | 2010-07-15 | 2010-07-15 |
| PD0029 | O4 ∶ K8 | 2 | 机场镇 | 2010-03-24 | 2010-03-25 |
| PD0035 | O3 ∶ K6 | 2 | 航头 | 2010-09-07 | 2010-09-07 |
| PD0044 | O3 ∶ K6 | 33 | 公利,仁济,南中心,金杨,东方,高东,泥城,浦南,浦人医 | 2011-06-10 | 2011-11-09 |
| PD0038 | O3 ∶ K6 | 10 | 南中心,金杨,三林,东方 | 2011-03-31 | 2011-09-08 |
| PD0054 | O3 ∶ K6 | 9 | 泥城,东方,机场镇 | 2011-08-19 | 2011-08-31 |
| PD0046 | O3 ∶ K6 | 8 | 公利,东方,仁济,金杨,浦人医 | 2011-08-01 | 2011-11-10 |
| PD0001 | O4 ∶ K9 | 7 | 三林,公利,泥城,浦南 | 2011-05-18 | 2011-10-21 |
| PD0039 | O3 ∶ K6 | 6 | 仁济,东方,南中心,七院 | 2011-08-03 | 2011-09-20 |
| PD0112 | O8 ∶ K41 | 6 | 仁济,东方 | 2011-08-03 | 2011-10-19 |
| PD0043 | O3 ∶ K6 | 5 | 金杨,仁济,公利 | 2011-09-14 | 2011-10-24 |
| PD0050 | O3 ∶ K6 | 4 | 仁济,东方,浦南 | 2011-08-09 | 2011-09-14 |
| PD0005 | O1 ∶ K36 | 3 | 金杨 | 2011-05-11 | 2011-05-11 |
| PD0056 | O3 ∶ K6 | 3 | 金杨 | 2011-07-13 | 2011-07-13 |
| PD0207 | O8 ∶ K21 | 2 | 三林,仁济 | 2011-09-19 | 2011-09-20 |
| PD0036 | O3 ∶ K6 | 2 | 机场镇,仁济 | 2011-08-31 | 2011-10-31 |
| PD0018 | O4 ∶ K68 | 2 | 南中心 | 2011-08-23 | 2011-08-23 |
| PD0111 | O8 ∶ K41 | 2 | 周浦 | 2011-09-15 | 2011-09-15 |
2.3.4 耐药菌株
1株多重耐药菌(菌株号10130,PFGE型K16N11.PD0105)与最相近带型的相似性系数为88.9%,7株耐2种抗生素的菌株中2株(菌株号11160、11161)未能分型,其余5株(菌株号11044、11038、11100、11124、11120)与最相近带型的相似性系数分别为72%、83.9%、87%、92.6%和97.3%,提示耐药菌株与敏感菌株的PFGE带型不同。
3 讨论
血清型分型技术操作简单,结果即时可得到,但是由于多种因素常致使菌株,尤其是食品分离株无法定型。本研究的505株菌株中有117株血清型无法分型,但这些菌株均能运用PFGE进行分型。尽管本次研究中亦有26株菌株PFGE未能分型,但远低于血清学未能分型的菌株数。这些菌株在排除了样品浓度过高、电泳液温度过高、凝胶浓度过低或混有杂质等影响因素,并在电泳中加入硫脲后依然未能分型,因此彻底解决未能分型这一问题还有待于进一步深入的研究。
本次研究结果显示63.42%(241/380)的散发及食物中毒患者分离株血清型为O3 ∶ K6,与国内外报道的结果 相类似,O3 ∶ K6血清型的高感染率可能是由于此血清型比其他血清型更容易导致腹泻与感染[7]。PFGE数据库显示K16N11.PD0044为血清型O3 ∶ K6的优势带型,菌株来源于不同或相同的时间、监测点的散发病例以及FDA送检的食物中毒患者分离株,K16N11.PD0044在2010年和2011年分别引起5起和2起食物中毒,说明这一带型的菌株长期存在于浦东新区,但与在监测食品中得到的1株O3 ∶ K6型菌株相比较,两者的PFGE分子分型相似性系数为82.6%,因此在此次研究中无法确定污染源。
根据聚类分析判断原则,带型相似性系数在100%的菌株为高度成簇性的菌株,在有流行病学信息支持的前提下,可认为这些菌株为同起暴发菌株,来源于暴发病例或相关的聚集性病例事件。本次研究结果显示2010-2011年发生多起疑似聚集性病例事件,有的发生在相同时间、相同地点,例如,2011年5月11日来自金杨的3株散发病例分离株是K16N11.PD0005型(O1 ∶ K36),还有的是发生在相邻时间、不同地点的疑似聚集性病例事件,例如K16N11.PD0021型内有3株(O4 ∶ K8)菌株是分离自2010年6月29日在祝桥就诊的腹泻患者,同年7月2日在金杨就诊的腹泻患者分离株中也得到与此相同的带型,提示这两个相距60余公里的监测点内4个患者可能为同一聚集性病例事件, 但仍需流行病学方面的证据来加以证实。当持续出现相同PFGE带型的时候应引起警惕,例如,在2010年7月下旬至8月中旬泥城的散发病例中分离到K16N11.PD0019(血清型为O4 ∶ K68)型菌株,在9月上旬食物中毒中也分离到这个型别的菌株,说明浦东地区存在被该株系污染的传染源。在2011年8月下旬南中心的散发病例中分离到K16N11.PD0018(血清型为O4 ∶ K68)型的菌株,与K16N11.PD0019相似性系数为94.4%,提示两者遗传关系较近。O4 ∶ K68与O3 ∶ K6在20世纪末曾是东南亚多国的流行株[8],近年来也是莫桑比克[9]等国的流行株,但O4 ∶ K68不是浦东新区的优势血清型,尽管如此,本次研究中PFGE分析结果提示我们应该密切注意这个株系的发展。
2010-2011年共发生20起由副溶血弧菌感染的食物中毒,通过PFGE分析,可以推测其中11起的感染来源于同一传染源。如果可以同时得到疑似食品与患者分离株,通过PFGE分析结果并结合流调资料,便可以查寻到传染源,但只有2起食物中毒事件同时得到患者与疑似食品分离株,并且两者在分子分型上不具相关性,说明疑似食品与暴发事件没有关系。其余18起食物中毒事件均未能同时得到患者与疑似食品分离株,杨丽华等[10]研究中也出现相同情况,因此需要我们在疑似食品的选择、采样、储藏、运输、检测方法等方面严格把关,提高细菌的阳性检出率,为流行病学调查提供完整的食物中毒证据链。
尽管本次研究的监测食品分离株与患者分离株在分子分型上不具相关性,提示这些监测食品不是引起浦东新区副溶血弧菌食源性疾病的高危食品,但Alam[3]等研究发现有2株食品分离株与引起多国大流行的临床分离株在PFGE型别上具有同源性,2012年日本[11]也报道海产品分离株与流行株在PFGE型别上具有同源性,因此持续对水产品中副溶血弧菌进行监测及同源性分析十分必要,可以了解菌株的动态并及时预警。
目前细菌耐药已成为治疗细菌性感染最为关注的问题,有报道指出副溶血弧菌也可能存在超级耐药株[12]。本研究显示目前浦东新区患者分离株中还未出现多重耐药菌株,仅对氨苄西林有极高的耐药性(503/505),对其余抗生素均有较高敏感性,研究结果与浙江省和广东省等地的报道有些不同 。
本研究综合运用耐药性检测、血清学分型、PFGE分子分型技术对2010-2011年在浦东新区各监测点及食物中毒事件中分离到的副溶血弧菌菌株进行了分析,初步建立浦东新区副溶血弧菌PFGE指纹图谱数据库,了解了优势菌株、常见菌株的分布情况、及其耐药谱和PFGE型别特征。
参考文献
[1] Ke BX, Tan HL, Li BS, et al. Etiologic characteristics of Vibrio parahaemolyticus strains causing outbreads and oporadic cases in Guangdong, 2009[J]. Chinese Journal of Epidemiology, 2011, 32(12):1237-1241.(in Chinese)柯碧霞, 谭海玲, 李柏生, 等. 广东省2009年副溶血弧菌暴发及散发菌株的病原学特征分析[J]. 中华流行病学杂志, 2011, 32(12):1237-1241.
[2] Parsons MB, Cooper KL, Kubota KA, et al. PulseNet USA standardized pulsed-field gel electrophoresis protocol for subtyping of Vibrio parahaemolyticus [J]. Foodborne Pathog Dis, 2007, 4(3):285-292.
[3] Alam M, Chowdhury WB, Bhuiyan NA, et al. Serogroup, Virulence, and Genetic Traits of Vibrio parahaemolyticus in the Estuarine Ecosystem of Bangladesh [J]. Appl Environ Microbiol, 2009, 75(10):6268-6274.
[4] Wagley S, Koofhethile K, Wing JB, et al. Comparison of V.parahaemolyticus isolated from seafoods and cases of gastrointestinal disease in the UK [J]. Int J Environ Health Res, 2008, 18(4):283-293.
[5] Kimura B, Sekine Y, Takahashi H, et al. Multiple-locus variable-number of tandem-repeats analysis distinguishes Vibrio parahaemolyticus pandemic O3:K6 strains [J].J Microbiol Methods, 2008, 72(3):313-320.
[6] Qu M, Zhang X, Liu GR, et al. Analysis on the etiological and molecular epidemiological characteristics of Vibrio parahaemolyticus in Beijing[J]. Chinese Journal of Epidemiology, 2011, 32(12):1255-1258.(in Chinese)曲梅, 张新, 刘桂荣, 等. 北京市副溶血弧菌病原学和分子流行病学特征分析[J]. 中华流行病学杂志, 2011, 32(12):1255-1258.
[7] Yeung PS, Hayes MC, DePaola A, et al. Comparative phenotypic, molecular, and virulence characterization of Vibrio parahaemolyticus O3:K6 isolates[J]. Appl Environ Microbiol, 2002, 68(6):2901-2909.
[8] Chowdhury NR, Chakraborty S, Tamaurthy T, et al. Molecular Evidence of Clonal Vibrio parahaemolyticus Pandemic Strains[J]. Emerg Infec Dis, 2010, 6(6):631-636.
[9] Ansaruzzaman M, Chowdhury A, Bhuiyan NA, et al. Characteristics of a pandemic clone of O3:K6 and O4:K68 Vibrio parahaemolyticus isolated in Beira, Mozambique[J]. J Med Microbiol, 2008, 57(Pt 12):1502-1507.
[10] Yang LH, Chen M, Chen HY, et al. Molecular typing on Vibrio parahaemolyticus strains by PFGE[J]. Chinese Journal of Disease Control and Prevention, 2010, 14(6):528-531.(in Chinese)杨丽华, 陈敏, 陈洪友, 等. 副溶血性弧菌脉冲场凝胶电泳分子分型研究[J].中华疾病控制杂志, 2010, 14(6):528-531.
[11] Hara-Kudo Y, Saito S, Ohtsuka K, et al.Characteristics of a sharp decrease in Vibrio parahaemolyticus infections and seafood contamination in Japan[J]. Int J Food Microbiol, 2012, 157(1):95-101.
[12] Tan HF, Ding LN, Lin F, et al. Study on serotype and drug resistance of Vibrio parahaemolyticus in Zhaoqing practical preventive medicine[J].Practical Preventive Medicine, 2010, 17(2):349-352.(in Chinese)谭海芳, 丁丽娜, 林凤, 等. 肇庆市副溶血弧菌血清分型和耐药性研究[J].实用预防医学, 2010, 17(2):349-352.
[13] Zhang JQ, Luo XH, He SY, et al. Monitoring and research of infectious diarrhea in Vibrio parahaemolyticus[J]. Chinese Journal of Health Laboratory Technology, 2010, 20(2):376-378.(in Chinese)张建群, 罗学辉, 何水渊, 等. 感染性腹泻中副溶血弧菌的监测与研究[J].中国卫生检验杂志, 2010, 20(2):376-378.
[14] He DM, Zhu HM, Ma C, et al. Comparative study on the phenotypic characteristics and molecular typing of foodborne Vibrio parahaemolyticus in Guangdong province[J]. Chinese Journal of Epidemiology, 2011, 32(12):1259-1263.(in Chinese)何冬梅, 朱海明, 马聪, 等.广东省食源性副溶血弧菌表型特征与分型比较研究[J].中华流行病学杂志, 2011, 32(12):1259-1263.
[2] Parsons MB, Cooper KL, Kubota KA, et al. PulseNet USA standardized pulsed-field gel electrophoresis protocol for subtyping of Vibrio parahaemolyticus [J]. Foodborne Pathog Dis, 2007, 4(3):285-292.
[3] Alam M, Chowdhury WB, Bhuiyan NA, et al. Serogroup, Virulence, and Genetic Traits of Vibrio parahaemolyticus in the Estuarine Ecosystem of Bangladesh [J]. Appl Environ Microbiol, 2009, 75(10):6268-6274.
[4] Wagley S, Koofhethile K, Wing JB, et al. Comparison of V.parahaemolyticus isolated from seafoods and cases of gastrointestinal disease in the UK [J]. Int J Environ Health Res, 2008, 18(4):283-293.
[5] Kimura B, Sekine Y, Takahashi H, et al. Multiple-locus variable-number of tandem-repeats analysis distinguishes Vibrio parahaemolyticus pandemic O3:K6 strains [J].J Microbiol Methods, 2008, 72(3):313-320.
[6] Qu M, Zhang X, Liu GR, et al. Analysis on the etiological and molecular epidemiological characteristics of Vibrio parahaemolyticus in Beijing[J]. Chinese Journal of Epidemiology, 2011, 32(12):1255-1258.(in Chinese)曲梅, 张新, 刘桂荣, 等. 北京市副溶血弧菌病原学和分子流行病学特征分析[J]. 中华流行病学杂志, 2011, 32(12):1255-1258.
[7] Yeung PS, Hayes MC, DePaola A, et al. Comparative phenotypic, molecular, and virulence characterization of Vibrio parahaemolyticus O3:K6 isolates[J]. Appl Environ Microbiol, 2002, 68(6):2901-2909.
[8] Chowdhury NR, Chakraborty S, Tamaurthy T, et al. Molecular Evidence of Clonal Vibrio parahaemolyticus Pandemic Strains[J]. Emerg Infec Dis, 2010, 6(6):631-636.
[9] Ansaruzzaman M, Chowdhury A, Bhuiyan NA, et al. Characteristics of a pandemic clone of O3:K6 and O4:K68 Vibrio parahaemolyticus isolated in Beira, Mozambique[J]. J Med Microbiol, 2008, 57(Pt 12):1502-1507.
[10] Yang LH, Chen M, Chen HY, et al. Molecular typing on Vibrio parahaemolyticus strains by PFGE[J]. Chinese Journal of Disease Control and Prevention, 2010, 14(6):528-531.(in Chinese)杨丽华, 陈敏, 陈洪友, 等. 副溶血性弧菌脉冲场凝胶电泳分子分型研究[J].中华疾病控制杂志, 2010, 14(6):528-531.
[11] Hara-Kudo Y, Saito S, Ohtsuka K, et al.Characteristics of a sharp decrease in Vibrio parahaemolyticus infections and seafood contamination in Japan[J]. Int J Food Microbiol, 2012, 157(1):95-101.
[12] Tan HF, Ding LN, Lin F, et al. Study on serotype and drug resistance of Vibrio parahaemolyticus in Zhaoqing practical preventive medicine[J].Practical Preventive Medicine, 2010, 17(2):349-352.(in Chinese)谭海芳, 丁丽娜, 林凤, 等. 肇庆市副溶血弧菌血清分型和耐药性研究[J].实用预防医学, 2010, 17(2):349-352.
[13] Zhang JQ, Luo XH, He SY, et al. Monitoring and research of infectious diarrhea in Vibrio parahaemolyticus[J]. Chinese Journal of Health Laboratory Technology, 2010, 20(2):376-378.(in Chinese)张建群, 罗学辉, 何水渊, 等. 感染性腹泻中副溶血弧菌的监测与研究[J].中国卫生检验杂志, 2010, 20(2):376-378.
[14] He DM, Zhu HM, Ma C, et al. Comparative study on the phenotypic characteristics and molecular typing of foodborne Vibrio parahaemolyticus in Guangdong province[J]. Chinese Journal of Epidemiology, 2011, 32(12):1259-1263.(in Chinese)何冬梅, 朱海明, 马聪, 等.广东省食源性副溶血弧菌表型特征与分型比较研究[J].中华流行病学杂志, 2011, 32(12):1259-1263.