Enterohemorrhagic Escherichia coli induced IL-1β level in human macrophages
WANG Shu-jing, CHENG Yu-li, XIONG Yan-wen, ZHANG Xiao-ai, HUANG Yuan-ming, REN Zhi-hong, SONG Li-qiong
Institute for Communicable Diseases Prevention and Control, Chinese Center for Disease Control and Prevention, State Key Laboratory for Communicable Disease Prevention and Control, Beijing 102206, China
Abstract
Objective In this study, we constructed different strains of EHEC O157: H7 (wild strain and mutant strains) to infect THP-1 cells in order to study the toxicity of different strains and cytokine production levels, such as IL-1β, and also compare the THP-1-secreted cytokine levels under the conditions of being cultured with or without FBS after infected with EHEC. Methods Aliquots of the bacteria were added in triplicate to the cell monolayer. At 2-10 h after infection, the release of lactate dehydrogenase (LDH) was quantified by using a Cytotox96 Kit. Meanwhile, the levels of human cytokines were quantified by using a Luminex Kit and ELISA Kit. Results Our results demonstrated that EHEC O157:H7-ehxA contributed to cytotoxicity in THP-1 cells, causing the production of higher IL-1β. Most important, the results showed that the cells cultured in 5% FBS-containing RPMI 1640 medium produced higher IL-1β while the difference in IL-1β level between wild type strains and mutant strains was more significant in OPT1-MEM serum-free medium. Conclusion ehxA plays a crucial role in EHEC O157:H7-induced IL-1β production. Moreover, the result revealed that the serum could stimulate cells to produce small amount of non specific IL-1β, which might cause the high background and hide the real difference between strains.
肠出血性大肠埃希菌感染人巨噬细胞产生白介素-1β水平的研究
王淑京, 程喻力, 熊衍文, 张晓嫒, 黄元铭, 任志鸿, 宋利琼
中国疾病预防控制中心传染病预防控制所, 传染病预防控制国家重点实验室, 北京 102206
摘要
目的 通过构建EHEC O157:H7野生株和突变株等不同菌株,来感染THP-1细胞,从而比较以上不同菌株的细胞毒和IL-1β等细胞因子的产生水平,同时比较使用有无胎牛血清(FBS)培养的THP-1对产生细胞因子水平的影响。 方法 将上述各菌株分别定量稀释于RPMI1640,5%FBS的细胞培养液中,在感染后2~10 h,用cytotox96试剂盒定量检测乳酸脱氢酶(LDH)的释放。同时用Luminex和酶联免疫吸附试验试剂盒定量检测多种细胞因子的水平。 结果 EHEC -O157:H7-ehxA是THP-1细胞毒作用的主要贡献者,并可引起高水平IL-1β的产生;在OPT1-MEM无血清培养基中,野生型菌株和突变型之间IL-1β的产生差异则更加显著。 结论 EHEC-O157:H7-ehxA 可诱导高水平IL-1β的产生,FBS能刺激细胞产生一定非特异性的IL-1β,这可能会导致高的背景和隐藏细胞株之间的真正差别。
肠出血性大肠埃希菌(EHEC)O157 ∶ H7是一种食源性病原菌,能够引起出血性腹泻(HC),甚至溶血性尿毒综合征(HUS)等危及生命的疾病。在99%临床分离的和许多牛分离的E. coli O157 ∶ H7菌株中都含有一个高度保守的质粒,这个大质粒命名为pO157[1]。溶血素(ehxA)是大质粒上第一个被描述的毒力因子[2]。溶血素操纵子由4个基因组成,在O137致HUS患者血中可以检测到溶血素抗体[3],侵袭性病原菌与巨噬细胞间相互作用的研究一直是细菌致病机制研究的一个热点,如:福氏志贺菌与巨噬细胞相互作用可导致细胞的坏死和细胞因子如白介素-1β(IL-1β)的释放[4],2型猪链球菌可以刺激人单核细胞系THP-1细胞生成一些细胞因子,如肿瘤坏死因子(TNF-α)、IL-1β、IL-6、IL-8和单核细胞趋化蛋白(MCP-1)产生,这些相关的细胞因子引起各种与感染、炎症和自身免疫过程的相关生物效应[5]。以往的研究表明巨噬细胞所产生的TNF-α 和IL-1在HUS相关的炎症反应中起到了重要的作用[6],但目前,EHEC O157 ∶ H7毒力因子与巨噬细胞之间的相互作用仍然不十分清楚。为了进一步探索大肠埃希菌O157 ∶ H7中ehxA的毒力功能,通过分析野生株和突变株的生物特性,包括对THP-1细胞的细胞毒性及细胞因子的产生进行了检测,研究不同菌株对机体产生细胞因子的影响;并对不同条件下培养的THP-1细胞所产生IL-1β水平进行了比较,现将结果报告如下。
1 材料与方法
1.1 菌株和质粒 EDL933,为EHEC O157 ∶ H7野生株;ΔpO157,为EDL933丢失大质粒pO157;ΔehxA,为EDL933缺失了ehxA基因;ΔehxA/pehxA,为ΔehxA的补充ehxA基因菌株;HB101,为阴性对照菌株,大肠埃希菌K12;以上菌株和质粒均由本实验组张晓嫒等构建和鉴定,详见文献[7]。
1.2 试剂和仪器
Triton X-100为美国BBI公司;RPMI1640 细胞培养基、FBS 购于美国Invitrogen公司;ELISA 试剂盒,Luminex 试剂盒均为美国R&D 公司生产;Cyto-Tox 96 Cytoxicity Kit为美国Promega公司。pH 计型号为Mettler Toledo Delta 320; CO2 孵箱型号为Thermo Forma Steri-Cycle CO2 incubator;低温离心机型号为Eppendorf Centrifuge 5810R;酶标仪型号为Bio-Rad Model 650。
1.3 细胞培养和感染
人单核细胞系THP-1 (ATCC TIB-202) 传代和感染如前所述[8],接种适量的THP-1细胞到24孔板上,培养液为RPMI1640(含5%FBS),每孔加入10-7mol/L的佛波酯(PMA)10 μl,37 ℃ CO2孵箱分化48 h,RPMI1640洗3次,再加入新鲜的细胞培养液(RPMI1640,5%FBS)备用。
接种THP-1细胞于24孔板(THP-1细胞要经以上分化处理),每孔细胞数2×105;挑取单菌落接种于LB液体培养基摇菌过夜16~18 h,细菌/细胞比例为100 ∶ 1,将上述各菌株分别定量稀释于RPMI1640,5%FBS的细胞培养液中,37 ℃ CO2 共同孵育一定时间。
1.4 细胞毒实验
在感染后2、4、6、8、10 h五个时间点,根据cytotox96试剂盒说明书(Promega, Madison, WI, U.S.),收集上清液并定量检测乳酸脱氢酶(LDH)的释放。细胞毒性表示为(实验释放-自发释放)/(最大释放-自发释放)×100%。这里的自发释放定义为未被感染的细胞培养上清LDH活性的量;最大释放定义为细胞被裂解缓冲液Triton X-100(美国BBI公司)裂解时最大限度地释放LDH活性的量。
1.5 细胞因子检测
在感染后2~10 h(同细胞毒实验五个时间点),收集细胞培养物的上清液检测细胞因子,其实验步骤如下:
使用RD6-40 0.9 ml溶解标准品,用RD6-40将标准品3倍系列稀释;将检测血清用RD6-40稀释10倍。将包被细胞因子抗体的磁珠100倍稀释后取50 μl加入试剂盒提供的96孔板中; 取稀释好的血清与标准品50 μl加到孔中,充分混匀后用膜将板封好,置于振荡器上室温振荡3 h; 用washing buffer洗3次后加入100倍稀释的biotin抗体50 μl。置于振荡器上室温振荡1 h; 用washing buffer洗3次后加入100倍稀释的PE 50 μl。置于振荡器上室温振荡30 min。
用washing buffer洗3次后加入100 μl washing buffer。置于振荡器上室温振荡2 min后上机检测。根据标准品浓度绘制标准曲线,使用Flowmetrix software软件计算样品浓度。
同时定量检测细胞因子IL-6、MCP-1、TNF-α 和IL-1β等的水平。只加入培养基的分化THP-1作为自发释放细胞因子对照。 LPS(1 mg/ml)(大肠埃希菌O111,Sigma公司)作为阳性对照。
1.6 IL-1β的检测
用相同剂量的细菌的感染不同介质中的THP-1细胞,来测量IL-1β的产生水平 用OPT1-MEM无血清培养基和使用传统的含5%小牛血清的RPMI1640培养基两种介质加入THP-1细胞,和相同剂量的细菌感染后4 h,收集细胞培养物的上清液,用酶联免疫吸附试验(ELISA)试剂盒检测不同介质中的THP-1细胞的IL-1β水平,并比较差异有无统计学意义。
1.7 统计学分析
实验结果使用均数表示。运用SPSS 16.0统计软件分析。对不同EHEC菌株感染的THP-1细胞培养上清液中的IL-1β水平之间的差异采用方差分析, P<0.05为差异有统计学意义。
2 结果
2.1 分化THP-1细胞毒性实验按照细菌与细胞100 ∶ 1 的比例加入细菌,与分化THP-1细胞相互作用不同时间,根据乳酸脱氢酶的释放量来比较不同菌株的细胞毒性差异,结果见图1。EHEC O157 ∶ H7 菌株EDL933、ΔpO157对分化THP-1细胞具有毒性作用,且这种毒性随时间的延长而升高,在10 h达到最高值。作用4 h后,在EDL933和ΔpO157之间,以及ΔehxA和ΔehxA/pehxA之间差异有统计学意义(P<0.05)。 HB101的LDH释放量则一直维持在相对低的水平。这些结果表明pO157质粒上编码ehxA对THP-1细胞是有毒的,并参与THP-1细胞的LDH释放。
图1 EHEC O157∶H7 菌株EDL933、ΔpO157、ΔehxA、ΔehxA/pehxA及HB101对分化THP-1细胞的细胞毒作用随时间变化的特点
Figure 1 Time specific effect of EHEC O157: H7 strain EDL933, ΔpO157, ΔehxA, ΔehxA/pehxA and HB101 on cytotoxicity of differentiated THP-1 cell
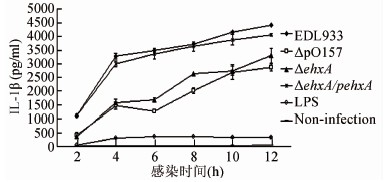
2.2 肠出血性大肠埃希菌O157 ∶ H7不同菌株诱导THP-1细胞中IL-1β产生
对感染不同菌株(EDL933,ΔpO157,ΔehxA,ΔehxA/pehxA)后的细胞上清液中的IL-1β的产生水平,通过Luminex试剂盒进行了测试。其结果显示,和其毒力质粒消除的菌株ΔpO157(P<0.05),以及其ehxA基因缺失突变株ΔehxA相比(P<0.05),EDL933刺激的THP-1细胞培养上清中产生较高水平的IL-1β。而来自ehxA基因缺失突变的IL-1β的释放减少,可以从补充ehxA基因(ΔehxA/pehxA)中得到恢复 (P<0.05)。结果见图2。另外,还评估了IL-6、MCP-1、TNF-α等其他细胞因子在THP-1细胞中的产生情况,结果表明ehxA并无影响其他细胞因子的产生。
图2 EHEC O157 ∶ H7 菌株EDL933、ΔpO157、ΔehxA、ΔehxA/pehxA及LPS对分化THP-1细胞产生IL-1β水平随时间变化的特点
Figure 2 Time specific effect of EHEC O157: H7 strain EDL933, ΔpO157, ΔehxA, ΔehxA/pehxA, and LPS on IL-1β level of differentiated THP-1 cell
2.3 不同培养基对检测IL-1β的影响
有无FBS存在下THP-1细胞感染不同的EDL933株其上清液中的IL-1β的浓度比较用OPT1-MEM不添加FBS的无血清培养基作为对照,并使用ELISA 试剂盒检测在不同介质中细胞溶解后上清液中的IL-1β浓度和使用传统的含5%小牛血清的RPMI1640培养基相比,野生型菌株和溶血素突变体之间的差异更大(P<0.05)。结果见图3。提示在不同介质中的血清可能是两个实验系统产生IL-1β显著差异的主要贡献者。
图3 有无FBS存在下THP-1细胞感染不同的EDL933株4 h时其上清液中IL-1β的浓度比较
Figure 3 Concentrations of IL-1β in different supernatants of THP-1 cells infected with EDL933 strains for 4h with or without FBS
3 讨论
人感染肠出血性大肠埃希菌O157 ∶ H7后可导致HUS,表现为急性肾衰、微血管病性溶血性贫血和血小板减少症,并且有大量炎症介质的生成包括促炎细胞因子如IL-1β、IL-6、TNF-α、IL-8、IL-1β、MCP-1和RANTES等,这些细胞因子在HUS的发生上都起到了重要的作用[9],目前对致病性大质粒pO157在炎症反应方面的研究较少。本研究结果显示,EDL933刺激人巨噬细胞生成IL-1β水平显著高于大质粒缺失株,提示大质粒在EHEC O157 ∶ H7刺激人巨噬细胞生成细胞因子上起到了重要的作用。
先前的研究已经表明,炎症反应是参与肠出血性大肠埃希菌O157 ∶ H7感染的发病机制。HUS患者在肠出血性大肠埃希菌O157 ∶ H7感染时,显示出了各种增加的循环促炎细胞因子,如IL-1β、TNF-α和IL-8 。然而,到底是肠出血性大肠埃希菌O157 ∶ H7的哪个组成部分通过巨噬细胞的活化引起促炎性细胞因子的高水平产生,并没有得到很好的证明。为了进一步揭示大质粒上的哪些基因在促IL-1β的生成中起作用,我们构建了溶血素操纵子A的缺失菌株ΔehxA,结果发现大质粒缺失菌株ΔpO157和ΔehxA刺激分化THP-1细胞生成IL-1β的水平都明显低于野生株,提示溶血素A(ehxA)在促进人巨噬细胞生成IL-1β上起到了重要的作用,与先前的研究基本相符[12]。在本研究中,我们的结果证明,肠出血性大肠杆菌O157 ∶ H7-ehxA诱导THP-1细胞分泌高水平的成熟IL-1β,同时,其他细胞因子(IL-6、MCP-1、TNF-α)也被检查,但ehxA对他们并无影响。我们的结果为研究溶血素在EHEC O157 ∶ H7致病过程中的作用提供了新的思路。即人感染EHEC O157 ∶ H7时,大质粒的存在激活了宿主的免疫系统,宿主细胞释放大量的炎症因子,其中溶血素在促进人巨噬细胞IL-1β的大量产生起到重要作用。
本研究中,通过不断摸索实验条件,我们采用低剂量的细菌感染4 h,以减少在先前实验中看到的细胞毒性。同时我们还用OPT1-MEM不添加FBS的无血清培养基作为平行对照,并使用ELISA试剂盒同时检测两种不同介质中细胞溶解后上清液中的IL-1β,结果显示,IL-1β的总体水平显著降低,相反,与使用传统的含5%小牛血清的RPMI1640培养基相比,野生型菌株和溶血素突变体之间的差异更大。这样的发现,使我们认识到在不同介质中的血清可能是两个实验系统产生IL-1β显著差异的主要贡献者。因此,在我们后面的重复实验中,用相同剂量的细菌的感染不同介质中的THP-1细胞,来测量IL-1β的产生水平,结果显示,在5%FBS的RPMI1640培养基中,整体都产生较高的IL-1β水平,而在OPT1-MEM无血清培养基中,野生型菌株和突变型之间IL-1β的产生差异更明显。血清能刺激细胞产生少量非特异性的IL-1β,可能会导致高的背景和隐藏细胞株之间的真正差别,IL-1β的水平在两种条件下的差异可能是由于实验条件的改变所致,然而,这些结果却与国内外有些学者 的实验结果不太相符,他们的实验结果认为FBS并不影响细胞因子的产生水平,对此,我们还将进一步研究来证实。
综上所述,本研究的创新之处在于,首次同时应用肠出血性大肠埃希菌O157 ∶ H7-ehxA突变株,突变株的回补株和野生株做平行对照,发现了肠出血性大肠埃希菌O157 ∶ H7-ehxA对THP-1细胞的细胞毒性作出了主要贡献,同时还发现在诸多的细胞因子中ehxA突变株主要对IL-1β的产生有重要作用。另外,血清能刺激细胞产生一定非特异性的细胞因子,这可能会导致高的背景和隐藏细胞株之间的真正差别。需要更多进一步的相关研究,以确定IL-1β在这一致命的食源性感染的发病机制中扮演的角色。
参考文献
[1] Banatvala N, Griffin PM, Greene KD, et al. The united states national prospective hemolytic uremic syndrome study: microbiologic, serologic, clinical, and epidemiologic findings[J]. J Infect Dis,2001,183(7):1063-1070.
[2] Schmidt H, Beutin L, Karch H. Molecular analysis of the plasmid-encoded hemolysin of Escherichia coli O157:H7 strain EDL 933[J]. Infect Immun,1995,63(3):1055-1061.
[3] Schmidt H, Kernbach C, Karch H. Analysis of the EHEC hly operon and its location in the physical map of the large plasmid of enterohaemorrhagic Escherichia coli O157:H7[J]. Microbiology,1996,142(Pt 4):907-914.
[4] Fernandez-Prada CM, Hoover DL, Tall BD, et al. Human monocyte-derived macrophages infected with virulent Shigella flexneri in vitro undergo a rapid cytolytic event similar to oncosis but not apoptosis[J]. Infect Immun,1997,65(4):1486-1496.
[5] Segura M, Vadeboncoeur N, Gottschalk M. CD14-dependent and-independent cytokine and chemokine production by human THP-1 monocytes stimulated by Streptococcus suis capsular type 2[J]. Clin Exp Immunol,2002,127(2):243-254.
[6] van de Kar NC, Monnens LA, Karmali MA, et al. Tumor necrosis factor and interleukin-1 induce expression of the verocytotoxin receptor globotriaosylceramide on human endothelial cells: implications for the pathogenesis of the hemolytic uremic syndrome[J]. Blood,1992,80(11):2755-2764.
[7] Zhang X, Cheng Y, Xiong Y, et al. Enterohemorrhagic Escherichia coli Specific Enterohemolysin Induced IL-1b in Human Macrophages and EHEC-Induced IL-1b Required Activation of NLRP3 Inflammasome[J]. PLoS One,2012,7(11):e50288.
[8] Daigle F, Graham JE, Curtiss R. Identification of Salmonella typhigenes expressed within macrophages by selective capture of transcribedsequences (SCOTS) [J]. Mol Microbiol,2001,41: 1211-1222.
[9] Proulx F, Toledano B, Phan V, et al. Circulating granulocyte colony-stimulating factor, C-X-C, and C-C chemokines in children with Escherichia coli O157:H7 associated hemolytic uremic syndrome[J]. Pediatr Res,2002,52(6):928-934.
[10] Litalien C, Proulx F, Mariscalco MM, et al. Circulating inflammatory cytokine levels in hemolytic uremic syndrome[J]. Pediatr Nephrol,1999,13:840-845.
[11] Proulx F, Toledano B, Phan V, et al. Circulating granulocyte colony-stimulating factor, C-X-C, and C-C chemokines in children with Escherichia coli O157:H7 associated hemolytic uremic syndrome[J].Pediatr Res,2002,52:928-934.
[12] Aldick T, Bielaszewska M, Uhlin BE, et al. Vesicular stabilization and activity augmentation of enterohaemorrhagic Escherichia coli haemolysin[J]. Mol Microbiol,2009,71(6):1496-1508.
[13] Gong Z, Calkins G, Cheng EC,et al. Influence of culture medium on smooth muscle cell differentiation from human bone marrow-derived mesenchymal stem cells[J]. Tissue Eng Part A,2009,15(2):319-330.
[14] Yang SW, Liu RF, Zhang KM. Effects of FBS concentrations on BMSC-secreted cytokine levels[J].Chinese Remedies & Clinics,2009,9(4):268-269.(in Chinnese) 杨苏旺,刘瑞风,张开明.不同浓度胎牛血清对骨髓基质细胞产生细胞因子水平影响的研究[J]. 中国药物与临床,2009,9(4):268-269.
[2] Schmidt H, Beutin L, Karch H. Molecular analysis of the plasmid-encoded hemolysin of Escherichia coli O157:H7 strain EDL 933[J]. Infect Immun,1995,63(3):1055-1061.
[3] Schmidt H, Kernbach C, Karch H. Analysis of the EHEC hly operon and its location in the physical map of the large plasmid of enterohaemorrhagic Escherichia coli O157:H7[J]. Microbiology,1996,142(Pt 4):907-914.
[4] Fernandez-Prada CM, Hoover DL, Tall BD, et al. Human monocyte-derived macrophages infected with virulent Shigella flexneri in vitro undergo a rapid cytolytic event similar to oncosis but not apoptosis[J]. Infect Immun,1997,65(4):1486-1496.
[5] Segura M, Vadeboncoeur N, Gottschalk M. CD14-dependent and-independent cytokine and chemokine production by human THP-1 monocytes stimulated by Streptococcus suis capsular type 2[J]. Clin Exp Immunol,2002,127(2):243-254.
[6] van de Kar NC, Monnens LA, Karmali MA, et al. Tumor necrosis factor and interleukin-1 induce expression of the verocytotoxin receptor globotriaosylceramide on human endothelial cells: implications for the pathogenesis of the hemolytic uremic syndrome[J]. Blood,1992,80(11):2755-2764.
[7] Zhang X, Cheng Y, Xiong Y, et al. Enterohemorrhagic Escherichia coli Specific Enterohemolysin Induced IL-1b in Human Macrophages and EHEC-Induced IL-1b Required Activation of NLRP3 Inflammasome[J]. PLoS One,2012,7(11):e50288.
[8] Daigle F, Graham JE, Curtiss R. Identification of Salmonella typhigenes expressed within macrophages by selective capture of transcribedsequences (SCOTS) [J]. Mol Microbiol,2001,41: 1211-1222.
[9] Proulx F, Toledano B, Phan V, et al. Circulating granulocyte colony-stimulating factor, C-X-C, and C-C chemokines in children with Escherichia coli O157:H7 associated hemolytic uremic syndrome[J]. Pediatr Res,2002,52(6):928-934.
[10] Litalien C, Proulx F, Mariscalco MM, et al. Circulating inflammatory cytokine levels in hemolytic uremic syndrome[J]. Pediatr Nephrol,1999,13:840-845.
[11] Proulx F, Toledano B, Phan V, et al. Circulating granulocyte colony-stimulating factor, C-X-C, and C-C chemokines in children with Escherichia coli O157:H7 associated hemolytic uremic syndrome[J].Pediatr Res,2002,52:928-934.
[12] Aldick T, Bielaszewska M, Uhlin BE, et al. Vesicular stabilization and activity augmentation of enterohaemorrhagic Escherichia coli haemolysin[J]. Mol Microbiol,2009,71(6):1496-1508.
[13] Gong Z, Calkins G, Cheng EC,et al. Influence of culture medium on smooth muscle cell differentiation from human bone marrow-derived mesenchymal stem cells[J]. Tissue Eng Part A,2009,15(2):319-330.
[14] Yang SW, Liu RF, Zhang KM. Effects of FBS concentrations on BMSC-secreted cytokine levels[J].Chinese Remedies & Clinics,2009,9(4):268-269.(in Chinnese) 杨苏旺,刘瑞风,张开明.不同浓度胎牛血清对骨髓基质细胞产生细胞因子水平影响的研究[J]. 中国药物与临床,2009,9(4):268-269.