Study of TaqMan real time PCR for detection of Enterococcus faecalis
JIN Dong, YU Bo, LIU Sha, LIU Kai, XU Jian-guo, YE Chang-yun
State Key Laboratory for Communicable Diseases Prevention and Control, Institute for Communicable Disease Prevention and Control, Chinese Center for Disease Control and Prevention, Beijing 102206, China
Abstract
Objective To establish a TaqMan real-time PCR assay to detect Enterococcus faecalis and provide reliable technical basis for its clinical application. Methods We designed the primers and probe for ddl gene of E. faecalis. The specificity of the assay was tested by using 39 common pathogens and opportunistic pathogens. In order to evaluate the sensitivity, the standard curve was built by using the target gene which was cloned into pMD18-T plasmid. We made the blood simulative specimens with the concentrations of E. faecalis from 3.9×100-3.9×108cfu/ml by 10 series dilutions of E. faecalis strain and mixing well with blood to evaluate the application in clinical sample detection. Results The target gene was positive in E.faecalis reference strains and clinical isolates but negative in other pathogens by this TaqMan real-time PCR assay. The standard curve showed that 20 copy E.faecalis per reaction could be detected by this assay. The sensitivity of this assay for blood simulative specimens was 3.9×103cfu/ml. The stability evaluation indicated that the coefficient of variation was from 0.99% to 1.84%. Conclusion The TaqMan real-time PCR assay established in our study could be used in the detection of E.faecalis in blood specimens.
Keywords:
Enterococcus faecalis
TaqMan real-time fluorescence quantitative polymerase chain reaction
ddl gene
粪肠球菌TaqMan荧光定量PCR检测方法的建立
金东, 于波, 刘莎, 刘凯, 徐建国, 叶长芸
中国疾病预防控制中心传染病预防控制所, 传染病预防控制国家重点实验室, 北京 102206
摘要
目的 建立用于检测粪肠球菌的TaqMan实时荧光定量-聚合酶链反应(real-time fluorescence quantitative-Polymerase Chain Reaction,FQ-PCR)方法。 方法 根据粪肠球菌的d-丙氨酸聚连接酶(ddl)基因设计TaqMan FQ-PCR的引物及探针,并使用39种常见致病菌和条件致病菌检测其特异性。将目的基因克隆到质粒中,制作标准曲线,确定方法的检测下限。制备血液模拟标本,直接提取核酸进行检测,探索临床应用的可能。 结果 在特异性评价实验中,除阳性对照外其余样本均未出现特异性扩增曲线。建立粪肠球菌TaqMan FQ-PCR方法的标准曲线,确定该方法的检测下限为20 copy/管。通过对粪肠球菌血液模拟标本的检测发现,本方法对模拟标本的检测灵敏度为3.9×103 cfu/ml。在稳定性评价中,对含菌量为3.9×108、3.9×106和3.9×104cfu/ml的血液模拟标本重复检测10次,结果显示扩增反应Ct值的变异系数(CV)为0.99%~1.84%。 结论 本研究建立了适用于临床标本检测的粪肠球菌TaqMan FQ-PCR方法。
内容大纲
-
1 材料与方法
- 1.1 主要试剂与仪器设备
- 1.2 实验用菌株
- 1.3 引物和探针的合成
- 1.4 质粒标准品的制备
- 1.5 质粒拷贝数换算
- 1.6 标准曲线的建立
- 1.7 TaqMan FQ-PCR法的反应体系及反应参数
- 1.8 血液模拟标本的制备及核酸提取
- 1.9 特异性评价
- 1.10 灵敏度和稳定性评价
- 2.1 TaqMan荧光定量PCR方法的特异性
- 2.2 标准曲线的制备
- 2.3 对血液模拟标本检测的灵敏度
- 2.4 TaqMan FQ-PCR法的稳定性
1 材料与方法
1.1 主要试剂与仪器设备 脑心浸液肉汤及细菌琼脂粉购自北京陆桥技术有限公司。API 20细菌生化鉴定条购自法国生物梅里埃公司。Premix Ex TaqTM、EasyDilution、pMD18-T载体、JM109感受态细胞以及小量质粒提取试剂盒购自大连宝生物工程有限公司。核酸提取试剂盒(QIAamp DNA Mini Kit)和胶回收试剂盒(Qiaquick Gel Extraction kit)购自德国QIAGEN公司。ABI 7900 HT PCR仪为美国应用生物系统公司产品。NanoDrop ND-1000分光光度计为美国Thermo公司产品。
1.2 实验用菌株
粪肠球菌参考菌株ATCC 51299和屎肠球菌参考菌株ATCC BAA-472购自ATCC。肠球菌临床分离株来自粪便、尿液、血液、阴道分泌物等临床标本,分离株均采用API20 Strep细菌生化鉴定系统鉴定。用于特异性评价的菌株还包括肠致病性大肠埃希菌(EPEC)、肠产毒性大肠埃希菌(ETEC)、肠侵袭性大肠埃希菌(EIEC)、肠出血性大肠埃希菌(EHEC)、肠聚集性大肠埃希菌(EAEC)、痢疾志贺菌、福氏志贺菌、鲍氏志贺菌、宋内志贺菌、甲型副伤寒沙门菌、肺炎克雷伯菌、奇异变形杆菌、弗劳地枸橼酸杆菌、杨氏枸橼酸杆菌、布氏枸橼酸杆菌、阴沟肠杆菌、粘质沙雷菌、副溶血性弧菌、金黄色葡萄球菌、肺炎链球菌、酿脓链球菌、唾液链球菌、缓症链球菌、血链球菌、巴黎链球菌、小肠结肠炎耶尔森菌、铜绿假单胞菌、嗜水气单胞菌、单增李斯特菌、空肠弯曲菌、幽门螺杆菌、艰难梭菌、脆弱拟杆菌等共38种病原菌及条件致病菌,具体菌株信息见表1。
1.3 引物和探针的合成
根据粪肠球菌ddl基因的保守区域应用Primer Express3.0软件设计引物与探针,引物和探针序列及Tm值见表2。引物与探针由上海基康生物公司合成。
1.4 质粒标准品的制备
(1)以ddl-F和ddl-R为引物,扩增目的基因,片段大小为154 bp;(2)切胶回收,纯化PCR产物;(3)连接到pMD18-T载体;(4)转化到JM109感受态细胞,37 ℃振荡培养1 h;(5)取100 μl菌液涂布于含有IPTG、X-gal的氨苄抗性脑心浸液培养基上;(6)挑取过夜培养的白色克隆接种于5 ml脑心浸液液体培养基中,摇菌过夜;(7)用M13+/-通用引物进行阳性克隆子的验证;(8)提取质粒进行目的片段的测序验证。
表1 实验用菌株信息
Table 1 Information of the strains used in this study
| 菌株名称 | 拉丁名 | 菌株来源 | 菌株数量 |
| 粪肠球菌 | Enterococcus faecalis | ATCC 51299 | 1 |
| 粪肠球菌 | Enterococcus faecalis | 分离株 | 26 |
| 屎肠球菌 | Enterococcus faecalis | ATCC BAA-472 | 1 |
| 屎肠球菌 | Enterococcus faecalis | 分离株 | 85 |
| 肺炎链球菌 | Streptococcus pneumoniae | 分离株 | 1 |
| 酿脓链球菌 | Streptococcus pyogenes | 分离株 | 1 |
| 口腔链球菌 | Streptococcus oralis | 分离株 | 1 |
| 缓症链球菌 | Streptococcus mitis | 分离株 | 1 |
| 血链球菌 | Streptococcus sanguis | 分离株 | 1 |
| 唾液链球菌 | Streptococcus salivarius | 分离株 | 1 |
| 巴黎链球菌 | Streptococcus lutetiensis | 测序株 | 1 |
| 福氏志贺菌 | Shigella flexneri | 测序株 | 1 |
| 痢疾志贺菌 | Shigella dysenteriae | CMCC 51329 | 1 |
| 鲍氏志贺菌 | Shigella bogdii | CMCC 51105 | 1 |
| 宋内志贺菌 | Shigella sonnei | 测序株 | 1 |
| 肠致病性大肠埃希菌 | Enteropathogeic E.coli | 2348/69 | 1 |
| 肠产毒性大肠埃希菌 | Enterotoxigenic E.coli | 10407 | 1 |
| 肠出血性大肠埃希菌 | Enterohemorrhagic E.coli | EDL 933 | 1 |
| 肠侵袭性大肠埃希菌 | Enteroinvasive E.coli | 44825 | 1 |
| 肠聚集性大肠埃希菌 | Enteroaggregative E.coli | O42 | 1 |
| 伤寒沙门菌 | Salmonella typhi | 分离株 | 1 |
| 肺炎克雷伯菌 | Klebsiella peneumoniae | 分离株 | 1 |
| 奇异变形杆菌 | Proteus mirabilis | 分离株 | 1 |
| 弗劳地枸橼酸杆菌 | Citrobacter freundii | 测序株 | 1 |
| 布氏枸橼酸杆菌 | Citrobacter braakii | 分离株 | 1 |
| 杨氏枸橼酸杆菌 | Citrobacter youngae | 分离株 | 1 |
| 阴沟肠杆菌 | Enterobacter cloacae | 分离株 | 1 |
| 粘质沙雷菌 | Serratia marcesens | 1.1857 | 1 |
| 副溶血性弧菌 | Vibrio parahaemolyticus | ATCC 17802 | 1 |
| 金黄色葡萄球菌 | Staphylococcus aureus | ATCC 6538 | 1 |
| 小肠结肠炎耶尔森菌 | Yersinia enterocolitica | ATCC 23715 | 1 |
| 铜绿假单胞菌 | Pseudomonas aeruginosa | ATCC 15442 | 1 |
| 嗜水气单胞菌 | Aeromonas hydrophila | 1.2017 | 1 |
| 单增李斯特菌 | Listeria monocytogenes | ATCC 54003 | 1 |
| 空肠弯曲菌 | Campylobacter jejuni | 分离株 | 1 |
| 艰难梭菌 | Clostridium difficile | 分离株 | 1 |
| 脆弱拟杆菌 | Bacteroides fragilis | ATCC 25285 | 1 |
| 洋葱伯克霍尔德菌 | Burkholderia cepacia | 分离株 | 1 |
| 类志贺邻单胞菌 | Plesimonas shigelloides | 1.1998 | 1 |
| 猪链球菌 | Streptococcus suis | 测序株 | 1 |
| 鲍曼不动杆菌 | Acinetobacter baumannii | 分离株 | 1 |
| 幽门螺杆菌 | Helicobacter pylori | 分离株 | 1 |
表2 粪肠球菌荧光定量检测引物及探针序列
Table 2 Primers and probe of real-ime PCR for Enterococcus faecalis
| 引物及探针名称 | 序列(5′~3′) | 长度(bp) | Tm值(℃) |
| Efa ddl-F | GAA AGA TGT CGC TTT CTA TGA TTA TGA | 27 | 54.4 |
| Efa ddl-R | GCG ACT TAA GCC ACT TCC ATC TA | 23 | 54.5 |
| Efa probe | FAM-ATG CAA ATC CCA GCG CAT GTT CC-BHQ | 23 | 63.1 |
1.5 质粒拷贝数换算
测定质粒DNA的浓度为164.5 ng/μl,根据质粒的分子质量将质粒样品浓度换算为拷贝数:每μl样品中检测基因的拷贝数=浓度(ng/μl)×阿佛加德罗常数×10-9/(660×重组质粒碱基数)。依此计算得到质粒拷贝数浓度为4.7×1010拷贝/μl。
1.6 标准曲线的建立
用EasyDilution将上述质粒连续10倍稀释至1.0×100~1.0×108拷贝/μl,共9个浓度梯度,每个浓度进行3次重复测定。
1.7 TaqMan FQ-PCR法的反应体系及反应参数
TaqMan FQ-PCR反应体系中包括2×Premix Ex TaqTM 10 μl、10 μmol/L的引物各0.4 μl、探针 0.2 μl、DNA模板2 μl,加去离子水至20 μl。PCR循环参数: 95 ℃预变性30 s;95 ℃变性5 s,60 ℃延伸20 s,共40个循环。未加入粪肠球菌的血液标本DNA提取物作为阴性对照。扩增结束后,扣除本底荧光信号后取同一阈值分析数据,确定各样本的Ct(Cycle threshold)值。
1.8 血液模拟标本的制备及核酸提取
(1)粪肠球菌参考菌株ATCC 51299接种于脑心浸液液体培养基中,过夜培养。将50 μl菌液接种于5 ml脑心浸液液体培养基中,摇菌至A值(波长610 nm)为0.60,平板计数为7.9×108 cfu/ml;(2)用磷酸盐缓冲液连续10倍稀释到7.9×100~7.9×107cfu/ml;(3)取无菌血液100 μl/管,分别加入100 μl不同浓度的粪肠球菌稀释悬液,制成3.9×100~3.9×108 cfu/ml浓度梯度的血液模拟标本;(4)5000×g离心10 min,弃去上清,用180 μl裂解液(20 mmol/L Tris-HCl pH 8.0, 2 mmol/L EDTA, 1.2% Triton,20 mg/ml的溶菌酶)重新悬起,37 ℃作用30 min,应用QIAamp核酸提取试剂盒提取模拟标本核酸,每个菌量浓度取3份血液模拟标本,平行独立提取DNA,同时提取未加入粪肠球菌的血液标本作为阴性对照。
1.9 特异性评价
使用本方法对39种常见致病菌及条件致病菌的基因组DNA进行检测,评价该TaqMan荧光定量PCR方法的特异性。
1.10 灵敏度和稳定性评价
用TaqMan FQ-PCR方法分别检测不同梯度浓度的质粒标准品和血液模拟标本,评价方法的检测灵敏度。分别选取高(3.9×108 cfu/ml)、中(3.9×106 cfu/ml)、低(3.9×104 cfu/ml)3个浓度的血液模拟标本,重复试验10次,计算变异系数。
2 结果
2.1 TaqMan荧光定量PCR方法的特异性 针对ddl基因的荧光定量检测,粪肠球菌参考菌株ATCC 51299及26株粪肠球菌临床分离株的核酸均为阳性,86株屎肠球菌核酸检测为阴性。其他38种常见病原菌及条件致病菌核酸均未检测到阳性。
2.2 标准曲线的制备
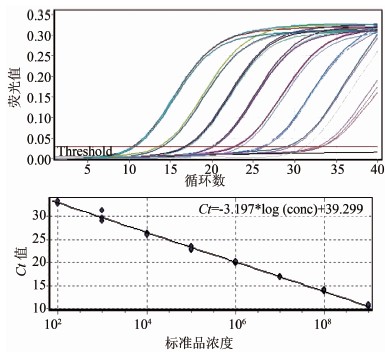
当质粒浓度为1.0×101~1.0×108拷贝/μl时,所有标本的扩增荧光信号强度均高于检测阈值;而当质粒浓度为1.0×100拷贝/μl时,3个平行样本均未出现特异性扩增。根据每反应体系加入2 μl模板计算得出,本研究建立的粪肠球菌实时荧光PCR体系的对质粒标准品的检测下限为20拷贝/反应体系。在质粒浓度为1.0×101~1.0×108拷贝/μl时,质粒浓度的对数值与其Ct值之间呈良好的线性关系,相关系数R2 =0.996 44,引物扩增效率为1.05,具体结果见图1。
图1 Taqman荧光定量PCR方法对质粒标准品的扩增曲线及标准曲线图
Figure 1 Amplification plots and standard curve for plasmid standard by Taqman real-time PCR for Enterococcus faecalis
2.3 对血液模拟标本检测的灵敏度
当血液模拟标本的含菌量为3.9×108~3.9×103cfu/ml时,所有标本的扩增荧光信号强度均高于检测阈值; 当标本含菌量为3.9×102 cfu/ml 时,3个平行样中有2个样本未出现特异性扩增,当标本含菌量为3.9×101和3.9×100 cfu /ml时,3个平行样本均未出现特异性扩增。血液模拟标本的含菌量为3.9×103 cfu/ml时重复进行了10次平行反应扩增均为阳性,由此得出本研究建立的粪肠球菌实时荧光PCR体系对血液模拟标本的检测下限为3.9×103 cfu/ml。
2.4 TaqMan FQ-PCR法的稳定性
用含菌量为3.9×108、3.9×106和3.9×104 cfu/ml的血液模拟标本进行TaqMan FQ-PCR法重复检测10次,以评价该方法的稳定性,结果显示扩增反应Ct值的变异系数(CV)为0.99%~1.84%。
3 讨论
粪肠球菌是人胃肠道常见的细菌之一,广泛存在于环境和动物中。虽然很少引起正常人的感染性疾病,但是粪肠球菌是院内感染的常见病原菌。多重耐药的粪肠球菌,特别是耐万古霉素的粪肠球菌的出现已经成为临床治疗粪肠球菌感染的难题 。对该菌准确快速的鉴定可以有效提高临床治疗的针对性和有效性,降低病死率以及患者的经济负担,同时也可以减少耐药菌株的播散,因此临床需要开展针对粪肠球菌的快速检测。目前文献报道的粪肠球菌的荧光定量检测方法主要是基于16S rRNA基因的SYBR green检测方法 。相对于这些方法TaqMan荧光定量PCR方法具有特异性高、重复性好的特点;另外TaqMan荧光定量PCR方法对于设计多重PCR同时检测粪肠球菌及相关的耐药基因更有优势。
在临床上通常使用血培养瓶对血液标本中细菌进行检测,这种方法耗时长、费用高。传统的基于表型的鉴定方法通常需要2~3 d才能完成对粪肠球菌的鉴定工作,且常规方法如API细菌鉴定系统主观因素影响大,半自动或者全自动的生化鉴定系统对于粪肠球菌的鉴定也常出现偏差 。特别是相同的菌株在不同的培养条件和状态下会出现生化反应不典型的情况,这也造成鉴定的不准确。荧光定量PCR方法相对于常规的分离培养方法具有耗时短,操作简便,自动化程度高,特异性好的特点。ddl基因 是粪肠球菌特有的保守基因,广泛用于粪肠球菌的检测工作 ,本研究基于ddl基因设计用于粪肠球菌检测的引物和探针,在39种致病菌和条件致病菌中检测其特异性,同时建立质粒标准曲线和血液模拟标本评价本方法的敏感性和稳定性。
实验证实本研究建立的用于检测粪肠球菌的TaqMan荧光定量PCR方法特异性好,仅在粪肠球菌中检测到特性扩增反应,而在其他肠球菌属及多种病原菌和条件致病菌中均未检测到特异扩增曲线。本方法灵敏度高,能检测到20个拷贝/μl的质粒标准品和含有3.9×103 cfu/ml粪肠球菌的血液模拟标本。稳定性好,通过对含菌量为3.9×108、3.9×106和3.9×104cfu/ml的血液模拟标本的10次重复检测,显示扩增反应Ct值的变异系数(CV)为0. 99%~1. 84%。本研究建立的TaqMan荧光定量PCR法为临床标本中粪肠球菌的检测提供了基础,但其实际应用的检测效率还需不同临床样本进行评价,另外建立针对耐药基因的多重荧光定量PCR方法与本方法联合应用会给临床的诊断和治疗提供更多的帮助。
参考文献
[1] Zheng B,Lv Y.Ministry of health national antimicrobial resistance investigation net annual report of 2011: antimicrobial resistance surveillance of gram-positive cocci[J]. The Chinese Journal of Clinical Pharmacology,2012,28(12):888-892.(in Chinese) 郑波,吕媛.卫生部全国细菌耐药监测网2011年革兰阳性菌耐药监测[J].中国临床药理学杂志,2012,28(12):888-892.
[2] Wang Y,Zhao AL,Ye CY.Real-time PCR-based method for the detection of Listeria monocytogenes in simulated clinical sample[J].Chinese Journal of Zoonoses,2009,25(6): 511-514.(in Chinese) 王艳,赵爱兰,叶长芸.荧光定量PCR 技术用于模拟临床标本单增李斯特菌检测的研究[J].中国人兽共患病学报,2009, 25 (6):511-514.
[3] Meng S,Li J,Bai XM, et al.Study of real time TaqMan PCR for detction of Enterobacter sakazakii[J].Disease Surveillance,2011,26(9):746-748.(in Chinese) 孟双,李娟,白雪梅,等. 阪崎肠杆菌实时荧光TaqMan PCR检测方法的研究[J]. 疾病监测,2011,26(9):746-748.
[4] Meng S, Bai XM, Wang Y, et al.Novel triplex real-time TagMan PCR assay foe the dectection of Aeromaonas hydrophila[J]. Chinese Journal of Zoonoses,2012, 28(12):217-222.(in Chinese) 孟双,白雪梅,王艳,等.嗜水气单胞菌实时荧光三重TaqMan PCR快速检测体系的建立[J]. 中国人兽共患病学报,2012, 28(12):217-222.
[5] Leavis HL, Bonten MJ, Willems RJ.Identification of high-risk enterococcal clonal complexes: global dispersion and antibiotic resistance[J]. Curr Opin Microbiol,2006,9(5):454-460.
[6] Naas T, Fortineau N, Snanoudj R, et al. First nosocomial outbreak of vancomycin resistant Enterococcus faecalis expressing a VanD-like phenotype associated with a vanA genotype[J]. J Clin Microbiol, 2005,43(8):3642-3649.
[7] Ozbek SM, Ozbek A, Erdorgan AS. Analysis of Enterococcus faecalis in samples from Turkish patients with primary endodontic infections and failed endodontic treatment by real-time PCR SYBR green method[J]. J Appl Oral Sci,2009,17(5):370-374.
[8] Sedgley CM, Nagel AC, Shelburne CE, et al. Quantitative real-time PCR detection of oral Enterococcus faecalis in humans[J]. Arch Oral Biol,2005,50(6):575-583.
[9] Garcia-Garrote, Cercenado FE, Bouza E. Evaluation of a new system, VITEK 2: for identification and antimicrobial susceptibility testing of enterococci[J]. J Clin Microbiol,2000,38(5):2108-2111.
[10] Tsakris A, Woodford NS, Pournaras M,et al. Apparent increased prevalence of high-level aminoglycoside-resistant Enterococcus durans resulting from false identification by a semiautomated software system[J].J Clin Microbiol,1998,36(5):1419-1421.
[11] Depardieu F, Perichon B,Courvalin P.Detection of the van alphabet and identification of enterococci and staphylococci at the species level by mμltiplex PCR[J]. J Clin Microbiol,2004, 42(12):5857-5860.
[12] Yean CY, Yin LS, Lalitha P, et al. A nanoplex PCR assay for the rapid detection of vancomycin and bifunctional aminoglycoside resistance genes in Enterococcus species[J]. BMC Microbiology,2007,7:112.
[2] Wang Y,Zhao AL,Ye CY.Real-time PCR-based method for the detection of Listeria monocytogenes in simulated clinical sample[J].Chinese Journal of Zoonoses,2009,25(6): 511-514.(in Chinese) 王艳,赵爱兰,叶长芸.荧光定量PCR 技术用于模拟临床标本单增李斯特菌检测的研究[J].中国人兽共患病学报,2009, 25 (6):511-514.
[3] Meng S,Li J,Bai XM, et al.Study of real time TaqMan PCR for detction of Enterobacter sakazakii[J].Disease Surveillance,2011,26(9):746-748.(in Chinese) 孟双,李娟,白雪梅,等. 阪崎肠杆菌实时荧光TaqMan PCR检测方法的研究[J]. 疾病监测,2011,26(9):746-748.
[4] Meng S, Bai XM, Wang Y, et al.Novel triplex real-time TagMan PCR assay foe the dectection of Aeromaonas hydrophila[J]. Chinese Journal of Zoonoses,2012, 28(12):217-222.(in Chinese) 孟双,白雪梅,王艳,等.嗜水气单胞菌实时荧光三重TaqMan PCR快速检测体系的建立[J]. 中国人兽共患病学报,2012, 28(12):217-222.
[5] Leavis HL, Bonten MJ, Willems RJ.Identification of high-risk enterococcal clonal complexes: global dispersion and antibiotic resistance[J]. Curr Opin Microbiol,2006,9(5):454-460.
[6] Naas T, Fortineau N, Snanoudj R, et al. First nosocomial outbreak of vancomycin resistant Enterococcus faecalis expressing a VanD-like phenotype associated with a vanA genotype[J]. J Clin Microbiol, 2005,43(8):3642-3649.
[7] Ozbek SM, Ozbek A, Erdorgan AS. Analysis of Enterococcus faecalis in samples from Turkish patients with primary endodontic infections and failed endodontic treatment by real-time PCR SYBR green method[J]. J Appl Oral Sci,2009,17(5):370-374.
[8] Sedgley CM, Nagel AC, Shelburne CE, et al. Quantitative real-time PCR detection of oral Enterococcus faecalis in humans[J]. Arch Oral Biol,2005,50(6):575-583.
[9] Garcia-Garrote, Cercenado FE, Bouza E. Evaluation of a new system, VITEK 2: for identification and antimicrobial susceptibility testing of enterococci[J]. J Clin Microbiol,2000,38(5):2108-2111.
[10] Tsakris A, Woodford NS, Pournaras M,et al. Apparent increased prevalence of high-level aminoglycoside-resistant Enterococcus durans resulting from false identification by a semiautomated software system[J].J Clin Microbiol,1998,36(5):1419-1421.
[11] Depardieu F, Perichon B,Courvalin P.Detection of the van alphabet and identification of enterococci and staphylococci at the species level by mμltiplex PCR[J]. J Clin Microbiol,2004, 42(12):5857-5860.
[12] Yean CY, Yin LS, Lalitha P, et al. A nanoplex PCR assay for the rapid detection of vancomycin and bifunctional aminoglycoside resistance genes in Enterococcus species[J]. BMC Microbiology,2007,7:112.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 金东 | |
| 于波 | |
| 刘莎 | |
| 刘凯 | |
| 徐建国 | |
| 叶长芸 | |
| PubMed | |
| Article by JIN Dong | |
| Article by YU Bo | |
| Article by LIU Sha | |
| Article by LIU Kai | |
| Article by XU Jian-guo | |
| Article by YE Chang-yun | |