1. Institute for Communicable Disease Prevention and Control, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
2. School of Public Health, Jiamusi University, Jiamusi 154007, Heilongjiang, China
Detection of Salmonella typhi in stool samples with real-time fluorescent quantitative polymerase chain reaction
XIAO Yan1,2, REN Zhi-hong2, FAN Fen-xia2, KAN Biao2, ZHU Li-ling1, YAN Mei-ying2
Abstract
Objective To establish a real-time fluorescent quantitative polymerase chain reaction (qPCR) assay to detect Salmonella typhi in stool samples. Methods Primers were designed based on the sequence of STY1633, specific gene of S. typhi, for qPCR assay. The specificity and sensitivity of the qPCR assay established were evaluated and verified by detecting 92 strains of common pathogens other than S. typhi and 44 S. typhi strains. The detection limit was determined by using simulative stool specimen supplemented with S. typhi. Further verifying of the specificity and sensitivity of the qPCR assay was performed with clinical stool samples from patients with fever and /or diarrheal symptoms. Results Total 44 S. typhi isolates were amplified to be positive by this qPCR assay. Five enteric pathogens other than S. typhi causing diarrhea and 8 enteric non-enteric bacteria causing bacteremia with fever symptom were detected to be negative. For purified total DNA from pure culture isolates, the detection limit of the qPCR assay was 500 fg per reaction, equal to 97 copies per reaction. The limit of detection was 104 cfu/g and 50 cfu/g respectively with crude nucleotide from simulative stool samples before and after enrichment. Conclusion The qPCR assay for detecting S. typhi in stool sample with high sensitivity and specificity was established, which could be used in the rapid diagnosis of S. typhi infection and differential diagnosis of other pathogen infections with fever and diarrheal symptoms as well as in the early warning, prevention and control for typhoid fever.
Keywords:
Salmonella typhi
real-time fluorescent quantitative polymerase chain reaction
typhoid fever
利用实时荧光定量-聚合酶链反应方法检测粪便标本中的伤寒沙门菌
肖燕1,2, 任志鸿2, 樊粉霞2, 阚飙2, 祝丽玲1, 闫梅英2
1. 中国疾病预防控制中心传染病预防控制所, 北京 102206;
2. 佳木斯大学公共卫生学院, 黑龙江 佳木斯 154007
2. 佳木斯大学公共卫生学院, 黑龙江 佳木斯 154007
摘要
目的 建立针对粪便标本中伤寒沙门菌的检测方法,评价该方法的特异性、敏感性及检测下限,以提高感染人群粪便标本中伤寒沙门菌的检出率。 方法 根据伤寒沙门菌特异基因STY1633设计特异性引物,优化反应条件,建立实时荧光定量-聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,qPCR)反应体系。利用92株常见的非伤寒病原菌及44株伤寒沙门菌的染色体DNA评价该方法的特异性和灵敏性,并对伤寒沙门菌的粪便模拟标本进行检测下限评价,同时利用10份伤寒患者粪便标本及48份其他病原所致发热和/或伴腹泻的患者粪便标本进行特异性、敏感性验证。 结果 利用本方法检测的伤寒沙门菌纯菌及伤寒患者标本均扩增阳性,其余的非伤寒沙门菌、致腹泻的其他5种肠道致病菌及引起发热症状的8种常见非肠道病原菌纯菌及相应患者标本均扩增阴性。在对纯伤寒沙门菌DNA检测中,qPCR法的最低检测限为500 fg/反应,相当于97个拷贝/反应。以粪便模拟样品提取DNA为模板的检测中,增菌前检测下限达104 cfu/g,增菌后可达50 cfu/g。 结论 基于STY1633基因的实时荧光定量PCR方法在检测粪便中的伤寒沙门菌中具有很好的特异性、灵敏度,为伤寒沙门菌的快速诊断及某些不明原因发热及腹泻症状的病原初步鉴定提供了新的简便型手段,对于伤寒的早期诊断及预防控制提供了技术支持。
内容大纲
-
1 材料与方法
- 1.1 实验所用菌株
- 1.2 引物的设计及合成
- 1.3 纯菌DNA模板的提取
- 1.4 粪便模拟标本的制备
- 1.5 临床患者样品核酸制备
- 1.6 qPCR 反应体系的建立
- 1.7 基因扩增及序列分析
- 2.1 伤寒沙门菌
- 2.1.1 纯菌样品的qPCR特异性及灵敏性检测
- 2.1.2 临床样品qPCR特异性及灵敏性检测
- 2.2 伤寒沙门菌qPCR检测下限测定
- 2.2.1 纯菌样本中qPCR的检测下限
- 2.2.2 粪便模拟标本中qPCR的检测下限
我国目前对伤寒的诊断主要依靠病原血培养,粪便培养由于其他肠道菌干扰致操作步骤及分离鉴定相对繁杂,故粪便分离培养在伤寒病例实验室诊断中较少应用[3]。但考虑粪便样本的易获得性、易接受性及非侵入性,发展以粪便检测为基础的检测方法在减少患者痛苦、降低检测费用等方面具有一定优势[4]。同时考虑传统病原分离培养需时较长,聚集性不明原因发热暴发或流行时急需对病例进行伤寒的诊断和鉴别诊断,因此,建立一种灵敏可重复且快捷的粪便标本中伤寒沙门菌的检测方法是伤寒及相关以发热为主要症状的传染病在监测、应急中迫切需要解决的问题。
目前,已有针对伤寒沙门菌的多个基因包括invA、prt、fliC-d和viaB的单重或多重PCR检测伤寒沙门菌[5]。该方法的确能准确、可靠地鉴定伤寒沙门菌,但需时相对较长,且易污染。也有报道可用实时荧光定量反转录-聚合酶链反应(rRT-PCR)检测血液中的伤寒沙门菌[6],但需要提取血液RNA,且特异性存在一定的局限性。考虑到伤寒沙门菌在肠道内增殖且可大量随粪便外排这一特点,本研究建立了针对粪便标本的实时荧光定量-聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,qPCR)检测方法。
1 材料与方法
1.1 实验所用菌株 本实验所用的伤寒沙门菌菌株均为本实验室保存,分离自1962-2006年我国伤寒高发的5个省份的伤寒患者。其他作为检测伤寒沙门菌特异性评价的菌株包括:甲型副伤寒沙门菌4株,产毒型O1群霍乱弧菌、O139群霍乱弧菌、副溶血弧菌、金黄色葡萄球菌、羊种布鲁氏菌、牛种布鲁氏菌、猪种布鲁氏菌、肺炎克雷伯菌、肺炎链球菌、脑膜炎奈瑟菌、军团菌、结核杆菌、伯氏疏螺旋体、钩端螺旋体、肠炎沙门菌、鼠伤寒沙门菌各1株,志贺菌四群及致泻性大肠埃希菌(EPEC、EIEC、EHEC、EAEC、ETEC)各1株均来自中国疾病预防控制中心传染病预防控制所。
1.2 引物的设计及合成
将伤寒沙门菌Ty2的全基因序列与GenBank中已发表的其他微生物基因组序列及人类基因组序列进行比对,发现STY1633基因仅存在于伤寒沙门菌中,因此根据GenBank中STY1633的序列,利用Beacon Designer 7.0软件(ABI公司)设计相应的qPCR引物,引物序列为:71-F: ACG GCG AGG ATG GTG TTA T和71-R: CGA GGT TTT TCC CTT TGA GAG, 引物由上海生工生物有限公司合成。
1.3 纯菌DNA模板的提取
DNA提取使用Wizard genomic DNA purification kit (Promega公司),操作步骤均严格按照该说明书进行。
1.4 粪便模拟标本的制备
1.4.1
挑取伤寒沙门菌CT18单个菌落接种在LB(Luria-Bertani)液体培养基,37 ℃振荡培养至A值达0.8(菌量约为1×108 cfu/ml)。此时的菌液作为原液,将其倍比稀释获得自1×107 ~1/32×100 cfu/ml不同浓度梯度菌液。取系列稀释菌液进行菌落计数,测定模拟标本中准确细菌含量。
1.4.2
取1.4.1中各浓度梯度菌液各500 μl与适当克数的健康人的粪便标本混合,混匀后,取一接菌环接种科玛嘉沙门菌显色平板,37 ℃过夜培养,观察目标菌生长情况。同时取粪便与菌液的混匀样品100 μl加入200 μl TE,涡旋振荡,1000 r/min离心1 min后去沉淀(粪便残渣)。将保留下来的上清,8000 r/min 5 min后弃上清,再将沉淀用1 ml TE重悬。振荡离心同上,弃上清,保留沉淀并用100 μl TE悬菌。经100 ℃水浴沸煮10 min后离心,留上清,此为增菌前样品,作为qPCR反应模板。
1.4.3
将1.4.2中剩余的粪便与菌液的混合物中加入6 ml亚硒酸盐增菌液,37 ℃过夜培养。第2天取一接菌环增菌液接种科玛嘉沙门菌显色平板,37 ℃过夜培养,观察目标菌生长情况。同时取1 ml该增菌液,按1.4.2中步骤制备增菌后样品DNA用于qPCR反应。
1.5 临床患者样品核酸制备
取0.2 g左右患者粪便用1 ml TE重悬后按1.4.2中的步骤进行核酸制备。
1.6 qPCR 反应体系的建立
使用SYBR Premix Ex Taq(TaKaRa公司)进行qPCR核酸扩增。反应体系(总体积20 μl)组成为:2×Premix mixture 10 μl,引物71-F及71-R各2 pmol,模板DNA 5 μl。使用CFX96荧光PCR仪,扩增条件为95 ℃,5 min;94 ℃ 30 s,60 ℃ 15 s,共45个循环,溶解曲线65 ℃,递增频率为0.05 s。对于Ct值≤35的扩增结果判定为阳性。
1.7 基因扩增及序列分析
以提取的菌株DNA为模板,使用高保真酶pyrobest(TaKaRa公司)进行常规PCR扩增,扩增产物行琼脂糖凝胶电泳,检测PCR片段长度。并将PCR产物纯化后,送上海生工生物有限公司进行序列测定(ABI3730),获得的序列利用DNAstar软件进行比对分析。PCR反应体系(总体积50 μl)组成为:10×pyrobest buffer 5 μl,4种dNTP各200 μmol/L,引物71-F及71-R各400 μmol/L,模板DNA 100 ng。扩增条件为95 ℃,5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,共35个循环。
2 结果
2.1 伤寒沙门菌 qPCR特异性及灵敏性检测。
2.1.1 纯菌样品的qPCR特异性及灵敏性检测
本研究共进行了48种136株细菌的qPCR检测,见表1,其中44株伤寒沙门菌均阳性,沙门菌属其他34种常见血清型均扩增阴性,其他常见腹泻病原包括霍乱弧菌、副溶血弧菌、志贺菌、致泻性大肠埃希菌亦扩增阴性。而且,临床其他常见发热病原菌包括金黄色葡萄球菌、肺炎链球菌、伯氏疏螺旋体、钩端螺旋体、嗜肺军团菌、脑膜炎奈瑟菌、立克次体、布鲁氏菌均扩增阴性,特异性、敏感性均为100%,说明本研究建立的qPCR具有较高的特异性及灵敏性。
对44株qPCR扩增阳性的伤寒沙门菌进行常规PCR扩增,见图1,2%琼脂糖凝胶电泳显示片段大小约200 bp,与理论值(210 bp)一致。对回收的PCR产物进行序列测定,经DNAstar软件比对发现,所有伤寒沙门菌菌株的扩增序列完全一致,不存在单个或多个核苷酸的点突变及缺失、插入情况。同时考虑44株伤寒沙门菌分离时间(1959-2006年)及地域(5个省份)的广泛性,进一步说明本研究建立的qPCR具有较高的特异性及代表性。
2.1.2 临床样品qPCR特异性及灵敏性检测
以10份伤寒患者粪便粗提的核酸为模板进行qPCR检测,结果均为阳性。48份非伤寒病原菌感染粪便包括嗜水气单胞菌感染4例,类志贺邻单胞菌感染3例,志贺菌感染2例,肠炎沙门菌感染2例,副溶血弧菌感染1例,致泻性大肠埃希菌感染5例,其余样品为未知病原致发热及腹泻样品,结果目的基因均扩增阴性,进一步说明针对STY1633的引物具有较高的特异性及灵敏性。
2.2 伤寒沙门菌qPCR检测下限测定
2.2.1 纯菌样本中qPCR的检测下限
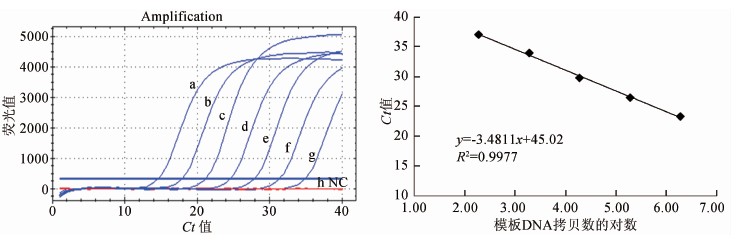
提取伤寒沙门菌标准株CT18基因组DNA作为阳性模板,对模板进行10倍系列稀释,检测qPCR反应的敏感性,结果如图1所示,qPCR检测STY1633靶基因的敏感性为 500 fg/反应,约为97个拷贝/反应,与文献报道[6]一致。以时间(min)为纵轴,模板DNA拷贝数的对数为横轴,获得拟合曲线方程为y=-3.4811x+45.02,R2=0.9977,说明引物扩增效率较高。本实验进行了三次独立重复实验,结果一致。
表1 伤寒沙门菌 qPCR特异性及敏感性检测
Table 1 Specificity and sensitivity of qPCR for detecting Salmonella typhi
| 沙门菌属 | 株数 | qPCR | 沙门菌属 | 株数 | qPCR | 其他病原菌 | 株数 | qPCR |
| 伤寒沙门菌 | 44 | + | 蒙得维的亚沙门菌 | 1 | - | 其他肠道病原菌 | ||
| 甲型副伤寒沙门菌 | 4 | - | 斯坦利沙门菌 | 1 | - | O1群霍乱弧菌 | 2 | - |
| 乙型副伤寒沙门菌 | 2 | - | 波摩那沙门菌 | 1 | - | O139群霍乱弧菌 | 2 | - |
| 丙型副伤寒沙门菌 | 1 | - | 波茨坦沙门菌 | 1 | - | 副溶血弧菌 | 4 | - |
| 猪霍乱沙门菌 | 1 | - | 姆班达卡沙门菌 | 1 | - | 痢疾志贺菌 | 1 | - |
| 鼠伤寒沙门菌 | 10 | - | 伊斯坦布尔沙门菌 | 1 | - | 福氏志贺菌 | 1 | - |
| 肠炎沙门菌 | 10 | - | 非丁伏斯沙门菌 | 1 | - | 鲍氏志贺菌 | 1 | - |
| 德尔卑沙门菌 | 2 | - | 利奇菲尔德沙门菌 | 1 | - | 宋内志贺菌 | 1 | - |
| 汤姆逊沙门菌 | 2 | - | 印第安纳沙门菌 | 1 | - | 致泻性大肠埃希菌 | 5 | - |
| 山夫登堡沙门菌 | 2 | - | 盖茨黑德沙门菌 | 1 | - | 其他常见发热病原 | ||
| 韦太夫雷登沙门菌 | 2 | - | 维尔肖沙门菌 | 1 | - | 金黄色葡萄球菌 | 5 | - |
| 阿贡纳沙门菌 | 2 | - | 威廉斯堡沙门菌 | 1 | - | 肺炎链球菌 | 1 | - |
| 阿伯丁沙门菌 | 1 | - | 旺滋沃思沙门菌 | 1 | - | 伯氏疏螺旋体 | 1 | - |
| 鸭沙门菌 | 1 | - | 胥伐成格隆沙门菌 | 1 | - | 钩端螺旋体 | 1 | - |
| 火鸡沙门菌 | 1 | - | 利文斯通沙门菌 | 1 | - | 嗜肺军团菌 | 1 | - |
| 圣地亚哥沙门菌 | 1 | - | 利物浦沙门菌 | 1 | - | 脑膜炎奈瑟菌 | 1 | - |
| 乌干达沙门菌 | 1 | - | 斯坦利维尔沙门菌 | 1 | - | 立克次体 | 2 | - |
| 肯塔基沙门菌 | 1 | - | 都柏林沙门菌 | 1 | - | 布鲁氏菌 | 3 | - |
图1 1633PCR产物琼脂糖凝胶电泳图(部分)
Figure 1 Agarose electrophoresis of PCR amplification of STY1633 in partial S. typhi isolates 注:M: Marker DL2000, lanes 1~23:PCR amplicon of 23 isolates of S. typhi。
图2 纯菌样本中qPCR检测STY1633敏感性
Figure 2 Sensitivity of qPCR for detecting STY1633 gene in pure strain specimen 注:a: 500 μg/test; b: 50 μg/test; c: 5 μg/test; d: 500 pg/test; e: 50 pg/test; f: 5 pg/test; g: 500 fg/test; h: 50 fg/test; NC: negative control
2.2.2 粪便模拟标本中qPCR的检测下限
分别以增菌前及增菌后粗制核酸为模板进行qPCR检测,结果未增菌粪便样品的最低检测限为104 cfu/g,粪便样品直接划线分离培养的灵敏度为105 cfu/g。增菌后qPCR的检测下限为50 cfu/g,与增菌后粪便样品直接划线分离培养的灵敏度基本一致。
3 讨论
利用粪便标本进行病原菌感染诊断具有方便、价廉、快捷、易于推广的特点,在粪便标本中进行核酸扩增检测病原菌感染,需设计筛选特异性高的引物。目前伤寒诊断多采用血培养,粪便标本较少采集,但患者粪便中往往含有大量伤寒沙门菌,若能发现粪便中伤寒沙门菌的快速检测方法,不仅可以缩短诊断周期、降低检测成本、使患者得到及时治疗、减少病原菌外排引起传播的机会,而且患者也更易于接受。虽然本课题组在以往研究中建立了基于其他基因(STY1631)的rRT-PCR方法检测血液中的伤寒沙门菌[6], 但后续研究发现该基因还存在于都柏林沙门菌中,限制了其用于粪便标本的检测。故本实验首先进行了基因组序列比对,排除伤寒沙门菌中与其他微生物及人类基因共有的基因外,发现STY1633是伤寒沙门菌特异的基因,因此设计了针对该基因的引物进行qPCR反应。
由于伤寒沙门菌属于肠道沙门菌属,故与其他肠道菌及沙门菌属其他血清型需要明确区分,避免假阳性反应。另外,由于伤寒在临床上主要以急起高热为主要表现,因此需与其他引起类似症状的致病菌进行区别。本研究通过相近种属沙门菌内不同血清型菌株及其他常见肠道病原菌、临床以发热为主要表现的需与伤寒进行鉴别诊断的非肠道病原菌共136株病原菌进行qPCR扩增检测,发现这些病原菌均扩增阴性,明显优于先前基于fliC-d的RT-LAMP的检测[7],表明本研究获得的针对STY1633的引物具有较高的特异性及灵敏性。为进一步验证其特异性及灵敏性, 本研究又采用10份血分离培养阳性伤寒患者的粪便样品和48份经分离培养确定为非伤寒沙门菌感染的发热和/或伴腹泻患者粪便样品进行qPCR检测,结果10份伤寒患者粪便样品均显示阳性扩增,而48份非伤寒患者样品均扩增阴性,说明本研究建立的基于STY1633的qPCR特异性较高,能快速区分其他常见的沙门菌属细菌及常见的致泻性细菌如大肠埃希菌、副溶血弧菌、志贺菌,以及以发热为主的侵袭性细菌,如金黄色葡萄球菌、脑膜炎奈瑟菌、螺旋体、布鲁氏菌等。因此该qPCR方法可考虑作为群体性不明原因发热患者中伤寒疾病的快速筛查技术之一。同时通过粪便模拟标本检测表明,qPCR的最低检测限为原始标本104 cfu/g,增菌后的检测下限为50 cfu/g,与以往报道的荧光PCR检测底限为1×105 cfu基本一致[5]。
利用SYBR染料法进行粪便标本中核酸的扩增检测,克服了常规PCR敏感性低、易污染的缺点,降低了探针法成本高、探针不稳定的劣势,同时利用粪便标本粗制的DNA为模板进行qPCR,克服了血液检测必须使用试剂盒纯化核酸的高费用,降低了成本,节约了时间,而且操作更方便,为了解人群伤寒沙门菌感染及携带情况提供了新方法,也为大规模健康体检或饮食从业人员体检的粪便样本检测提供了快速的初步诊断手段。
总之,本研究建立了简便、快捷、特异性好及灵敏度高的适用于粪便标本的伤寒沙门菌检测方法,并通过临床样品的实际检测验证。
参考文献
[1] WHO. Sequencing primers and protocol[EB/OL]. http://www.who.int/entity/csr/resources/publications/swineflu/Genome Primers_20090512.pdf,2011/2011-11-08.
[2] National data of class A, B and C communicable disease in May 2012[J]. Disease Surveillance, 2012,27(6):421. (in Chinese) 2012年5月中国甲乙丙类传染病疫情动态简介[J].疾病监测,2012,27(6):421.
[3] Tran N, Abhilasha K,sabina D,et al. The sensitivity of real time PCR amplification targeting invasive Salmonella serovars in biological specimens[J]. BMC Infectious Diseases, 2010,10(5):125-133.
[4] Nagarajan AG, Karnam G, Lahir A, et al. Reliable means of diagnosis and serover determination of blood borne Salmonella strains:quick PCR amplification of unique genomic loci by novel primer sets[J]. J Clin Microbiol, 2009,47(8):2435-2441.
[5] Grace YN, Li MN, Raymond L, et al, Development of a novel multiplex PCR for the detection and differentiation of Salmonella enterica serovars Typhi and paratyphi A[J]. Res Microbiol, 2010,161(4):243-248.
[6] Fan FX, Lou J, Chen JC, et al. Detection of Salmonella typhi in blood with real time fluorescent quantitative reverse transcriptive polymerase chain reaction[J]. Disease Surveillance, 2012,27(6):471-474.(in Chinese) 樊粉霞,娄静,陈建才,等. 利用实时荧光定量反转录-聚合酶链反应方法检测血液中伤寒沙门菌[J].疾病监测,2012,27(6):471-474.
[7] Fan FX, Wang SJ, Lou J, et al. Establishment of RT LAMP technique to detect Salmonella typhi pathogen in blood[J]. Disease Surveillance, 2012,27(4):325-329. (in Chinese) 樊粉霞,王淑京,娄静,等. 全血中伤寒沙门菌RT LAMP检测方法的建立[J].疾病监测,2012,27(4):325-329.
[2] National data of class A, B and C communicable disease in May 2012[J]. Disease Surveillance, 2012,27(6):421. (in Chinese) 2012年5月中国甲乙丙类传染病疫情动态简介[J].疾病监测,2012,27(6):421.
[3] Tran N, Abhilasha K,sabina D,et al. The sensitivity of real time PCR amplification targeting invasive Salmonella serovars in biological specimens[J]. BMC Infectious Diseases, 2010,10(5):125-133.
[4] Nagarajan AG, Karnam G, Lahir A, et al. Reliable means of diagnosis and serover determination of blood borne Salmonella strains:quick PCR amplification of unique genomic loci by novel primer sets[J]. J Clin Microbiol, 2009,47(8):2435-2441.
[5] Grace YN, Li MN, Raymond L, et al, Development of a novel multiplex PCR for the detection and differentiation of Salmonella enterica serovars Typhi and paratyphi A[J]. Res Microbiol, 2010,161(4):243-248.
[6] Fan FX, Lou J, Chen JC, et al. Detection of Salmonella typhi in blood with real time fluorescent quantitative reverse transcriptive polymerase chain reaction[J]. Disease Surveillance, 2012,27(6):471-474.(in Chinese) 樊粉霞,娄静,陈建才,等. 利用实时荧光定量反转录-聚合酶链反应方法检测血液中伤寒沙门菌[J].疾病监测,2012,27(6):471-474.
[7] Fan FX, Wang SJ, Lou J, et al. Establishment of RT LAMP technique to detect Salmonella typhi pathogen in blood[J]. Disease Surveillance, 2012,27(4):325-329. (in Chinese) 樊粉霞,王淑京,娄静,等. 全血中伤寒沙门菌RT LAMP检测方法的建立[J].疾病监测,2012,27(4):325-329.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 肖燕 | |
| 任志鸿 | |
| 樊粉霞 | |
| 阚飙 | |
| 祝丽玲 | |
| 闫梅英 | |
| PubMed | |
| Article by XIAO Yan | |
| Article by REN Zhi-hong | |
| Article by FAN Fen-xia | |
| Article by KAN Biao | |
| Article by ZHU Li-ling | |
| Article by YAN Mei-ying | |