Rapid identification of 7 enteropathogens with multiplex PCR assay
WANG Zeng-guo1, XIANG Lian2, LI Fang1, WEI Xiao-guang1, WU Shou-zhi1
Xi'an Center for Disease Control and Prevention, Xi'an 710054, Shaanxi, China
Abstract
Objective To establish a multiplex polymerase chain reaction (PCR) assay for the rapid detection and typing of Enterotoxigenic Escherichia coli (ETEC), Enteroinvasive Escherichia coli (EIEC), Enteropathogenic Escherichia coli (EPEC), Verotoxin-producing Escherichia coli (VTEC), Eteroaggregative Escherichia coli (EAEC), Shigella and Salmonella. Methods Thirteen pairs of primers for the detection of the 7 enteropathogens with multiplex PCR were designed. After electrophoresis, the specific fragments were observed to identify the pathogens. The clinical samples were inoculated to the selective agar at 37 ℃ for 18 hours, the half clones were selected for the complex PCR. Results All the standard strains could get the positive fragments with this complex PCR assay. Among 322 clinical samples from diarrhea patients, 24 strains of Shigella, including 7 S. flexneri strains and 17 S. sonnei strains, 5 Salmonella strains, 12 EPEC strains, 6 ETEC strains, 3 EIEC strains, 1 VTEC strain and 3 EAEC strains were detected. Conclusion This complex PCR assay is rapid and specific and can detect all the forms of Escherichia coli causing diarrhea, Shigella and Salmonella in a single reaction, which could be used in the rapid detection of common diarrheal pathogens.
一种多重PCR方法快速鉴定7种常见肠道病原菌
王增国1, 相莲2, 李芳1, 魏晓光1, 吴守芝1
1. 西安市疾病预防控制中心, 陕西 西安 710054;
2. 西安医学院附属医院
2. 西安医学院附属医院
摘要
目的 建立一种能够快速检测并分型5种致泻性大肠埃希菌、志贺菌及沙门菌的多重聚合酶链反应(multiplex polymerase chain reaction,M-PCR) 方法。 方法 设计针对7种常见肠道致病菌的12对引物,通过多重PCR方法扩增后电泳观察相应条带,确定病原菌。临床标本直接划线接种于肠道选择性平皿,挑取可疑菌落直接提取核酸进行多重PCR检测。 结果 所有标准菌株均能扩增到相应目的片段,322份腹泻病标本中使用该方法共检出志贺菌24株(福氏志贺菌7株、宋内志贺菌17株)、 沙门菌5株、EPEC共12株(均为aEPEC)、ETEC共6株(elt阳性3株;est阳性3株)、EIEC共3株、VTEC共1株(stx1和stx2A均阳性)、EAEC共3株。 结论 该方法快速特异,能同时检测7种常见肠道致病菌,可用于腹泻病常见病原的快速检验。
内容大纲
1 材料与方法
1.1 实验用参考菌株 5种致泻性大肠埃希菌参考菌株EDL933(EHEC)、2348/69(EPEC)、H10407(ETEC)、042(EAEC)、CMCC44825(EIEC)及大肠埃希菌ATCC25922、肠炎沙门菌参考菌株CMCC50041为西安市疾病预防控制中心(CDC)微生物检验室保存,志贺菌使用西安市CDC微生物检验室分离保存福氏4c志贺菌,编号0901。
1.2 主要试剂及仪器
Taq DNA 聚合酶、dNTP、100 bp DNA Marker购自大连宝生物公司;引物合成自上海英骏生物技术有限公司;Goldview核酸染料购自赛百盛公司;EDTA、Tris及硼酸为上海生工生物工程技术服务有限公司;离心机为湘仪公司产品、PCR扩增仪为美国M-J公司产品、凝胶成像仪为Bio-rad公司产品。
1.3 多重PCR方法
1.3.1 模板制备
采用水煮模板法。标准菌株过夜培养后,挑取适量菌落至分有50 μl灭菌纯水的EP管中,置于-20 ℃冰箱中,待液体冷冻后,置于煮沸水中煮沸25 min,取出EP管12 000 rpm离心5 min,取上清液作为模板。
1.3.2 多重PCR体系及扩增程序
结合文献中所述方法加以综合及调整 :25 μl反应体系中主要组分终浓度分别为MgCl2 2.5 mmol/L,dNTP均为0.3 mmol/L,各引物浓度为0.4 μmol/L(invE、aggR和estIa)、0.2 μmol/L(escV、stx2A、estIb、uidA、pic和stx1A)及0.1 μmol/L(bfpB、elt和invA)和2 U Taq DNA聚合酶。热循环程序如下,94 ℃预变性5 min,94 ℃变性30 s、63 ℃退火30 s、72 ℃延伸1.5 min,共30个循环,最后72 ℃延伸5 min。
1.3.3 PCR结果电泳检测
取6 μl PCR扩增产物混合加样缓冲液后,加入含5%Goldview的2.5%琼脂糖中,并同时加入DNA Marker,使用0.5×TBE电泳缓冲液,经120 V/cm电泳50 min。使用凝胶成像仪观察电泳结果。
1.4 临床应用
该多重PCR方法应用于2011年度西安市腹泻病监测标本中,患者粪便或肛拭子标本采集于Cary-Blair运送培养基送至实验室后,直接接种麦康凯培养基及XLD培养基,37 ℃培养18~24 h后挑取5个麦康凯平皿上大肠样菌落、乳糖不发酵菌落及XLD平皿上产H2S菌落(约半个菌落)直接水煮模板,进行多重PCR检测。所得阳性菌株的验证采用 常规生化鉴定(API20E)和/或WS 271-2007方法中所述方法进行PCR毒力基因鉴定。
2 结果
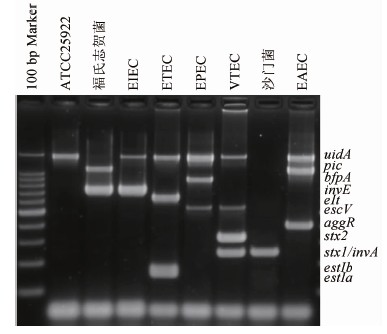
2.1 参考菌株多重PCR结果 所有参考菌株采用该多重PCR方法扩增后均能扩增到目的片段,测序结果与目的基因一致,结果见图1。
图1 多重PCR方法检测几种常见肠道致病菌电泳结果
Figure 1 Results of the multiplex PCR with reference strains
注:所有标准菌株均扩增出特异性片段:大肠埃希菌对照ATCC25922(uidA阳性)、福氏志贺菌F4c0901(pic,invE阳性)、EIEC CMCC44825(uidA,invE阳性)、ETEC H10407(uidA,elt,estIb,estIa阳性)、EPEC E2348/69(uidA,bfpA,escV阳性)、VTEC EDL933(uidA,escV,stx1A,stx2A阳性)、沙门菌CMCC50041(invA阳性)、EAEC042(uidA,pic,aggR阳性)、100 bp DNA Marker依次为1500,1000,900,800,700,600,500,400,300,200,100 bp。
2.2 临床应用验证
2.2.1 结果判定
由于95%的大肠埃希菌携带uidA基因,因此uidA基因主要用于区分大肠埃希菌与其他菌属,根据其他相应特异性及毒力基因并结合细菌菌落特征对待检菌株进行快速判断,结果判定见表1。
表1 多重PCR方法检测多种肠道致病菌的结果判断
Table 1 Identification of enteropathogens with this multiplex PCR assay
| 菌株 | uidA | escV | bfpB | stx1 | stx2 | elt | estIa | estIb | invE | aggR | pic | invA |
| 非致泻大肠埃希菌 | + | - | - | - | - | - | - | - | - | - | - | - |
| EIEC | + | - | - | - | - | - | - | - | + | - | - | - |
| ETEC | + | - | - | - | - | d(1) | d | d | - | - | - | - |
| EPEC | + | + | +/-(2) | - | - | - | - | - | - | - | - | - |
| VTEC | + | + | - | d | d | - | - | - | - | - | - | - |
| EAEC | + | - | - | - | - | - | - | - | - | + | +/- | - |
| 志贺菌 | - | - | - | - | - | - | - | - | + | - | +/- | - |
| 沙门菌 | - | - | - | - | - | - | - | - | - | - | - | + |
2.2.2 临床应用验证
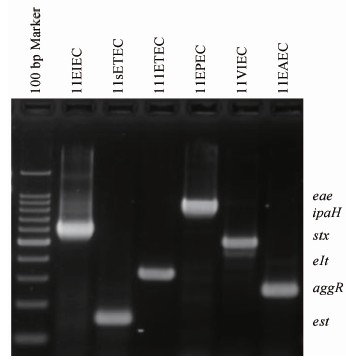
采用该多重PCR方法检测2011年322份腹泻病标本,共检出志贺菌24株(福氏志贺菌7株、宋内沙门菌17株)、 沙门菌5株、EPEC共12株(均为aEPEC)、ETEC共6株(elt阳性3株;est阳性3株)、EIEC共3株、VTEC共1株(stx1和stx2A均阳性)、EAEC共3株。其鉴定及初步分型结果见表2。所有菌株的生化反应鉴定结果均符合;致泻性大肠埃希菌用国家标准PCR方法进行证实,所有菌株鉴定结果均一致,见图2。
图2 致泻性大肠埃希菌临床分离株使用标准PCR电泳图
Figure 2 Results of the standard PCR with clinical Escherichia coli strains
表2 2011年西安市临床腹泻病患者中肠道病原菌鉴定及毒力基因检测
Table 2 Identification of enteropathogens and virulence gene from diarrhea patients samples in Xian,2011
| 肠道病原菌 | 毒力基因型 | 分离菌株数 |
| 福氏志贺菌 | invE、pic | 7 |
| 宋内志贺菌 | invE | 17 |
| 沙门菌 | invA | 5 |
| aEPEC | escV | 12 |
| ETEC1 | elt | 3 |
| ETEC2 | estIb | 3 |
| EIEC | invE | 3 |
| VTEC | stx1、stx2 | 1 |
| EAEC | aggR、pic | 3 |
使用本研究中多重PCR检测到的5种致泻性大肠埃希菌(11EIEC、11sETEC、11lETEC、11EPEC、11EPEC和11EAEC)使用标准PCR方法均可产生相应大小PCR片段。
3 讨论
目前,除STEC中的O157外,常规的细菌分离培养和生化鉴定方法难以鉴别致泻性大肠埃希菌至种水平。PCR方法是一种非常有效的分子生物学方法,它通过鉴定目的核酸的存在来检测临床标本中的病原体。它不仅具有特异性和敏感性高的优点,更具有能够快速高通量的特点。在粪便标本中,PCR方法可以有效的区分开肠道正常菌群的大肠埃希菌和致泻性大肠埃希菌[8]。由于致泻性大肠埃希菌采用常规的分离培养方法具有明显的限制性,采用多重PCR方法检测致泻性大肠埃希菌已经成了不少学者首选的方法 ,不同文献中也有较多的方法发表,但针对每种致泻性大肠埃希菌所采用的目的基因都基本相似。而Muller等[7]的方法虽然体系中引物数量多,但涵盖的致泻性大肠埃希菌类型较为全面,且运用该方法所产生的不同目的片段间相差约100 bp,电泳结果较易观察。扩增特异性也较好。
本方法通过去除不具有检测特异性的astA引物及添加沙门菌的特异性引物invA,并通过对体系的优化成功对参考菌株进行扩增和鉴定。在实际运用中发现针对EIEC的invE基因同样存在于志贺菌,以及用于EAEC的pic基因存在于福氏志贺菌中。在对笔者实验室所有保存的志贺菌的pic基因扩增中发现,该基因存在于所有52株福氏志贺菌中,而宋内志贺菌均不携带pic基因。这一结果和其他文献结论一致。因此本文所改良的方法可在鉴定多种致泻性大肠埃希菌的同时检测沙门菌及志贺菌,共计7种肠道致病菌,并可同时检测出5种致泻性大肠埃希菌的毒力基因型及并区分福氏志贺菌及宋内志贺菌。由于pic基因可存在于不同菌株中,因此对于鉴定的意义并不大,在临床应用中主要用于了解菌株间的毒力基因特征。
本文所述方法需要在临床应用中结合常规的分离培养,观察并挑取细菌单个菌落。标本接种选择性培养基培养后,可根据菌落特征选择可疑菌落,如多数的大肠埃希菌为乳糖发酵菌落、志贺菌为乳糖不分解菌落、沙门菌为乳糖不分解产H2S菌落。在结果的判定中,由于95%的大肠埃希菌均携带uidA(β-葡萄糖苷酶基因)[5],可根据uidA基因的存在与否加以初步区别。而本文中所加入的沙门菌invA基因扩增产物为244 bp,电泳结果和VTEC的stx1A基因扩增片段无法区别,可根据沙门菌在选择性平皿上(如XLD、SS等常用肠道选择性培养基)产生H2S菌落的特点,继而根据uidA基因的存在与否加以初步区别。同时作为ETEC的标志基因,estIa和estIb基因相差仅15 bp,笔者在使用小于2.5%的琼脂糖电泳根本无法区分。
为了避免在挑取菌落时造成的漏检,有学者已成功在Muller的体系中加入VTEC的其他毒力基因引物并能够直接通过粪便标本提取核酸后进行[12]。同时这一16重引物的多重PCR也已成功的应用于食品中致泻性大肠埃希菌的检测。我们也将在下一步研究直接从粪便(食品)核酸或选择性培养基1区菌落中刮取菌落进行筛选检测致泻性大肠埃希菌、沙门菌及志贺菌。
本方法实验结果特异性高,无非特异性扩增,能够在24 h之内(标本接种选择性培养基培养18 h后挑取可疑菌落进行PCR)对常见的7种肠道致病菌进行快速的筛选检测,同时能对近年来受到广泛关注的VTEC(如O157、O104)筛选检测。该方法能够应用于感染性腹泻病原检测和食物中毒疑似肠道致病菌污染的实验室检测中。并能初步了解病原菌分型特征。能够弥补常规方法对包括VTEC在内的致泻性大肠埃希菌检验的不足。为了解我国致泻性大肠埃希菌的人群感染或食品污染提供快速特异的实验方法。
( 志谢: 感谢河南省疾病预防控制中心夏胜利老师对本研究的技术支持!)
参考文献
[1] Lin XH, Ran L, Ma L, et al. Analysis on the cases of infectious diarrhea (other than cholera, dysentery,typhoid and paratyphoid) reported in China in 2010[J]. Chinese Journal of Food Hygiene, 2011,23:385-389.(in Chinese) 林羡华,冉陆,马莉,等.2010年全国其他感染性腹泻报告病例信息分析[J]. 中国食品卫生杂志,2011,23:385-389.
[2] Wei CY. The disease control and prevention strategy of infectious diarrhea in China[J]. Strait Journal of Preventive Medicine, 2006,12:1-4.(in Chinese) 魏承毓. 我国感染性腹泻的基本状况与防控对策[J]. 海峡预防医学杂志,2006,12:1-4.
[3] Yu XF, Pan JC, Meng DM, et al. Multiplex real time PCR detecting Salmonella, Shigella and diarrheagenic Escherichia coli[J]. Chiese Journal of Peventive Medicine, 2007,41:461-465. (in Chinese) 于新芬,潘劲草,孟冬梅,等. 多重实时PCR检测沙门菌、志贺菌和致泻性大肠埃希菌[J]. 中华预防医学杂志,2007,41: 461-465.
[4] Yu XF, Pan JC, Meng DM, et al. Detection of shiga toxin and intimin genes of diarrheagenic Escherichia coli using multiplex real time PCR[J]. Chinese Journal of Laboratory Medicine, 2007,5:529-532. (in Chinese) 于新芬,潘劲草,孟冬梅,等. 多重实时PCR检测致泻性大肠埃希菌志贺毒素和紧密素基因[J]. 中华检验医学杂志,2007,5:529-532.
[5] Zhu M, Ran L, Shen S, et al. Detection of diarrheagenic Escherichia coli with a Muti PCR method[J]. Chinese Journal of Preventive Medicine, 2010,44:345-347. (in Chinese) 朱敏,冉陆,沈圣,等. 多重PCR快速检测致泄大肠埃希菌[J]. 中华预防医学杂志,2010,44:345-347.
[6] Chiu CH, Ou JT. Rapid identification of Salmonella serovars in feces by specific detection of virulence genes, invA and spvC, by an enrichment broth culture multiplex PCR combination assay[J]. J Clin Microbiol, 1996,34:2619-2622.
[7] Muller D, Greune L, Heusipp G, et al. Identification of unconventional intestinal pathogenic Escherichia coli isolates expressing intermediate virulence factor profiles by using a novel single step multiplex PCR[J]. Appl Environ Microbiol, 2007,73:3380-3390.
[8] Nguyen TV, Le Van P, Le Huy C, et al. Detection and characterization of diarrheagenic Escherichia coli from young children in Hanoi, Vietnam[J]. J Clin Microbiol, 2005,43: 755-760.
[9] Persson S, Olsen KE, Scheutz F, et al. A method for fast and simple detection of major diarrhoeagenic Escherichia coli in the routine diagnostic laboratory[J]. Clin Microbiol Infect, 2007,13:516-524.
[10] Toma C, Lu Y, Higa N, et al. Multiplex PCR assay for identification of human diarrheagenic Escherichia coli[J]. J Clin Microbiol, 2003,41:2669-2671.
[11] Pass MA, Odedra R, Batt RM. Multiplex PCRs for identification of Escherichia coli virulence genes[J]. J Clin Microbiol, 2000,38:2001-2004.
[12] Antikainen J, Tarkka E, Haukka K, et al. New 16 plex PCR method for rapid detection of diarrheagenic Escherichia coli directly from stool samples[J]. Eur J Clin Microbiol Infect Dis, 2009,28:899-908.
[2] Wei CY. The disease control and prevention strategy of infectious diarrhea in China[J]. Strait Journal of Preventive Medicine, 2006,12:1-4.(in Chinese) 魏承毓. 我国感染性腹泻的基本状况与防控对策[J]. 海峡预防医学杂志,2006,12:1-4.
[3] Yu XF, Pan JC, Meng DM, et al. Multiplex real time PCR detecting Salmonella, Shigella and diarrheagenic Escherichia coli[J]. Chiese Journal of Peventive Medicine, 2007,41:461-465. (in Chinese) 于新芬,潘劲草,孟冬梅,等. 多重实时PCR检测沙门菌、志贺菌和致泻性大肠埃希菌[J]. 中华预防医学杂志,2007,41: 461-465.
[4] Yu XF, Pan JC, Meng DM, et al. Detection of shiga toxin and intimin genes of diarrheagenic Escherichia coli using multiplex real time PCR[J]. Chinese Journal of Laboratory Medicine, 2007,5:529-532. (in Chinese) 于新芬,潘劲草,孟冬梅,等. 多重实时PCR检测致泻性大肠埃希菌志贺毒素和紧密素基因[J]. 中华检验医学杂志,2007,5:529-532.
[5] Zhu M, Ran L, Shen S, et al. Detection of diarrheagenic Escherichia coli with a Muti PCR method[J]. Chinese Journal of Preventive Medicine, 2010,44:345-347. (in Chinese) 朱敏,冉陆,沈圣,等. 多重PCR快速检测致泄大肠埃希菌[J]. 中华预防医学杂志,2010,44:345-347.
[6] Chiu CH, Ou JT. Rapid identification of Salmonella serovars in feces by specific detection of virulence genes, invA and spvC, by an enrichment broth culture multiplex PCR combination assay[J]. J Clin Microbiol, 1996,34:2619-2622.
[7] Muller D, Greune L, Heusipp G, et al. Identification of unconventional intestinal pathogenic Escherichia coli isolates expressing intermediate virulence factor profiles by using a novel single step multiplex PCR[J]. Appl Environ Microbiol, 2007,73:3380-3390.
[8] Nguyen TV, Le Van P, Le Huy C, et al. Detection and characterization of diarrheagenic Escherichia coli from young children in Hanoi, Vietnam[J]. J Clin Microbiol, 2005,43: 755-760.
[9] Persson S, Olsen KE, Scheutz F, et al. A method for fast and simple detection of major diarrhoeagenic Escherichia coli in the routine diagnostic laboratory[J]. Clin Microbiol Infect, 2007,13:516-524.
[10] Toma C, Lu Y, Higa N, et al. Multiplex PCR assay for identification of human diarrheagenic Escherichia coli[J]. J Clin Microbiol, 2003,41:2669-2671.
[11] Pass MA, Odedra R, Batt RM. Multiplex PCRs for identification of Escherichia coli virulence genes[J]. J Clin Microbiol, 2000,38:2001-2004.
[12] Antikainen J, Tarkka E, Haukka K, et al. New 16 plex PCR method for rapid detection of diarrheagenic Escherichia coli directly from stool samples[J]. Eur J Clin Microbiol Infect Dis, 2009,28:899-908.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 王增国 | |
| 相莲 | |
| 李芳 | |
| 魏晓光 | |
| 吴守芝 | |
| PubMed | |
| Article by WANG Zeng-guo | |
| Article by XIANG Lian | |
| Article by LI Fang | |
| Article by WEI Xiao-guang | |
| Article by WU Shou-zhi | |