Establishment of novel real-time TaqMan PCR assay for detection of Citrobacter freundii
JIN Dong, WANG Yi-ting, BAI Xue-mei, YE Chang-yun, LIU Li-yun
State Key Laboratory for Communicable Disease Prevention and Control, Institute for Communicable Disease Prevention and Control, Chinese Center for Disease Control and Prevention, Beijing 102206, China
Abstract
Objective To establish a real-time TaqMan polymerase chain reaction (PCR) assay for the detection of Citrobacter freundii. Methods Primers and probe were designed based on the sequences of tricarboxylic transport (tct) gene.The target gene was cloned to pMD20-T vector to build the standard curve of this assay and evaluate the sensitivity of the assay. The specificity was evaluated by using 20 other enteropathogenic bacteria and isolates causing nosocomial infection. Results Sensitivity test of recombinant plasmids showed that the sensitivity could reach 1×101copies /reaction.Specificity test showed that no specific amplifications were presented for the 20 other enteropathogenic bacteria and the isolates causing nosocomial infection. The detection limit of this assay for artificially contaminated milk was 1.0×102cfu/ml. Conclusion This real-time TaqMan PCR assay is sensitive and specific for the rapid detection of Citrobacter freundii.
弗氏枸橼酸杆菌TaqMan实时荧光定量-聚合酶链反应检测方法的建立
金东, 王艺婷, 白雪梅, 叶长芸, 刘丽云
中国疾病预防控制中心传染病预防控制所, 传染病预防控制国家重点实验室, 北京 102206
摘要
目的 建立针对弗氏枸橼酸杆菌的TaqMan实时荧光定量-聚合酶链反应(real time-PCR)检测方法。 方法 针对弗氏枸橼酸杆菌的特有序列设计引物和TaqMan探针,扩增目的基因建立标准曲线,确定检测方法的灵敏度;对20种其他肠道致病菌及院内感染中常见的致病菌进行检测,评价该检测方法的特异性;使用牛奶模拟标本评价方法在实际检测工作中应用性。 结果 TaqMan real time-PCR检测方法对弗氏枸橼酸杆菌重组质粒的检测灵敏度为1.0×101拷贝/反应体系;该检测方法在检测30种其他肠道致病菌及院内感染中常见的致病菌时未出现特异性扩增。该检测方法对牛奶模拟样本中弗氏枸橼酸杆菌检测下限为1.0×102cfu/ml的菌量;通过对1.0×107、1.0×105和1.0×103三个浓度质粒标准品的重复检测,确定本方法的组内变异系数为1.90%~3.91%;组间变异系数为1.52%~1.69%。 结论 本研究建立的TaqMan real time-PCR检测方法可作为检测弗氏枸橼酸杆菌灵敏、特异、快速的方法。
内容大纲
-
1 材料与方法
- 1.1 材料
- 1.2 方法
- 1.2.1 引物和探针的合成
- 1.2.2 菌株基因组DNA的提取
- 1.2.3 质粒标准品的制备
- 1.2.4 普通PCR反应体系
- 1.2.5 TaqMan real time-PCR反应体系
- 1.2.6 特异性评价
- 1.2.7 牛奶模拟样本的检测
- 1.2.8 稳定性评价
- 2.1 目的基因片段的克隆和验证
- 2.2 TaqMan real time-PCR检测方法的灵敏度
- 2.3 TaqMan real time-PCR检测的特异性
- 2.4 TaqMan real time-PCR方法检测弗氏枸橼酸杆菌的组内和组间特异性
- 2.5 牛奶模拟样本检测结果
目前还没有特异的弗氏枸橼酸杆菌的筛选培养基,弗氏枸橼酸杆菌的鉴定也主要通过常规的生化反应。为了快速特异的检测和鉴定弗氏枸橼酸杆菌,我们根据弗氏枸橼酸杆菌的特异基因建立了弗氏枸橼酸杆菌灵敏、特异的TaqMan实时荧光定量-聚合酶链反应(real time-PCR)检测方法。
1 材料与方法
1.1 材料 1.1.1 菌株来源
弗氏枸橼酸杆菌、杨氏枸橼酸杆菌、布氏枸橼酸杆菌、科氏枸橼酸杆菌、罗氏枸橼酸杆菌、肠产毒素性大肠埃希菌(Enterotoxigenic E. coli, ETEC)、肠侵袭性大肠埃希菌(Enteroinvasive E. coli, EIEC)、肠致病性大肠埃希菌(Enteropathogenic E. coli, EPEC)、肠出血性大肠埃希菌(Enterohemorrhage E. coli, EHEC)、肠集聚性大肠埃希菌(Enteroaggregative E. coli, EAEC)、阪崎肠杆菌、单增李斯特菌、粘质沙雷菌、阴沟肠杆菌、铜绿假单胞菌、福氏志贺菌、类志贺邻单胞菌、嗜水气单胞菌和产气肠杆菌为本科室保存。
用于特异性检测的其他细菌核酸由中国疾病预防控制中心传染病预防控制所各科室提供,包括甲型副伤寒沙门菌、鼠伤寒沙门菌、肠炎沙门菌、羊布鲁氏菌、流感嗜血杆菌、小肠结肠炎耶尔森菌、汉赛巴尔通体、结核分枝杆菌及金黄色葡萄球菌等。
1.1.2 主要试剂与仪器设备
Premix Ex TaqTM Kit、PCR产物克隆试剂盒(pMD20-T Vector)、DL2000 DNA Marker和EasyDilution均购自宝生物工程(大连)有限公司。细菌基因组DNA提取试剂盒(Wizard Genomic DNA Purification Kit)购自Promega公司。PCR产物胶回收试剂盒(QIAquick Gel Extraction Kit)购自德国Qiagen公司。NanoDrop ND-1000分光光度计为美国Thermo公司产品。Gel Doc 2000凝胶成像系统为美国伯乐公司产品。Rotor Gene Q实时荧光定量PCR仪为德国Qiagen公司产品。
1.2 方法
1.2.1 引物和探针的合成
根据本实验室完成的弗氏枸橼酸杆菌测序菌株信息寻找弗氏枸橼酸杆菌的特异基因,最终确定tct基因为弗氏枸橼酸杆菌的特异基因。选择其稳定的保守区域作为检测靶标序列,应用Primer Express 3.0软件设计引物和探针(表1)。引物和探针均由上海基康生物公司合成。
1.2.2 菌株基因组DNA的提取
菌株基因组DNA 的提取使用Promega公司的Wizard Genomic DNA
表1 引物与探针序列
Table 1 Primers and probe sequences of real-ime PCR to detect Citrobacter freundii
| 引物及探针名称 | 序列(5′~3′) | 扩增产物大小(bp) |
| TCT-F | GCA GGA CAG GAA GCG TCT G | |
| TCT-R | CAG CCG ACC ATC TTT TAC ATA GC | 126 |
| TCT-Probe | AGC CGC TGA ACG ACT TCC AGA CCA |
Purification Kit,按照说明书进行操作。使用NanoDrop ND-1000分光光度计测定细菌基因组DNA的纯度和浓度,基因组DNA少量分装,-20 ℃保存备用。
1.2.3 质粒标准品的制备
以表1引物,扩增目的基因126 bp,切胶回收,纯化PCR产物;然后连接到pMD20T载体并转化JM109感受态细胞;筛选阳性克隆子,测序验证。提取质粒,根据质粒的分子量将质粒样品浓度换算为拷贝数浓度;每μl样品中检测基因的拷贝数=浓度(ng/μl)×阿佛加德罗常数×10-9/(660×重组质粒碱基数)。用EasyDilution将上述质粒依次稀释成1.0×100~1.0×109拷贝/μl,共10个浓度梯度。
1.2.4 普通PCR反应体系
普通PCR反应总体系为20 μl,含10×Buffer(Mg2+ plus) 2 μl、dNTPs (10 mmol/L) 1 μl、 ExTaq DNA 聚合酶0.2 μl、上下游引物(10 μmol/L)各1 μl、模板DNA 1 μl、无菌水13.8 μl。PCR循环参数:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸45 s,共30个循环;72 ℃延伸7 min。同时用无菌水代替模板DNA作为空白对照。反应结束后,取5 μl PCR产物在1.5%的琼脂糖凝胶上进行电泳,在凝胶成像系统上观察结果。
1.2.5 TaqMan real time-PCR反应体系
实时荧光TaqMan PCR反应总体系为20 μl,含2×Premix Ex TaqTM 10 μl;上下游引物(10 μmol/L)各0.4 μl,Reverse primer(10 μmol/L)0.4 μl,BHQ-Probe(10 μmol/L)0.4 μl,模板DNA 1.0 μl,无菌水7.8 μl。在Rotor Gene Q实时荧光定量PCR仪上扩增并测定结果。荧光定量PCR循环参数:95 ℃预变性30 s;95 ℃变性5 s,60 ℃延伸30 s,共40个循环。扩增结束后,扣除本底荧光信号后取同一阈值分析数据,确定各样本的Ct(cycle threshold)值。
1.2.6 特异性评价
以常见致病菌及条件致病菌DNA 为模板评价TaqMan实时荧光PCR体系的特异性。
1.2.7 牛奶模拟样本的检测
取振荡过夜的弗氏枸橼酸杆菌50 μl接种于5 ml LB培养液中,摇菌至A值为0.60,菌落计数为5.0×108。首先使用 磷酸盐缓冲液 将菌液原液稀释至1.0×108,然后磷酸盐缓冲液连续10倍稀释为1.0×100~1.0×107cfu/ml。将各个稀释度的菌液污染牛奶,并参照文献的方法[8]提取细菌核酸:取l ml牛奶,加入0.1 ml各个稀释度的菌液,取100 μl奶样分别加入0.05 mg蛋白酶K、50 μl 0.1%Triton X-100,混匀,37 ℃ 30 min,加入900 μl 150 mmol/L NaCl,反复混匀,13 000 rpm离心10 min,小心弃去上清,取沉淀用100 μl 150 mmol/L NaCl重悬。提取基因组DNA,平行检测3次。
1.2.8 稳定性评价
对浓度为1.0×107、1.0×105及1.0×102的质粒标准品一个批次内重复检测10次以计算其组间变异系数;不同批次重复检测10次以计算其组间变异系数。
2 结果
2.1 目的基因片段的克隆和验证 实验获得的tct基因扩增片段分子质量大小与预期结果一致。将所得片段转入T载体中,经测序验征,所获阳性克隆包含的目的片段序列完全相同。
2.2 TaqMan real time-PCR检测方法的灵敏度
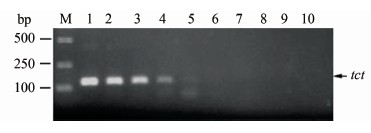
将质粒标准品进行普通PCR扩增显示,当每反应体系中重组质粒的模板数降到104拷贝/μl以下时,普通PCR扩增后未出现目的条带 (图1)。
图1 普通PCR对弗氏枸橼酸杆菌tct基因检测的灵敏度
Figure 1 Sensitivity of conventional PCR to detect tct gene of Citrobacter freundii 注:M为分子量Marker; 1~9分别是模板量为1.0×108~1.0×100拷贝/μl的质粒标本;10为阴性对照。
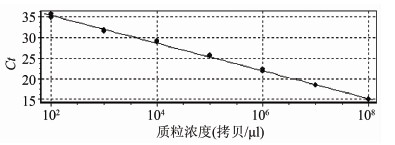
用与普通PCR检测方法相同的质粒稀释梯度作为模板进行实时荧光PCR检测的结果显示:当质粒标准品浓度为1.0×108~1.0×101拷贝/μl时,均有阳性扩增。在该TaqMan实时荧光PCR检测方法体系中,靶基因扩增反应的Ct值与模板浓度之间存在良好的线性关系,相关系数为0.998(图2、3)。
图2 TaqMan实时荧光PCR对弗氏枸橼酸杆菌tct基因检测灵敏度
Figure 2 Sensitivity of real-time TaqMan PCR to detect tct gene of Citrobacter freundii
图3 实时荧光TaqMan PCR检测弗氏枸橼酸杆菌tct基因的标准曲线
Figure 3 Standard curve of real-time TaqMan PCR to detect tct gene of Citrobacter freundii
为了更好的评价该TaqMan real time-PCR检测方法的检测下线,我们对质粒标准品浓度为1.0×103~1.0×100拷贝/μl三个稀释浓度分别进行了4次平行实验。结果1.0×101拷贝/μl的4次反应均有检测信号。因此我们认为检测下限为1.0×101拷贝/μl。
由此可见,我们建立的实时荧光PCR检测方法对弗氏枸橼酸杆菌质粒标准品的检测灵敏度比普通PCR方法高1000倍。
2.3 TaqMan real time-PCR检测的特异性
除48株弗氏枸橼酸杆菌外,其他30种肠道病原菌及院内感染的常见致病菌,包括杨氏枸橼酸杆菌、布氏枸橼酸杆菌、科氏枸橼酸杆菌、罗氏枸橼酸杆菌、ETEC、EIEC、EPEC、EHEC、EAEC、阪崎肠杆菌、单增李斯特菌、粘质沙雷菌、阴沟肠杆菌、铜绿假单胞菌、福氏志贺菌、类志贺邻单胞菌、嗜水气单胞菌、产气肠杆菌、甲型副伤寒沙门菌、鼠伤寒沙门菌、肠炎沙门菌、羊布鲁氏菌、流感嗜血杆菌、小肠结肠炎耶尔森菌、汉赛巴尔通体、结核分枝杆菌和金黄色葡萄球菌均未出现特异扩增(表2)。说明该检测方法特异性很好。
表2 实验菌株及TTRP检测结果
Table 2 Strains of this study and TaqMan PCR results of tct gene
| 菌株名称 | 拉丁名称 | 来源 | 菌株数 | tct基因阳性菌株数 |
| 弗氏枸橼酸杆菌 | Citrobacter freundii | ATCC 43864及分离株 | 48 | 48 |
| 杨氏枸橼酸杆菌 | Citrobacter youngae | ATCC 29220及分离株 | 50 | 0 |
| 布氏枸橼酸杆菌 | Citrobacter braakii | 分离株 | 9 | 0 |
| 科氏枸橼酸杆菌 | Citrobacter koseri | ATCC BAA-895 | 1 | 0 |
| 罗氏枸橼酸杆菌 | Citrobacter rodentium | ATCC BAA-352 | 1 | 0 |
| 肠集聚性大肠埃希菌 | Enteroaggregative E. coli | 17-2 和EcO422 | 2 | 0 |
| 肠出血性大肠埃希菌 | Enterohemorrhage E. coli | EDL933及分离株 | 90 | 0 |
| 肠侵袭性大肠埃希菌 | Enteroinvasive E. coli | CMCC 44825 | 1 | 0 |
| 肠致病性大肠埃希菌 | Enteropathogenic E. coli | 2348/69 | 1 | 0 |
| 肠产毒性大肠埃希菌 | Enterotoxigenic E. coli | 10407 | 1 | 0 |
| 鼠伤寒沙门菌 | Salmonella typhimurium | ATCC CT18及分离株 | 2 | 0 |
| 甲型副伤寒沙门菌 | Salmonella paratyphi | ATCC 9150 | 1 | 0 |
| 肠炎沙门菌 | Salmonella enteritidis | CMCC 50336 | 1 | 0 |
| 小肠结肠炎耶尔森菌 | Yersinia enterocolitica | ATCC 23715 | 1 | 0 |
| 阪崎肠杆菌 | Enterobacter Sakazakii | 分离株 | 1 | 0 |
| 羊布鲁氏菌 | Brucella melitensis | 分离株 | 1 | 0 |
| 流感嗜血杆菌 | Haemophilus influenzae | 分离株 | 1 | 0 |
| 坂崎肠杆菌 | Enterobacter Sakazakii | ATCC 45401 | 1 | 0 |
| 福氏志贺菌 | Shigella flexneri | 分离株 | 10 | 0 |
| 类志贺邻单胞菌 | Plesiomonas shigelloides | ATCC 51903 | 1 | 0 |
| 嗜水气单胞菌 | Aeromonas hydrophila | 分离株 | 1 | 0 |
| 铜绿假单胞菌 | Pyocyanic pneumonia | ATCC 15442 | 1 | 0 |
| 嗜水气单胞菌 | Aeromonas hydrophila | ATCC 7966 | 1 | 0 |
| 结核分枝杆菌 | Mycobacterium tuberculosis | 分离株 | 1 | 0 |
| 汉赛巴尔通体 | Bartonella henselae | 分离株 | 1 | 0 |
| 单增李斯特菌 | Listeria monocytogenes | CMCC 54003 | 1 | 0 |
| 金黄色葡萄球菌 | Staphyloccocus aureus | ATCC 6538 | 1 | 0 |
| 产气肠杆菌 | Enterobacter aerogenes | ATCC 13048 | 1 | 0 |
| 阴沟肠杆菌 | Enterobacter cloacae | ATCC 13047 | 1 | 0 |
| 阴沟肠杆菌 | Enterobacter cloacae | 分离株 | 1 | 0 |
| 粘质沙雷菌 | Serratia marcescens | 分离株 | 1 | 0 |
2.4 TaqMan real time-PCR方法检测弗氏枸橼酸杆菌的组内和组间特异性
分别选取高、中、低3个浓度的质粒标准品进行重复检测以确定本方法的组内和组间变异系数。在同一批次试验中重复检测1.0×107、1.0×105和1.0×103三个浓度的质粒标准品10次,计算其组内变异系数为1.31%~1.66%;不同批次重复检测1.0×107、1.0×105和1.0×103三个浓度的质粒标准品10次,确定其组间变异系数为2.11%~2.45%。
2.5 牛奶模拟样本检测结果
当1 ml牛奶加入的菌量为1.0×108~1.0×100cfu/ml时,用TaqMan实时荧光PCR体系检测结果,如图中1~7模板量依次为1.0×108~1.0×102cfu/ml的菌量;NTC是空白对照。在该PCR检测方法中,靶基因扩增反应的Ct值与菌量稀释度之间均存在良好的线性关系,相
图4 TaqMan real time-PCR对牛奶模拟标本中弗氏枸橼酸杆菌tct基因检测灵敏度
Figure 4 Sensitivity of real-time TaqMan PCR to detect tct gene of Citrobacter freundii in artificially contaminated milk
关系数为0.998,提示实时荧光PCR检测方法对牛奶模拟样本中弗氏枸橼酸杆菌检测下线为1.0×102 cfu/ml的菌量。
3 讨论
弗氏枸橼酸杆菌作为人类肠道的共生菌,很少被人们所关注。但是近年来在食品和腹泻患者的粪便中不断分离到弗氏枸橼酸杆菌,提示弗氏枸橼酸杆菌可能是一种潜在的病原菌 。目前,还没有特异的弗氏枸橼酸杆菌的筛选培养基,弗氏枸橼酸杆菌的鉴定主要依靠传统的生化鉴定方法,此种方法费用高,耗时长,主观因素影响大。
TaqMan real time-PCR技术由于其自身的优势被广泛应用于多种病原微生物的检测工作,与普通PCR方法不同的是,TaqMan real time-PCR在普通PCR的基础上加入一条特异的荧光探针,其对引物与模板的同源性要求也高于普通PCR,因此real time-PCR方法比普通PCR法具有更高的特异性。本研究针对弗氏枸橼酸杆菌的保守基因设计引物和荧光探针,建立了弗氏枸橼酸杆菌TaqMan real time-PCR检测方法,与传统的分离培养、生化鉴定的方法相比,本实验建立的 TaqMan real time-PCR方法1天内即可完成对弗氏枸橼酸杆菌的检测工作。我们通过对质粒标准品的检测发现该体系检测的灵敏度明显高于普通PCR。该体系在区分弗氏枸橼酸杆菌与其他30种肠道病原菌及院内感染的常见致病菌中具有很高的特异性。通过对牛奶模拟标本的检测证明本体系在牛奶模拟标本中的检测下限为10×102cfu/ml。
目前,在国内外研究中,还没有对弗氏枸橼酸杆菌进行荧光定量PCR检测方法的报道。本研究建立的TaqMan real time-PCR方法为临床标本的检测提供了可靠的技术依据,通过检测牛奶模拟标本中的弗氏枸橼酸杆菌,为在食品中检测弗氏枸橼酸杆菌提供了基础。但是本实验建立的方法应用效果还需要更多标本的验证。另外TaqMan real time-PCR方法对仪器设备、实验环境、实验试剂及耗材和实验人员的操作等均有一定的要求,这限制了此方法在基层实验室的应用。
参考文献
[1] Deal EN, Micek ST, Ritchie DJ, et al. Predictors of in-hospital mortality for bloodstream infections caused by Enterobacter species or Citrobacter freundii[J]. Pharmacotherapy,2007,27(2):191-199.
[2] Liu CP, Weng LC, Tseng HK, et al. Cefotaxime-resistant Citrobacter freundii in isolates from blood in a tertiary teaching hospital in Northern Taiwan[J].J Infect,2007,55(4):363-368.
[3] Doulgeraki AI, Paramithiotis S, Nychas GJ. Characterization of the Enterobacteriaceae community that developed during storage of minced beef under aerobic or modified atmosphere packaging conditions[J]. Int J Food Microbiol,2011,145(1):77-83.
[4] Giammanco GM, Aleo A, Guida I, et al.Molecular epidemiological survey of Citrobacter freundii misidentified as Cronobacter spp. (Enterobacter sakazakii) and Enterobacter hormaechei isolated from powdered infant milk formula[J]. Foodborne Pathog Dis,2011,8(4):517-525.
[5] Huang FZ, Xu SH. Investigation of a bacterial food poisoning case[J].Journal of Preventive Medicine Information,2008,24(2):135-136.(in Chiness) 黄凤珍,徐少华.一起细菌性食物中毒调查.[J] 预防医学情报杂志,2008,24(2):135-136.
[6] Chen CD, Zhen ZX, Zhuo F, et al. Investigation on an outbreak of food poisoning casse by C.aerogenes[J]. Modern Preventive Medicine,2012,39(2):299-301,306.(in Chinese) 陈传德,郑泽璇,卓菲,等. 一起由弗劳地枸橼酸杆菌引起的食物中毒暴发调查 [J].现代预防医学,2012,39(2):299-301,306.
[7] Gong XJ, Song LG, Jia WH, et al.Laboratory detection and analysis of an outbreak of food poisoning caused by Citrobacter freundii [J].Henan Journal of Preventive Medicine,2011,22(6):482,485.(in Chinese) 宫晓君,宋利国,贾维华,等.一起由弗劳地枸橼酸杆菌引起的食物中毒实验室检测分析[J].河南预防医学杂志,2011,22(6):482,485.
[8] Xu HH, Xie F, Lei LC.Development of detection method for shigella in milk by polymerase chain reaction[J].Food Safety and Quality Detection Technology,2010,27(1):43-48.(in Chinese) 许会会,谢芳,雷连成.牛奶中志贺氏菌PCR检测方法的建立 [J].食品安全质量检测学报,2010,27(1):43-48.
[2] Liu CP, Weng LC, Tseng HK, et al. Cefotaxime-resistant Citrobacter freundii in isolates from blood in a tertiary teaching hospital in Northern Taiwan[J].J Infect,2007,55(4):363-368.
[3] Doulgeraki AI, Paramithiotis S, Nychas GJ. Characterization of the Enterobacteriaceae community that developed during storage of minced beef under aerobic or modified atmosphere packaging conditions[J]. Int J Food Microbiol,2011,145(1):77-83.
[4] Giammanco GM, Aleo A, Guida I, et al.Molecular epidemiological survey of Citrobacter freundii misidentified as Cronobacter spp. (Enterobacter sakazakii) and Enterobacter hormaechei isolated from powdered infant milk formula[J]. Foodborne Pathog Dis,2011,8(4):517-525.
[5] Huang FZ, Xu SH. Investigation of a bacterial food poisoning case[J].Journal of Preventive Medicine Information,2008,24(2):135-136.(in Chiness) 黄凤珍,徐少华.一起细菌性食物中毒调查.[J] 预防医学情报杂志,2008,24(2):135-136.
[6] Chen CD, Zhen ZX, Zhuo F, et al. Investigation on an outbreak of food poisoning casse by C.aerogenes[J]. Modern Preventive Medicine,2012,39(2):299-301,306.(in Chinese) 陈传德,郑泽璇,卓菲,等. 一起由弗劳地枸橼酸杆菌引起的食物中毒暴发调查 [J].现代预防医学,2012,39(2):299-301,306.
[7] Gong XJ, Song LG, Jia WH, et al.Laboratory detection and analysis of an outbreak of food poisoning caused by Citrobacter freundii [J].Henan Journal of Preventive Medicine,2011,22(6):482,485.(in Chinese) 宫晓君,宋利国,贾维华,等.一起由弗劳地枸橼酸杆菌引起的食物中毒实验室检测分析[J].河南预防医学杂志,2011,22(6):482,485.
[8] Xu HH, Xie F, Lei LC.Development of detection method for shigella in milk by polymerase chain reaction[J].Food Safety and Quality Detection Technology,2010,27(1):43-48.(in Chinese) 许会会,谢芳,雷连成.牛奶中志贺氏菌PCR检测方法的建立 [J].食品安全质量检测学报,2010,27(1):43-48.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 金东 | |
| 王艺婷 | |
| 白雪梅 | |
| 叶长芸 | |
| 刘丽云 | |
| PubMed | |
| Article by JIN Dong | |
| Article by WANG Yi-ting | |
| Article by BAI Xue-mei | |
| Article by YE Chang-yun | |
| Article by LIU Li-yun | |