Detection of echovirus 30 causing aseptic meningitis outbreak in Quanzhou and analysis on its genetic characteristics and molecular evolution
ZHENG You-xian1, LIU Jian-zhong1, WENG Yu-wei2, CHEN Wei2, LIN Bi-lian1, CHEN Ming-chun1
Quanzhou Center for Disease Control and Prevention, Quanzhou 362000, Fujian, China
Abstract
Objective To understand the pathogen causing an aseptic meningitis outbreak in Quanzhou in 2011 and pathogen's genetic characteristics and molecular evolution. Methods Clinical specimens were collected from the aseptic meningitis cases to detect enterovirus 71 (EV71), coxsackievirus A16 (Cox A16) and universal RNA by using real-time RT-PCR. The complete nucleotide sequencing of VP1 region of 5 random positive specimens were conducted, BLAST program was used to identify the genotype by nucleotide pairwise-alignment with al1 available sequences in GenBank database, and the phylogenetic tree was drawn to compare with other enterovira1sequences. Results Real-time RT-PCR indicated that 39 of 47 clinical specimens were universal enterovirus positive but not EV71 or Cox A16. The complete nucleotide sequence of VP1 region of 5 enterovirus isolates was 876nt with homology of >98.9%, and had closer relationships with echovirus 30. These strains had close distance with the strains isolated in Henan and Zhejiang in 2008 and far distance with those isolated in Taiwan of China (2001) and India (2011). When compared with echovirus 30 prototype strain Bastianni, the distance was farthest. Conclusion Echovirus 30 circulated in Quanzhou in 2011 and caused aseptic meningitis outbreak in some areas. Phylogenetic trees analyses showed that the strains isolated from this outbreak had close distance with these isolated in China in recent years and far distance with those isolated abroad.
无菌性脑膜炎暴发中病原学检测及埃柯30型肠道病毒的基因特征和分子进化分析
郑友限1, 刘建忠1, 翁育伟2, 陈炜2, 林碧莲1, 陈明春1
1. 泉州市疾病预防控制中心, 福建 泉州 362000;
2. 福建省疾病预防控制中心
2. 福建省疾病预防控制中心
摘要
目的 了解引起福建省泉州地区2011年无菌性脑膜炎暴发疫情的埃柯30型肠道病毒(echovirus 30,ECHO30)病原及基因特征,分析基因变异情况及进化来源。 方法 对泉州市2011年无菌性脑膜炎暴发疫情中的临床样本采用实时荧光定量反转录-聚合酶链反应(rRT-PCR)方法进行肠道病毒通用型、肠道病毒71型(EV71)和柯萨奇病毒A组16型(Cox A16)核酸检测,随机选5份阳性样本进行肠道病毒VP1区核苷酸序列测定,将测序所得VP1序列用BLAST程序在GenBank上序列搜寻比对,确定其基因型, 并通过构建进化树分析其遗传进化规律。 结果 47份样本经rRT-PCR检测,有39份非EV71和Cox A16的其他肠道病毒核酸阳性, 5份阳性样本的肠道病毒VP1区核苷酸序列均为876 bp,且同源性最高,均大于98.9%,最高仅相差一个核苷酸,与它们具有较高同源性的均是ECHO30。与本次分离株亲缘关系最近的一组ECHO30分别是2008年河南省和浙江省的分离株,与中国台湾2001年无菌性脑炎分离株以及印度2011年分离株则距离较远;原型株Bastianni和20世纪90年代美国分离株和本次分离到的ECHO30毒株距离最远。 结论 2011年ECHO30在泉州地区发生一定程度的传播流行,并导致无菌性脑膜炎疫情的局部暴发流行,进化树分析表明本次分离株与国内近年ECHO30分离株亲缘关系较近,而与国外分离株则相对较远。
内容大纲
-
1 材料与方法
- 1.1 标本来源
- 1.2 病毒RNA核酸提取
- 1.3 实时荧光定量反转录-聚合酶链反应(rRT-PCR)检测
- 1.4 肠道病毒VP1区核苷酸序列测定
- 1.5 病毒型别判定和同源性分析
- 2.1 流行情况
- 2.2 rRT-PCR检测
- 2.3 VP1区核苷酸序列分析及病毒型别判定
- 2.4 ECHO30分离株VP1区氨基酸序列同源性比较
- 2.5 ECHO30 VP1区遗传进化树分析
1 材料与方法
1.1 标本来源 安溪县、德化县疾病预防控制中心(CDC)从256例疑似无菌性脑膜脑炎患者中选择新发、症状典型的30例(其中安溪县2所学校11例、德化县3所学校19例)进行样本采集,其中咽拭子30份、脑脊液8份及粪便9份,总共47份样本于4 ℃冷藏条件下,及时运送至泉州市CDC实验室。
1.2 病毒RNA核酸提取
采用QIAGEN公司的QIAamp Viral RNA Mini Kit试剂盒提取,分别吸取咽拭子/疱疹液/脑脊液标本140 μl加入560 μl的AVL缓冲液,混匀,室温放置15 min;加入560 μl无水乙醇,混匀,瞬时离心;分2次(每次约630 μl)将混合溶液加至QIAamp柱中,将QIAamp柱套在收集管上,8000 r/min离心5 s,弃去过滤液,换一新的收集管,小心加入750 μl的AW1缓冲液,8000 r/min离心5 s,弃去过滤液,小心加入750 μl的AW2缓冲液,8000 r/min离心5 s,弃去过滤液,13 000 r/min再次离心1 min;将QIAamp柱放入一支干净的1.5 ml离心管中。向膜上加入35 μl EB缓冲液, 室温放置5 min, 8000 r/min离心1 min,离心管中液体即为提取的病毒RNA,并立即对RNA进行反转录,或置-70 ℃保存备用。
1.3 实时荧光定量反转录-聚合酶链反应(rRT-PCR)检测
采用上海之江生物科技有限公司的肠道病毒通用型、肠道病毒71型(human enterovirus 71,EV71)和柯萨奇病毒A组16型(coxsackievirus A16,Cox A16)核酸测定试剂盒(荧光PCR法),反应条件为45 ℃反转录10 min, 95 ℃预变性15 min,95 ℃ 15 s;60 ℃ 1 min,扩增40个循环,在60 ℃时收集FAM荧光,反应在AB公司的7500荧光定量PCR仪上进行。
1.4 肠道病毒VP1区核苷酸序列测定
参照文献[1],合成了一对肠道病毒VP1区两侧分别位于VP3区和2A区的简并引物:008(5′-GCR TGC AAT GAY TTC TCW GT-3′ 2411~2430 nt)和011(5′-GCI CCI GAY TGI TGI CCR AA-3 ′ 3408~3389nt),随机选取5份分别来自上述5所学校不同患者样本(经rRT-PCR检测为肠道病毒通用型阳性,而EV71和Cox A16为阴性者)的病毒RNA提取液(编号分别为FJ-QZ01-11、FJ-QZ02-11、FJ-QZ03-11、FJ-QZ04-11、FJ-QZ05-11),采用QIAGEN公司的One Step RT-PCR Kit试剂盒进行反转录-聚合酶链反应(RT-PCR),反应条件为50 ℃30 min,94 ℃ 10 min进行反转录和变性,然后94 ℃ 30 s, 50 ℃ 30 s,72 ℃ 1 min,35个循环,转入 72 ℃ 10 min,反应在Bio-Rad公司的C1000梯度PCR仪上进行。PCR产物用QIAGEN公司快速纯化试剂盒(QIA quick purificat ion Kit)进行纯化,然后在AB公司3100型全自动测序仪上采用Sanger末端双脱氧终止法,双向标记测定VP1基因的全长。
1.5 病毒型别判定和同源性分析
将测序所得VP1序列通过NCBI网站用BLAST程序在GenBank上进行序列搜寻比对,确定其基因型VP1读码框位置。并用DNAstar megAlign软件对核苷酸和氨基酸序列处理分析,用Jotun Hein方法进行同源性分析以及绘制遗传进化树, 11株参比肠道病毒ECHO30的VP1序列均取自GenBank数据库。
2 结果
2.1 流行情况 2011年3 5月泉州地区安溪、德化等地陆续发生了不明原因脑膜炎的暴发,患者集中在15岁以下儿童,且临床症状相似,表现为发热、头痛、恶心、呕吐,病程3~10 d,预后良好,无致死病例出现,无后遗症。前后共报告病例256例,患者年龄均<15 岁,其中≤5岁占调查数的9%,6~10岁占调查数62%,11~15岁占调查数的29%,男性病例占总病例数的67.6%,女性占32.4%。
2.2 rRT-PCR检测
30例患者(其中≤5岁4例,6~10岁19例,11~15岁7例;男性22例,女性8例)共47份样本经rRT-PCR检测,39份(其中咽拭子23份,脑脊液8份及粪便8份)为EV71和Cox A16核酸阴性,而肠道病毒通用型核酸阳性,其余8份三者均为阴性。
2.3 VP1区核苷酸序列分析及病毒型别判定
经序列测定,5株病毒(3株来自咽拭子,2株来自脑脊液,且均分离自不同患者)VP1区全长876个核苷酸,将得到的核苷酸序列输入NCBI的GenBank数据库中,用BLAST进行相关序列的检索和比对,结果5株病毒同源性最高,均大于98.9%,其中最高为FJ-QZ01-11和FJ-QZ02-11同源性为99.7%,仅相差一个核苷酸,证明5株病毒属于同一型别,且来源相同。5株所测序列及部分参考株序列对比见图1。与它们具有较高同源性的全是ECHO30,与其他任何一型肠道病毒VP1上核苷酸的同源性均不足75%,其中与来自浙江的ECHO30毒株Zhejiang-15-03同源性最高为95%左右,其次为来自河南的Henan-06-2008,同源性为92%左右,而与ECHO30原型株Bastianni相应区段核苷酸序列的同源性为81%左右,见表1。根据肠道病毒同一血清型核苷酸和氨基酸同源性应分别超过75%和88%的原则可认为与ECHO30原型株VP1区核苷酸序列高度同源的5株病毒属于ECHO30[2],见表1。
2.4 ECHO30分离株VP1区氨基酸序列同源性比较
2株ECHO30分离株VP1区氨基酸序列完全相同,均为292aa,见图2,与它们同源性最为接近的是国内已公布河南、浙江等省的ECHO30分离株, 最多有2个氨基酸的差异,其次同源性较近的是台湾2001年无菌性脑膜炎分离株,有7个氨基酸差异,而与欧美地区分离株及原型株Bastianni同源性较低, 但变异区域较分散, 无集中变异区。
2.5 ECHO30 VP1区遗传进化树分析
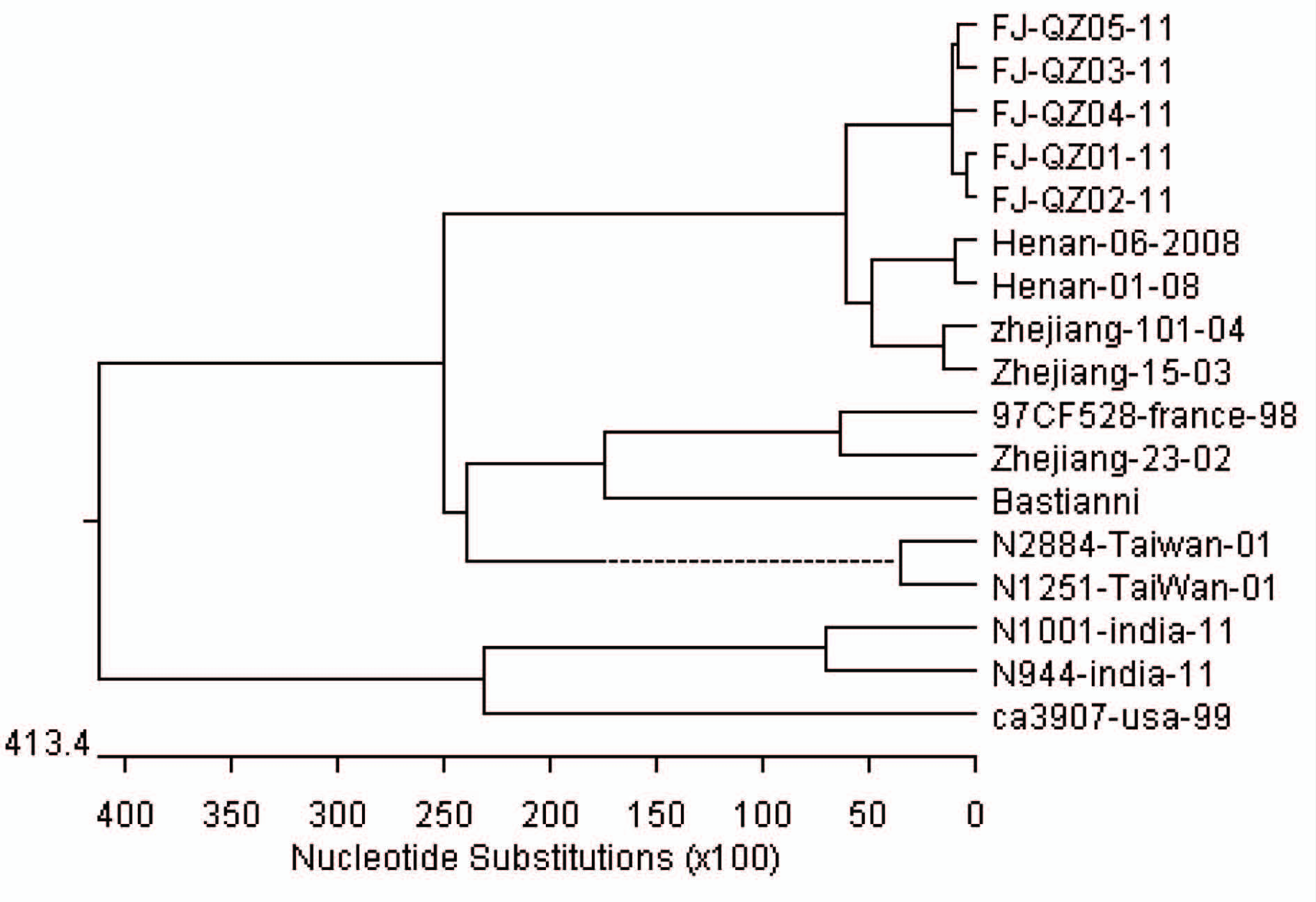
为了进一步分析本次ECHO30分离株的遗传进化性质,基因变异规律以及与国内外ECHO30病毒的遗传进化关系, 我们将株5株分离株病毒与不同时期、不同国家和地区的ECHO30分离株VP1区采用DNAstar megAlign软件构建进化树,见图3。5株本次暴发疫情分离株位于同一支,证明其相同来源;与本次分离株亲缘关系最近的一组ECHO30病毒分别是从2008年河南省的分离株Henan-06-2008和Henan-01-08以及浙江省的分离株Zhejiang-101-04和Zhejiang-15-03,中国台湾2001年无菌性脑炎分离株N2884-Taiwan-01和N1251-Taiwan-01以及印度2011年分离株N1001-india-11和N944-india-11则距离较远;原型株Bastianni90年代美国分离株ca3907-usa-99和本次分离到的ECHO30毒株距离最远。
图1 泉州地区ECHO30分离株VP1区核苷酸序列与部分参考株序列比较
Figure 1 Comparison of nucleotide sequence in VP1 region between echovirus 30 strains isolated in Quanzhou and reference strains
表1 泉州地区ECHO30分离株与ECHO30参考株VP1区核苷酸序列同源性比较
Table 1 Comparison of nucleotide sequence homology in VP1 region between echovirus 30 strains isolated in Quanzhou and reference strains
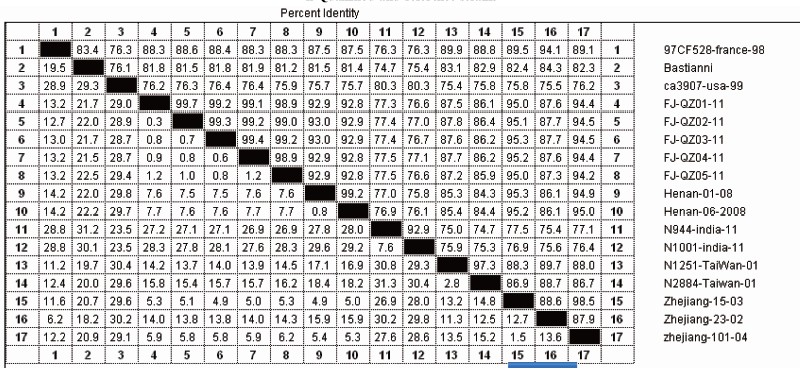
图2 泉州地区ECHO30分离株VP1区氨基酸序列与部分参考株序列比较
Figure 2 Comparison of amino acid sequence in VP1 region between echovirus 30 strains isolated in Quanzhou and reference strains
图3 ECHO30分离株VP1区核苷酸序列系统进化树
Figure 3 Phylogenetic tree of nucleotide sequence in VP1 region of isolated echovirus 30 strains
3 讨论
无菌性脑炎/脑膜炎,又称为病毒性脑炎/脑膜炎,是由各种病毒感染引起的中枢神经系统疾病。轻者能自行缓解,危重者可导致后遗症及死亡,而HEV是其最主要的病原体之一[3]。ECHO30是肠道病毒中引起无菌性脑膜炎的主要病毒, 近40 年来已在世界许多地区引起该病的暴发流行。美国1998年所有肠道病毒分离株中,ECHO30占42%[1]。1997年法国一家医院的新生儿中发生院内感染ECHO30引起的无菌性脑膜炎暴发流行[2], 2001年在中国台湾发生了大规模无菌性脑膜炎暴发, 报告的1130例病例中有188例(17%) 确诊为ECHO30感染所致[4],2004年在浙江省以及2004年在福州地区也都发生了ECHO30引发的无菌性脑膜炎暴发[5]。VP1是肠道病毒衣壳蛋白中位于最外层的部分,大部分抗原决定簇也位于此,有研究表明,以VP1为基础,对肠道病毒进行基因分型与血清分型的一致性是相当高的,对该段序列的分析是肠道病毒分子诊断、毒株分型及进化分析的有效方法 。因此,本研究选择该区域的病毒核酸序列作为遗传进化分析的基础。
本研究对2011年泉州地区不明原因脑膜炎标本进行分子生物学检测,并经PCR扩增、测序及比对明确此次脑膜炎暴发病原ECHO30。对5株分离株进行了VP1区全基因测序, 并挑选11株国内外各时期各地的ECHO30代表株以及ECHO30原型株的相应区段核酸序列, 构建ECHO30的遗传进化树分析图, 研究VP1区核苷酸和氨基酸的遗传变异情况,以及不同来源毒株的同源性。本次ECHO30分离株无论是核苷酸水平还是氨基酸水平,同源性都相当高,一致率均大于98.9%,最高达99.7%,且位于进化树的同一支,说明本次脑膜炎暴发有可能是由来源相同的ECHO30引起。ECHO30引起的无菌性脑膜炎的暴发流行国内外近年均有报道,通过对VP1区基因的遗传进化树分析,与本次分离株亲缘关系最近的是国内近年河南省、浙江省的ECHO30分离株,而与ECHO30原型株、法国、中国台湾、印度以及美国分离株的亲缘关系则相对较远,提示本次暴发流行可能是国内肠道病毒ECHO30在泉州地区又一暴发流行。
HEV是引起无菌性脑膜炎最重要的病原体之一,HEV-B组中的ECHO30、ECHO13、ECHO9、Cox A9 Cox A6和Cox B3、Cox B5型均有报道[8],本研究通过对引起2011年泉州地区无菌性脑膜炎暴发流行的ECHO30分离株VP1区基因全序列进行了分析,并对病毒的基因特征和分子流行病学特点进行初步研究分析。今后,应进一步建立无菌性脑膜炎的流行病学监测和实验室监测系统,加强对ECHO30病毒基因分子流行病学研究[9],以了解其在国内的基因型分布及流行传播规律,为更好地预防和控制相关疾病的发生奠定科学基础。
参考文献
[1] Oberste MS,Maher K, Kennett ML,et al.Molecular epidemiologyand geneticdiversity of echovirus type 30(E30):genotypes correlate with temporaldynamics of E30 isolation[J].Clincal Microbiol,1999,37:3928-3931.
[2] Chambon M,Bailly JL,Beguet A,et al. An outbreak due to echovirus type 30 in an eonatal unit in France in 1997 and usefulnessof PCR diagnosis[J]. J Hosp Infect,1999, 43(1): 63-68.
[3] Wang HY,Xu AQ, Zhu Z,et al.The genetic characterization and molecular evolution of echovirus 30 during outbreaks of aseptic meningitis[J]. Chinese Journal of Epidemiology,2006,27(9):793-797.(in Chinese)
王海岩,徐爱强,朱贞,等.无菌性脑膜炎暴发中ECHO 30病毒的基因特征及分子进化分析[J].中华流行病学杂志,2006,27(9):793-797.
[4] Wang JR,Tsai HP, Huang SW, et al. Laboratory diagnosis and genetic analysis of an Echovirus 30 associated outbreak of aseptic meningitis in Taiwan in 2001[J]. J Clin Microbiol,2002,40(12):4439-4444.
[5] He AH, Chen L, Yang XH, et al. Epidemiology of echovirus 30 pathogen of aseptic meningitis in Fuzhou[J]. Chinese Journal of Vaccines and Immunization,2007,13(4):363-368.(in Chinese)
何爱华,陈立,杨秀惠,等.福州地区无菌性脑膜炎病原——埃柯病毒30型分流行病学分析[J].中国计划免疫,2007,13(4):363-368.
[6] Zhao YN,Jiang QW,Jiang RJ,et al.VP1 Sequence analysis of the Echovirus type 30 newly isolated in China[J]. Chinese Journal of Virology,2005,21(2):101-105.(in Chinese)
赵雅男,姜庆五,姜仁杰,等.我国新分离ECHO 30病毒VP1序列分析[J].病毒学报,2005,21(2):101-105.
[7] Oberste MS,Maher K,Kilpatrick DR,et al. Moleular evolution of the human enteroviruses:correlation of serotype with VP1 sequence and application to picornavirus classification[J].J Virol,1999,73:1941-1948.
[8] Jiang RJ, Chen YZ, Zhao YN, et al. Epidemiological survey of outbreak of viral meningitis caused by ECHO 30[J]. Chinese Journal of Disease Control & Prevention,2005,9(6):616-619.(in Chinese)
姜仁杰,陈胤忠,赵雅男,等.ECHO 30型病毒性脑膜炎暴发的流行病学调查[J].疾病控制杂志,2005,9(6):616-619.
[9] Kilpatrick DR,Quay J,Pallansch MA, et al. Type specific detection of echovirus 30 isolates using degenerate reverse transcriptase PCR primers[J]. J Clin Microbiol,2001,39(4):1299-1302.
[2] Chambon M,Bailly JL,Beguet A,et al. An outbreak due to echovirus type 30 in an eonatal unit in France in 1997 and usefulnessof PCR diagnosis[J]. J Hosp Infect,1999, 43(1): 63-68.
[3] Wang HY,Xu AQ, Zhu Z,et al.The genetic characterization and molecular evolution of echovirus 30 during outbreaks of aseptic meningitis[J]. Chinese Journal of Epidemiology,2006,27(9):793-797.(in Chinese)
王海岩,徐爱强,朱贞,等.无菌性脑膜炎暴发中ECHO 30病毒的基因特征及分子进化分析[J].中华流行病学杂志,2006,27(9):793-797.
[4] Wang JR,Tsai HP, Huang SW, et al. Laboratory diagnosis and genetic analysis of an Echovirus 30 associated outbreak of aseptic meningitis in Taiwan in 2001[J]. J Clin Microbiol,2002,40(12):4439-4444.
[5] He AH, Chen L, Yang XH, et al. Epidemiology of echovirus 30 pathogen of aseptic meningitis in Fuzhou[J]. Chinese Journal of Vaccines and Immunization,2007,13(4):363-368.(in Chinese)
何爱华,陈立,杨秀惠,等.福州地区无菌性脑膜炎病原——埃柯病毒30型分流行病学分析[J].中国计划免疫,2007,13(4):363-368.
[6] Zhao YN,Jiang QW,Jiang RJ,et al.VP1 Sequence analysis of the Echovirus type 30 newly isolated in China[J]. Chinese Journal of Virology,2005,21(2):101-105.(in Chinese)
赵雅男,姜庆五,姜仁杰,等.我国新分离ECHO 30病毒VP1序列分析[J].病毒学报,2005,21(2):101-105.
[7] Oberste MS,Maher K,Kilpatrick DR,et al. Moleular evolution of the human enteroviruses:correlation of serotype with VP1 sequence and application to picornavirus classification[J].J Virol,1999,73:1941-1948.
[8] Jiang RJ, Chen YZ, Zhao YN, et al. Epidemiological survey of outbreak of viral meningitis caused by ECHO 30[J]. Chinese Journal of Disease Control & Prevention,2005,9(6):616-619.(in Chinese)
姜仁杰,陈胤忠,赵雅男,等.ECHO 30型病毒性脑膜炎暴发的流行病学调查[J].疾病控制杂志,2005,9(6):616-619.
[9] Kilpatrick DR,Quay J,Pallansch MA, et al. Type specific detection of echovirus 30 isolates using degenerate reverse transcriptase PCR primers[J]. J Clin Microbiol,2001,39(4):1299-1302.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 郑友限 | |
| 刘建忠 | |
| 翁育伟 | |
| 陈炜 | |
| 林碧莲 | |
| 陈明春 | |
| PubMed | |
| Article by ZHENG You-xian | |
| Article by LIU Jian-zhong | |
| Article by WENG Yu-wei | |
| Article by CHEN Wei | |
| Article by LIN Bi-lian | |
| Article by CHEN Ming-chun | |