Species identification and antibiotic resistance analysis of Candida clinical isolates
LI Wen-ge1, CHENG Ying1, WU Yuan1, ZHOU Cheng-jun2, JIA Hong-bing2, LU Jin-xing1, WANG Jing2
National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
Abstract
Objective To identify species composition of Candida clinical isolates and analyze the antibiotic resistance of the isolates. Methods VITEK Ⅱ, API20c, CHRO Magar and PCR method were used to identify yeast like clinical isolates, and the ATB Fungus3 was used for antibiotic resistance testing. Results A total of 96 yeast like clinical isolates from China Japan Friendship Hospital were identified, which belonged to 6 species, including 40 Candida albicans strains (41.7%), 36 Candida tropicalis strains (37.5%), 13 Candida glabrata strains (13.54%), 5 Candida parapsilosis strains (5.21%), 1 Candida krusei strain (1.04%) and 1 Candida Norway strain (1.04%). The strains showed different drug susceptibility to 5 anti fungal drugs tested. The strains were 100% sensitive to 5 flucytosine and amphotericin b, but showed different resistance to 3 azoles, including fluconazole, itraconazole and voriconazole. Conclusion Molecular analysis of the ITS region combined with traditional culturing is a effective way for the identification of Candida. In this study, the results indicated that infection of non albicans Candida was in increase. ICU is the place where Candida is frequently isolated. Patients aged >60 years are at high risk of the nosocomial infection. The results of anti fungi test in vitro showed that some Candida isolates had resistance to azole antifungal drugs.
医院内假丝酵母菌感染的菌种构成和耐药性分析
李文革1, 程颖1, 吴媛1, 周诚军2, 贾红兵2, 卢金星1, 王靖2
1. 中国疾病预防控制中心传染病预防控制所医院感染室, 传染病预防控制国家重点实验室, 北京 102206;
2. 卫生部中日友好医院检验科
2. 卫生部中日友好医院检验科
摘要
目的 分析医院内感染假丝酵母菌菌种构成和耐药性。 方法 对临床标本分离的酵母样真菌,用VITEK-Ⅱ(生物梅里埃公司)生化鉴定仪、API20c生化鉴定试纸条和念珠菌显色琼脂以及聚合酶链反应(polymerase chain reaction, PCR)方法进行酵母样真菌菌种的鉴定,应用ATB Fungus3 进行药敏试验。 结果 96株酵母样真菌,可分为6个种,包括白色念珠菌40株 (41.7%)、热带念珠菌36株 (37.5%)、光滑念珠菌13株 (13.54%)、近平滑念珠菌5株 (5.21%)、克柔念珠菌1株 (1.04%)、挪威念珠菌 1株(1.04%)。各种假丝酵母菌对5种抗真菌药呈现不同的敏感性,对两性霉素B和5-氟胞嘧啶的敏感率为100%,而对氟康唑、伊曲康唑、伏立康唑则表现出一定的耐药性。 结论 基因间隔转录区分子生物学分析结合传统培养和生化方法,可有效提高假丝酵母菌鉴定的准确性。本研究结果提示医院内非白假丝酵母菌感染有增多趋势。重症监护病房(intensive care unit, ICU)是重要的假丝酵母菌来源科室。60岁以上的老龄患者是医院内真菌感染的高危人群。体外药敏试验提示部分假丝酵母菌出现了唑类药物(氟康唑和伊曲康唑)的耐药性。
内容大纲
基因间隔转录区(internal transcribed sequence, ITS)是常用于真菌种属鉴定和进化分析的核糖体序列 。近年来,热带假丝酵母菌和克柔假丝酵母菌对唑类药物的抗药性显著增高,如中国台湾出现了氟康唑抗性的热带假丝酵母菌ST140[6];法国报道了5-氟胞嘧啶抗性的热带假丝酵母菌[7]。本研究就医院2009年12月至2010年12月期间分离的96株真菌菌株的种属和耐药情况进行了鉴定和分析,以期了解我国临床假丝酵母菌感染情况,为临床治疗假丝酵母菌感染提供参考。
1 材料与方法
1.1 材料 沙保氏和马铃薯琼脂,购于OXOID公司;VITEK-Ⅱ全自动鉴定药敏分析仪和API20c生化鉴定条购于生物梅里埃公司,科玛嘉念珠菌显色琼脂培养基购于法国科玛嘉公司。
1.2 菌株
所有临床分离假丝酵母菌菌株均来源于医院住院和门诊患者,包括痰液(53例)、血液(9例)、粪便(5例)、分泌物(6例)、静脉管(1例)、尿液(15例)、脓液(3例)、咽拭子(3例)和呼吸道插管(1例)。严格按有关规定收集并送检。各菌株来源病例在年龄组的分布:60~100岁65人,40~59岁16人,20~39岁12人,1~19岁3人。质控菌株白色念珠菌ATCC2091、热带念珠菌ATCC 750购自美国ATCC(美国模式培养物保藏中心)。
1.3 酵母样真菌的培养鉴定
取血液标本10 ml注入需氧血培养瓶中,放置Bact/Alert3D全自动血培养仪中,待仪器报警为阳性后,涂片镜检为酵母样菌后接种于沙保氏和马铃薯琼脂培养基上,其他标本直接接种于沙保氏和马铃薯琼脂培养基上,28 ℃培养24~48 h后出现酵母样菌落,将分离到的酵母样真菌接种于科玛嘉显色培养基,按产品说明书根据不同颜色判断菌种,对不能用显色培养基鉴定的菌种应用VITEK-Ⅱ和API20c真菌鉴定试纸条进行鉴定。
1.4 假丝酵母菌的PCR鉴定
对于一些用常规的鉴定方法不能有效鉴定到种属的非常见假丝酵母菌,PCR扩增ITS并测序,不同假丝酵母菌种的ITS区长度不同,约1.9~400 kp左右。而后在GenBank中进行BLAST(http://blast.ncbi.nlm.nih.gov)分析来确定其种型。参考文献[4]设计引物: 上游引物为 ITS1(5′-TCC GTA GGT GAA CCT GCG G-3′),下游引物为ITS4(5′-TCC TCC GCT TAT TGA TAT GC-3′)。50 μl PCR体系:10×PCR buffer 5 μl,dNTP 4 μl (各2.5 mmol/L),rTaq 0.5 μl(5 U/μl),ITS1和ITS4各1 μl (10 ng/μl),模板DNA 3 μl (80 ng/μl),dH2O 35.5 μl。PCR反应条件:95 ℃ 4 min,94 ℃ 30 s,50 ℃ 30 s,72 ℃ 1 min,72 ℃ 10 min,第2、3、4步共35个循环。取PCR产物5 μl,1%的琼脂糖凝胶电泳,120 V,20 min。
1.5 药敏实验
应用法国生物-梅里埃公司ATB-Fungus3药敏卡测试,药物:5-氟胞嘧啶(5-FC)、两性霉素B(AMB)、氟康唑(FLU)、伊曲康唑(ITR)和伏立康唑(VRC),按照试剂盒说明书步骤进行试验,药敏结果按美国临床实验室标准化协会(CLSI)标准判定。
2 结果
2.1 真菌感染的病区分布 分离到的96株菌株,来自大内科的菌株数位于第1位,见表1,ICU病房和门诊来源的标本分别位列于第2位和第3位。老年病房的真菌分离率也较高。
表1 真菌感染的主要病区分布
Table 1 Fungal infections in different wards
| 科室 | 分离菌株数 | 构成比/% |
| 儿科 | 3 | 3.13 |
| ICU | 21 | 21.88 |
| 老年科 | 10 | 10.42 |
| 门诊科(1) | 15 | 15.62 |
| 皮肤病科 | 2 | 2.08 |
| 外科 | 8 | 8.33 |
| 内科 | 37 | 38.54 |
| 合计 | 96 | 100.00 |
2.2 种属分布
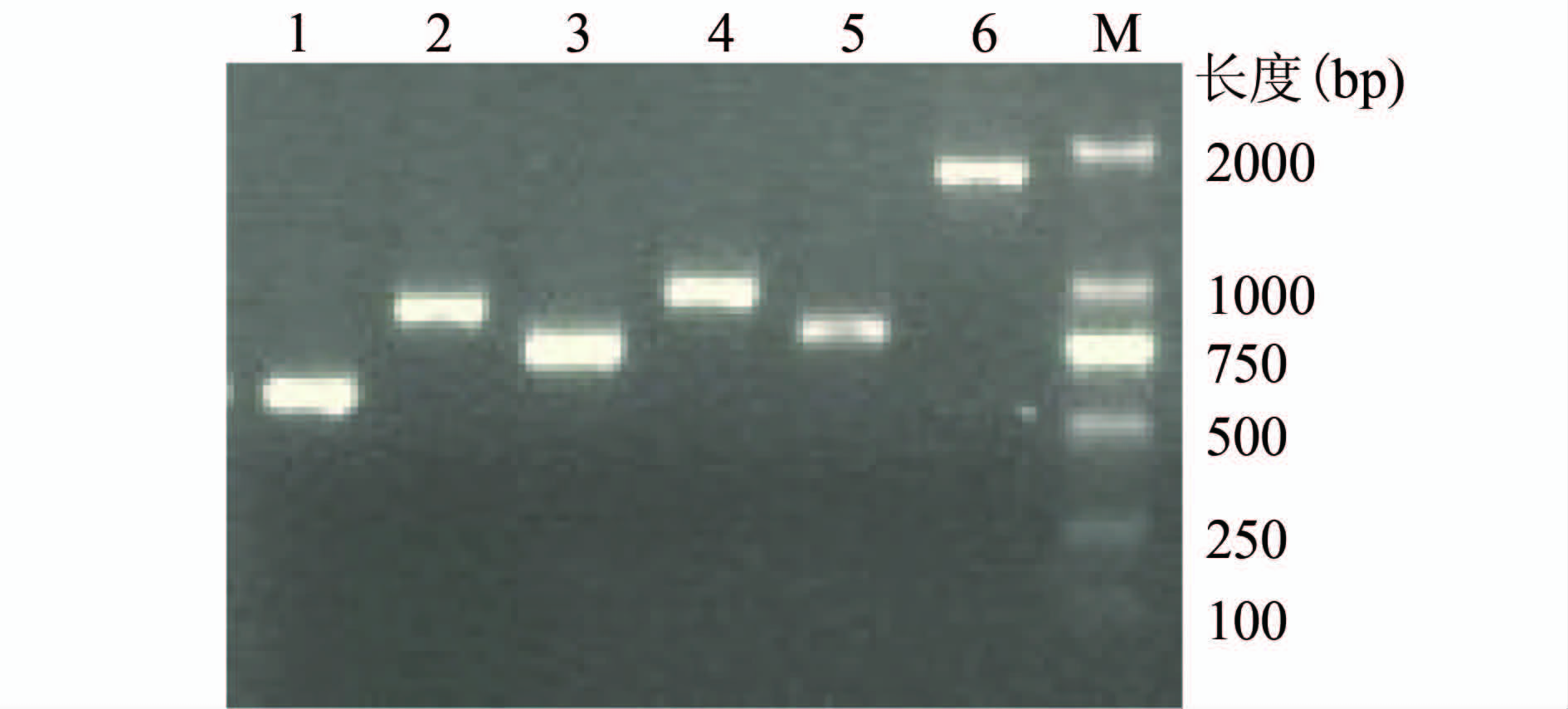
本研究中共进行了96株酵母样真菌(呼吸道标本56例,尿液15例,分泌物6例,脓液3例,粪便5例,血液9例,静脉插管1例和呼吸道插管1例)的种属鉴定。不同来源的酵母样真菌的种属分布见表2。部分菌株的ITS区PCR扩增产物电泳图见图1。 鉴定结果显示白色念珠菌比例最高,为41.7%(40/96),其次为热带念珠菌37.5%(36/96)、光滑念珠菌13.54%(13/96)、近平滑念珠菌5.21%(5/96)、克柔念珠菌1.04%(1/96)和挪威念珠菌1.04%(1/96)。
表2 不同来源假丝酵母菌的种属分布(株)
Table 2 Species specific distribution of Candida isolates from different sources
| 标本类型 | 种属类型 | |||||
| 白假丝酵母 | 光滑假丝酵母 | 热带假丝酵母 | 克柔假丝酵母 | 近平滑假丝酵母 | 挪威假丝酵母 | |
| 痰液 | 21 | 6 | 24 | 1 | 1 | 0 |
| 血液 | 4 | 1 | 2 | 0 | 1 | 0 |
| 粪便 | 1 | 1 | 2 | 0 | 1 | 0 |
| 分泌物 | 4 | 1 | 1 | 0 | 0 | 0 |
| 静脉管 | 1 | 0 | 0 | 0 | 0 | 0 |
| 尿液 | 6 | 4 | 5 | 0 | 0 | 1 |
| 脓液 | 1 | 0 | 0 | 0 | 2 | 0 |
| 咽拭子 | 2 | 0 | 1 | 0 | 0 | 0 |
| 插管 | 0 | 0 | 1 | 0 | 0 | 0 |
| 合计 | 40 | 13 | 36 | 1 | 5 | 1 |
图1 ITS区PCR产物电泳图
Figure 1 Electrophoresis map of ITS PCR products 1~6分别代表白假丝酵母、光滑假丝酵母、热带假丝酵母、近平滑假丝酵母、克柔假丝酵母和挪威假丝酵母菌的ITS序列; M:2000 Marker。
2.3 药敏实验结果
96株假丝酵母菌对5种抗真菌药物的药敏结果见表3。6种假丝酵母菌对5-氟胞嘧啶和两性霉素B均未产生耐药或剂量依赖性敏感,而对氟康唑和伊曲康唑分别有11株假丝酵母菌产生了耐药性,39株菌为剂量依赖性敏感。共有10株菌(热带假丝酵母菌和光滑假丝酵母菌)对伏立康唑产生剂量依赖性敏感。唑类耐药的菌株主要有热带假丝酵母菌、光滑假丝酵母菌和克柔假丝酵母菌,其中以热带假丝酵母菌为主要的耐唑类药物假丝酵母菌,共15株。
表3 96株酵母样真菌对5种抗真菌药物的敏感性试验结果(1)
Table 3 Susceptibility results of 96 yeast-like fungi isoaltes to 5 antifungal drugs
| 名称 | 株数 | 5-氟胞嘧啶 | 两性霉素B | 氟康唑 | 伊曲康唑 | 伏立康唑 | ||||||||||||||
| S | SDD | R | S | SDD | R | S | SDD | R | S | SDD | R | S | SDD | R | ||||||
| 白色念珠菌 | 40 | 40 | 0 | 0 | 40 | 0 | 0 | 36 | 4 | 0 | 36 | 4 | 0 | 40 | 0 | 0 | ||||
| 热带念珠菌 | 36 | 36 | 0 | 0 | 36 | 0 | 0 | 21 | 9 | 6 | 16 | 13 | 7 | 29 | 7 | 0 | ||||
| 光滑念珠菌 | 13 | 13 | 0 | 0 | 13 | 0 | 0 | 5 | 4 | 4 | 6 | 4 | 3 | 10 | 3 | 0 | ||||
| 近平滑念珠菌 | 5 | 5 | 0 | 0 | 5 | 0 | 0 | 5 | 0 | 0 | 5 | 0 | 0 | 5 | 0 | 0 | ||||
| 克柔念珠菌 | 1 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 0 | 0 | ||||
| 挪威念珠菌 | 1 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | ||||
| 合计 | 96 | 96 | 0 | 0 | 96 | 0 | 0 | 67 | 18 | 11 | 64 | 21 | 11 | 86 | 10 | 0 | ||||
3 讨论
假丝酵母菌属的多个菌种作为人体正常菌群之一,可从多部位分离到,通常从无菌部位标本如血液、胸腹水等分离到真菌,在排除污染因素后即可确定为感染源。目前对于从临床呼吸道标本中分离到白色念珠菌,是否定性为真菌感染尚有争议。但普遍认同深部痰液、支气管/肺泡盥洗液分离培养到菌株,以及痰标本3次送检阳性,痰性状涂片白细胞>25/低倍镜,上皮细胞<10/低倍镜则考虑有真菌感染的可能,本实验中的痰标本均按照上述标准收集。在分离的96株真菌中,以白色念珠菌分离率最高,占41.7%,其次是热带念珠菌占37.5%,与文献报道基本一致[8],可能与热带假丝酵母菌对宿主细胞有很强的黏附性有关。对96例酵母样菌感染病例的标本来源进行分析,统计结果表明,在继发真菌感染的疾病中,以呼吸道最多,其次为泌尿道和血液。在年龄分布上,以老年人占优势,这与老年人因生理防御功能减退及各种严重的基础性疾病易继发真菌感染有关[9]。近年来,由于免疫抑制剂、激素的大量应用以及免疫缺陷患者增多,导致人体免疫力下降,同时随着中心静脉置管、导管介入、器官移植等新技术在临床广泛开展,放疗、化疗和大量新型广谱高效抗菌药物的应用,导致假丝酵母菌属医院感染呈上升趋势[10]。
本研究中96株酵母样真菌对5种抗真菌药物的药敏检测结果表明,96株真菌对5种抗真菌药物具有一定的敏感性,尤其是5-氟胞嘧啶、两性霉素B,但假丝酵母菌对唑类药物的耐药性增加,处于剂量依赖性敏感(SDD)的菌株比例较大,临床可根据情况增加药物的剂量,96株酵母样真菌对氟康唑和伊曲康唑的敏感率均低于70%。热带假丝酵母菌对3种唑类药物的敏感率最低;而白色假丝酵母菌或热带假丝酵母菌以及其他假丝酵母菌对两性霉素B和5-氟胞嘧啶的敏感率均很高,为100%。本文中的分析结果显示一线的唑类药物对酵母样真菌的耐药率要高于两性霉素B和5-氟胞嘧啶。
综上所述,本课题对某医院1年内住院患者和部分门诊患者进行了假丝酵母菌的分离培养和分子生物学鉴定、菌种构成,科室来源分析和体外药敏实验。传统的培养鉴定不能有效将常见的假丝酵母菌区分并鉴定到种的水平,本研究应用分子生物学方法,扩增ITS区,进行序列测定和比对,将菌株鉴定到种的水平。白假丝酵母菌依然是医院分离的主要假丝酵母菌,而非白假丝酵母菌如热带假丝酵母菌和光滑假丝酵母菌的分离数量仅次于白假丝酵母,提示近年来,医院内非白假丝酵母菌感染增多的可能。医院内的多个科室均可分离出假丝酵母菌,其中以ICU和大内科为主。患者年龄在60岁以上的有65人,占总病例数的67.71%,提示老年人群可能是医院内真菌感染的高危人群。体外药敏实验结果显示热带假丝酵母、光滑假丝酵母和克柔假丝酵母对氟康唑和伊曲康唑出现了耐药性。
参考文献
[1] Hu LJ, Chen L, Liang HP. To analyze the fungi and antibiotic resistance testing collected from hospital clinical specimens[J]. Journal of Clinical Laboratory,2011,29(1):76-77.(in Chinese)
胡丽杰,陈璐,梁怀盼.医院临床标本中真菌的分离培养与耐药性分析[J]. 临床检验杂志,2011,29(1):76-77.
[2] Selvarangan R, Bui U, Limaye AP,et al. Rapid identification of commonly encountered candida species directly from blood culture bottles[J]. J Clin Microbiol,2003,41(12): 5660-5664.
[3] Silva S, Negri M, Henriques M,et al. Candida glabrata,Candida parapsilosis and Candida tropicalis: biology, epidemiology,pathogenicityand antifungal resistance[J]. FEMS Microbiol Rev,2012,36(2):288-305.
[4] White T, Bruns T, Lee S,et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols: a guide to methods and applications[M]. San Diego, CA: Academic Press,1990.
[5] Kuzucu C, Durmaz R, Otlu B,et al. Species distribution, antifungal susceptibility and clonal relatedness of Candida isolates from patients in neonatal and pediatric intensive care units at a medical center in Turkey[J]. New Microbiol,2008,31(3): 401-408.
[6] Chou HH, Lo HJ, Chen KW, et al. Multilocus sequence typing of Candida tropicalis shows clonal cluster enriched in isolates with resistance or trailing growth of fluconazole[J]. Diagn Microbiol Infect Dis,2007,58:427-433.
[7] Kothavade RJ, Kura MM, Valand AG,et al. Candida tropicalis: its prevalence, pathogenicity and increasing resistance to fluconazole[J]. J Med Microbiol,2010,59(Pt 8): 873-880.
[8] Yang YL, Guo FL, Shi YJ, et al. Susceptibility to antifungal agents in 111 Candida strains causing nosocomial deep fungal infections[J]. Chinese Journal of Nosocomiology,2009,19(3):355-357. (in Chinese)
杨玉林,郭凤玲,史跃杰,等 110例假丝酵母菌属感染和药敏结果分析[J]. 中华医院感染学杂志,2009,19(3):355-357.
[9] Huang YK, Xia X, Li T, et al. Isolation of yeasts from clinical specimens and analysis of the resistance to these yeasts to anti fungus agents recently[J]. Journal of Clinical Laboratory,2003,21(z1):60-62. (in Chinese)
黄云昆,夏星,李婷,等.临床标本中酵母样真菌的分离及耐药性现状分析[J]. 临床检验杂志,2003,21(增刊):60-62.
[10] Zhao Y, Xu YC. The current situation of common clinical yeast infection and drug resistance[J]. Chinese Journal of Mycology,2010,5(1):48-51. (in Chinese)
赵颖,徐英春.临床常见酵母菌感染及耐药现状[J]. 中国真菌学杂志,2010,5(1):48-51.
胡丽杰,陈璐,梁怀盼.医院临床标本中真菌的分离培养与耐药性分析[J]. 临床检验杂志,2011,29(1):76-77.
[2] Selvarangan R, Bui U, Limaye AP,et al. Rapid identification of commonly encountered candida species directly from blood culture bottles[J]. J Clin Microbiol,2003,41(12): 5660-5664.
[3] Silva S, Negri M, Henriques M,et al. Candida glabrata,Candida parapsilosis and Candida tropicalis: biology, epidemiology,pathogenicityand antifungal resistance[J]. FEMS Microbiol Rev,2012,36(2):288-305.
[4] White T, Bruns T, Lee S,et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols: a guide to methods and applications[M]. San Diego, CA: Academic Press,1990.
[5] Kuzucu C, Durmaz R, Otlu B,et al. Species distribution, antifungal susceptibility and clonal relatedness of Candida isolates from patients in neonatal and pediatric intensive care units at a medical center in Turkey[J]. New Microbiol,2008,31(3): 401-408.
[6] Chou HH, Lo HJ, Chen KW, et al. Multilocus sequence typing of Candida tropicalis shows clonal cluster enriched in isolates with resistance or trailing growth of fluconazole[J]. Diagn Microbiol Infect Dis,2007,58:427-433.
[7] Kothavade RJ, Kura MM, Valand AG,et al. Candida tropicalis: its prevalence, pathogenicity and increasing resistance to fluconazole[J]. J Med Microbiol,2010,59(Pt 8): 873-880.
[8] Yang YL, Guo FL, Shi YJ, et al. Susceptibility to antifungal agents in 111 Candida strains causing nosocomial deep fungal infections[J]. Chinese Journal of Nosocomiology,2009,19(3):355-357. (in Chinese)
杨玉林,郭凤玲,史跃杰,等 110例假丝酵母菌属感染和药敏结果分析[J]. 中华医院感染学杂志,2009,19(3):355-357.
[9] Huang YK, Xia X, Li T, et al. Isolation of yeasts from clinical specimens and analysis of the resistance to these yeasts to anti fungus agents recently[J]. Journal of Clinical Laboratory,2003,21(z1):60-62. (in Chinese)
黄云昆,夏星,李婷,等.临床标本中酵母样真菌的分离及耐药性现状分析[J]. 临床检验杂志,2003,21(增刊):60-62.
[10] Zhao Y, Xu YC. The current situation of common clinical yeast infection and drug resistance[J]. Chinese Journal of Mycology,2010,5(1):48-51. (in Chinese)
赵颖,徐英春.临床常见酵母菌感染及耐药现状[J]. 中国真菌学杂志,2010,5(1):48-51.