Pulsed-field gel electrophoresis typing of enteroaggregative Escherichia coli isolates
SUN Hui, LIU Xue-tong, ZHAO Ai-lan, JIN Dong, XIONG Yan-wen, LU Shan
State Key Laboratory for Communicable Diseases Prevention and Control, Chinese Center for Disease Control and Prevention, Beijing 102206, China
Abstract
Objective To understand the molecular epidemiological characteristics of enteroaggregative Escherichia coli (EAEC) isolates from sporadic diarrheal patients in China and establish related database. Methods Pulsed-field gel electrophoresis (PFGE) was performed according to the PulseNet protocol of Escherichia coli O157:H7 with minor modifications. An UPGMA dendrogram was constructed with BioNumerics software. Results According to the PulseNet protocol, 48 PFGE patterns were obtained from 52 EAEC isolates, and then they were divided into 14 groups named from A to N. Isolates from different regions or isolates with different adherent phenotypes to HEp-2 cells were widely distributed in different groups. Conclusion The EAEC isolates from sporadic diarrheal patients in China were highly polymorphic. The PFGE protocol developed in this study seemed to be suitable for the molecular typing of EAEC isolates in China.
Keywords:
enteroaggregative Escherichia coli
aggregative adherence
pulsed-field gel electrophoresis
molecular typing
肠集聚性大肠埃希菌分离株脉冲场凝胶电泳分析
孙晖, 刘学通, 赵爱兰, 金东, 熊衍文, 卢珊
中国疾病预防控制中心传染病预防控制所, 传染病预防控制国家重点实验室, 北京 102206
摘要
目的 对我国散发腹泻患者肠集聚性大肠埃希菌(EAEC)分离株进行脉冲场凝胶电泳(PFGE)分析,以了解其分子流行病学特征并初步建立我国EAEC菌株的基础数据库。 方法 参照PulseNet大肠埃希菌O157:H7的PFGE实验方法对52株EAEC分离株进行分析,并使用BioNumerics软件进行聚类。 结果 在限制性内切酶XbaⅠ和PulseNet推荐的电泳参数下,菌株基因组酶切片段分布均匀,条带易于识别。52株EAEC分离株产生了48种PFGE带型,初步聚类为A~N 14个群,不同地区来源及不同HEp-2细胞黏附表型的菌株广泛分布在不同PFGE聚类群中。 结论 我国散发腹泻患者EAEC分离株呈现高度多态性,PFGE电泳参数和限制性内切酶XbaⅠ适用于我国EAEC菌株的分析。
致泻性大肠埃希菌(diarrheagenic Escherichia coli,DEC)引起的感染性腹泻是发展中国家面临的一个重要公共卫生问题,其中肠集聚性大肠埃希菌(enteroaggregative Escherichia coli,EAEC)是一类新发现的病原菌,其特征是对HEp-2细胞的“叠砖样”集聚性黏附表型(aggregative ‘stacked-brick’ pattern)[1]。
HEp-2细胞黏附试验是检测并确定EAEC菌株的“金标准”,而目前实际工作中主要通过PCR检测aggR基因来筛选EAEC,但EAEC菌株间的异质性很大,致病机制相对复杂,不同菌株所含有的毒力基因存在很大差异,没有一种特定的毒力基因为所有EAEC菌株所共有[2]。目前有调查表明,EAEC在我国腹泻患者中有一定的分离率,并且菌株呈现多种O ∶ H血清型和MLST(multilocus sequence typing,多位点序列分型)序列型及耐药特征[3]。本研究在参考美国疾病预防控制中心PulseNet大肠埃希菌O157 ∶ H7 脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE)分型方法基础上,对我国不同地区腹泻患者EAEC分离株进行分析,以了解其分子流行病学特征,并初步建立我国EAEC菌株的PFGE基础数据库。
1 材料与方法
1.1 材料1.1.1 实验菌株
本研究中50株aggR基因阳性EAEC菌株分离自河南、四川、山西、北京等地散发腹泻患者粪便。所有菌株经系统生化鉴定、O ∶ H血清分型后-80 ℃保存。EAEC参考菌株Ec042和17-2均为本室保存。沙门菌H9812(Salmonella braenderup strain H9812)用于PFGE分析时的分子质量Marker。
1.1.2 主要试剂与仪器
Taq DNA聚合酶、限制性内切酶XbaⅠ购自TaKaRa公司;SeaKem Gold(SKG)琼脂糖购自基因有限公司;蛋白酶K、十二烷基肌氨酸钠购自Merck公司;SDS、EDTA、Tris及硼酸购自生工生物工程(上海)技术服务有限公司;细菌基因组提取试剂盒购自康为世纪公司。PCR仪为SensoQuest Labcycler(德国Senso公司);脉冲场凝胶电泳仪为CHEF DRIII system(美国Bio-Rad公司);凝胶成像系统为Gel DocTM XR+(美国Bio-Rad公司);水浴摇床为Grant OLS2000(英国Grant公司);浊度仪为Densimat(法国bioMérieux公司)。
1.2 方法
1.2.1 HEp-2细胞黏附试验及集聚性黏附相关基因检测
本研究中的所有52株aggR基因阳性的EAEC菌株均进行HEp-2细胞黏附分析。将待测菌株与HEp-2细胞按100 ∶ 1的比例接种于铺有玻片的24孔细胞板中,37 ℃、5% CO2培养条件下孵育3 h;细胞板以PBS漂洗3次,加入1 ml/孔预冷的无水乙醇,-20 ℃,作用15 min;细胞板以PBS漂洗3次,加入500 μl/孔吉姆萨染液,作用30 min;细胞板以无菌纯水漂洗3次,取出玻片晾干,指甲油封边固定,显微镜下观察并记录细菌黏附表型 [4]。所有菌株均进行已知的EAEC四类集聚性黏附相关基因(aggA、aafA、agg3A和hdaA)检测,聚合酶链反应(PCR)引物及扩增条件见参考文献[4]。
1.2.2 PFGE
(1)胶块制作:取400 μl细菌悬浊液(麦氏比浊值4.0~4.5)于37 ℃孵育5 min后加入20 μl蛋白酶K(20 mg/ml)。将菌悬液与400 μl 1% SeaKem Gold:1% SDS混匀后加入模具,在室温下凝固10~15 min后制成胶块。
(2)细菌基因组酶切:制成2 mm宽的胶块,用150 μl酶切缓冲液37 ℃缓冲10~15 min。加入新酶切缓冲液和适量的限制性内切酶共200 μl,每个样本XbaⅠ酶的用量为45 U。37 ℃孵育2 h 。
(3)电泳条件:电压6.0 V/cm,脉冲夹角120°,脉冲时间6.8~35.4 s,电泳时间18~19 h。
(4)图像获取及聚类分析:电泳结束后,将胶块放入1 μg/ml溴化乙锭溶液中染色30 min,置纯水中脱色30 min,凝胶成像仪中成像,记录图像文件为.tiff格式。应用BioNumerics(Version 4.0)(Applied Maths BVBA,Belgium)软件识别图像条带,选择UPGMA(Unweighted Pair Group Method using Arithmetic averages)方法,条带位置差异容许度选择1.5%,优化值为1.5%进行聚类,并对每一种不同的带型进行命名。
2 结果
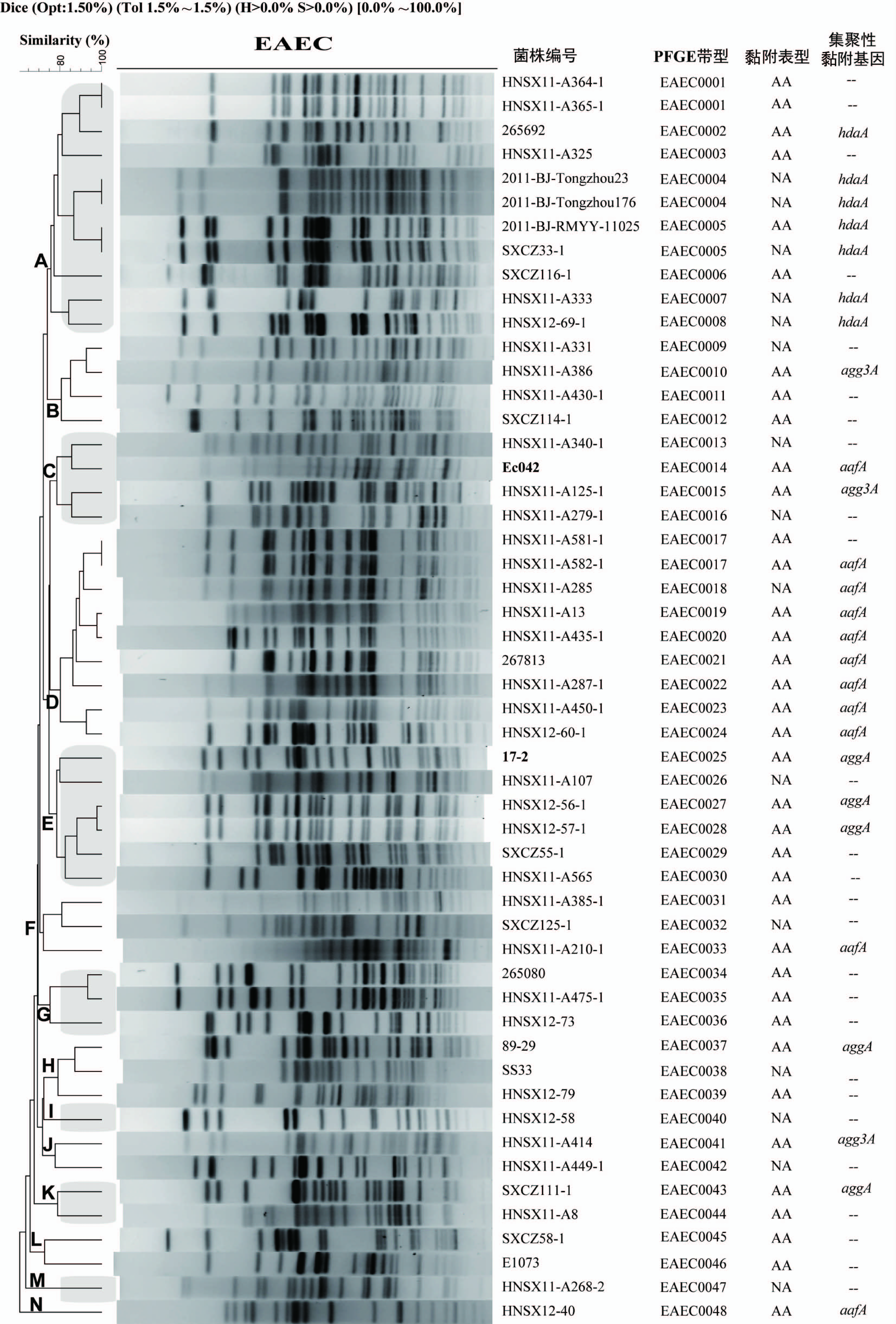
2.1 EAEC分离株PFGE分型情况 52株(包括参考菌株Ec042及17-2)aggR基因阳性菌株,共产生48种不同的PFGE带型(EAEC0001~EAEC0048),除4种PFGE带型(EAEC0001、EAEC0004、EAEC0005及EAEC0017)中分别包括2株菌外,其余44株菌分别为单一的PFGE带型(图1),表明我国EAEC散发感染患者中的菌株存在多样性,无明显流行的优势PFGE带型。参考菌株Ec042及17-2均为独特的带型(分别为EAEC0014和EAEC0025带型)。
EAEC0001带型包括2株分离自不同时期河南睢县腹泻患者粪便标本的菌株,均对HEp-2细胞表现相同的集聚性黏附(AA)表型但缺乏集聚性黏附基因;EAEC0004带型包括2株分离自不同时期北京通州区腹泻患者粪便标本的菌株,均表现为对HEp-2细胞的不黏附(NA)表型但含有集聚性黏附基因hdaA。EAEC0005带型包括2株分别分离自北京和四川腹泻患者粪便的菌株,2菌株含有相同的集聚性黏附基因hdaA,但对HEp-2细胞表现为不同的黏附表型(AA或NA黏附);此外,EAEC0017带型包括2株分离自不同时期河南睢县腹泻患者粪便标本的菌株,均对HEp-2细胞表现相同的集聚性黏附(AA)表型但1株含有集聚性黏附基因aafA,另1株不含集聚性黏附基因。
2.2 不同PFGE型别EAEC菌株对HEp-2细胞黏附及携带集聚性黏附基因情况
根据52株EAEC分离株PFGE带型UPGMA聚类图,可以将其分为A~N共14个PFGE聚类群(聚类相似性≤85%)。各聚类群包括的菌株数量不等,其中A群最多,包括11株;D群次之,包括9株;其余12个群分别包括1~6株不等。
52株aggR基因阳性的菌株中,表现为集聚性黏附(AA黏附)的有37株,其余15株表现为不黏附(NA黏附)。从PFGE聚类图来看(图1),AA与NA黏附表型菌株散在分布于整个PFGE带型中,与PFGE聚类群无明显相关性。这也说明PFGE的分型结果不能用于解释和判断菌株对HEp-2细胞的黏附结果,这一诊断EAEC的“金标准”。
图1 52株EAEC分离株PFGE带型UPGMA聚类图
Figure 1 UPGMA Dendrogram based on PFGE patterns of 52 EAEC isolates
注:AA:集聚性黏附;NA:不黏附;--:集聚性黏附相关基因阴性。
52株aggR基因阳性的菌株中,携带4种集聚性黏附相关基因的有26株,其中aggA基因(介导集聚性黏附菌毛Ⅰ)阳性5株,aafA基因(介导集聚性黏附菌毛Ⅱ)阳性11株,agg3A基因(介导集聚性黏附菌毛Ⅲ)阳性3株,hdaA基因(介导集聚性黏附菌毛HdaA)阳性7株。37株AA黏附表型菌株中,20株携带已知的集聚性黏附基因;而5株hdaA基因阳性及1株aafA基因阳性的菌株,表现为不黏附。从PFGE聚类图来看(图1),集聚性黏附基因类型与PFGE聚类群存在一定的相关性,如聚类群A主要是hdaA基因阳性菌株;聚类群D主要是aafA基因阳性菌株;聚类群E主要是aggA基因阳性菌株等。
3 讨论
EAEC感染是发展中国家婴幼儿腹泻的重要病因之一,也是继ETEC之后导致成人旅游者腹泻的第二大病原菌[1]。2011年5月,德国出现血清型为O104 ∶ H4的产志贺毒素大肠埃希菌暴发疫情,其致病菌是EAEC获得了携带毒力基因stx2a的噬菌体Stx2,并获得了产超光谱β-内酰胺酶(extended-spectrum beta-lactamase,ESBLs)的耐药质粒[6]。本次疫情之严重、波及范围之广说明了EAEC获得其他致病因子之后具有很强的致病能力[7]。我国学者一项对东南省份2466份腹泻患者粪便标本的检测表明,aggR基因阳性菌株有41株,占全部粪便标本的1.66%[3]。庞慧等[8]对山西长治地区170份腹泻患者粪便标本的致泻性大肠埃希菌检测表明,EAEC的检出率仅次于EPEC,占4.12%(7/170)。
PFGE 是PulseNet China中病原菌分子分型的重要技术,可实现全球范围监测信息的查询和比对[9]。本研究应用XbaⅠ限制性内切酶对我国EAEC分离株进行PFGE分析,菌株酶切后的条带数目适中,片段大小分布均匀;此外,PFGE将本研究中的52株EAEC菌株分为48种带型,表明该研究中使用的限制性内切酶和电泳参数适用于EAEC菌株的分型分析。
PFGE分型结果表明,我国散发感染性腹泻患者EAEC菌株呈现高度多态性,这也符合EAEC为一类高度异质性的大肠埃希菌的一般特点[10]。但是,本研究中存在4种PFGE带型,分别含有2株菌,这些相同PFGE带型的菌株,集聚性黏附表型及携带的集聚性黏附基因有的相同,有的不同,此外,根据菌株的分离来源看,流行病学上也不支持这些带型相同的菌株可能具有相同的传染来源。因此,同所有其他分子分型方法一样,PFGE对于EAEC的分型也存在一定的局限性,对于相同PFGE带型菌株的解释,一方面可结合流行病学资料,另一方面可增加另外一种限制性内切酶后进行PFGE分析,或结合其他的分子分型方法,如MLST分析。
本研究建立了我国EAEC菌株的PFGE参数和基础数据库,并可以在后续的工作中不断对数据库进行丰富,为了解我国EAEC菌株的分子流行病学特征、EAEC暴发调查及溯源等奠定了基础。
参考文献
[1] Liu XT, Xiong YW, Xu JG. Progress in research of enteroaggregative Escherichia coli [J]. Disease Surveillance, 2012,27(10):828-833.(in Chinese)刘学通,熊衍文,徐建国. 肠集聚性大肠埃希菌研究进展[J].疾病监测,2012,27(10):828-833.
[2] Kaur P, Chakraborti A, Asea A. Enteroaggregative Escherichia coli:an emerging enteric food borne pathogen [J]. Interdiscip Perspect Infect Dis, 2010,2010:254159.
[3] Chen Y, Chen X, Zheng S, et al. Serotypes, genotypes and antimicrobial resistance patterns of human diarrhoeagenic Escherichia coli isolates circulating in southeastern China [J]. Clin Microbiol Infect, 2013,[Epub ahead of print]. doi:10.1111/1469-0691.12188.
[4] Liu XT, Chen Q, Sun H, et al. Adherence characteristics to HEp-2 cells and genes associated with aggregative adherence in EAEC strains isolated from China [J]. Journal of Pathogen Biology, 2012,7(12):893-896.(in Chinese)刘学通,陈强,孙晖,等. 我国EAEC分离株对HEp-2细胞的黏附特征及集聚性黏附相关基因分析[J].中国病原生物学杂志,2012,7(12):893-896.
[5] Jin D, Zhao AL, Bai XN, et al. Pulsed field gel electrophoresis typing on non O157 Shiga toxin producing Escherichia coli isolates [J]. Chinese Journal of Epidemiology, 2013,34(5):495-498. (in Chinese)金东,赵爱兰,白向宁,等. 非O157产志贺毒素大肠埃希菌分离株脉冲场凝胶电泳分析[J].中华流行病学杂志,2013,34(5):495-498.
[6] Rohde H, Qin J, Cui Y, et al. Open source genomic analysis of Shiga toxin producing E. coli O104:H4 [J]. N Engl J Med, 2011,365(8):718-724.
[7] Frank C, Werber D, Cramer JP, et al. Epidemic profile of Shiga toxin producing Escherichia coli O104:H4 outbreak in Germany [J]. N Engl J Med, 2011,365(19):1771-1780.
[8] Pang H, Zhao AL, Bai XN, et al. Detection and analysis of diarrheagenic Escherichia coli from stool specimens of patients with infectious diarrhea in Changzhi area [J]. Chinese Journal of Zoonoses, 2013,29(5):520-522.(in Chinese)庞慧,赵爱兰,白向宁,等.长治地区腹泻患者致泻性大肠埃希菌的检测与分析[J].中国人兽共患病学报,2013,29(5):520-522.
[9] Xu J. PulseNet China [J]. Emerging Microbes & Infections, 2012,1:e29.
[10] Aslania MM, Alikhanib MY, Zavarib A, et al. Characterization of enteroaggregative Escherichia coli (EAEC) clinical isolates and their antibiotic resistance pattern [J]. Int J Infect Dis, 2011,15(2):e136-e139.
[2] Kaur P, Chakraborti A, Asea A. Enteroaggregative Escherichia coli:an emerging enteric food borne pathogen [J]. Interdiscip Perspect Infect Dis, 2010,2010:254159.
[3] Chen Y, Chen X, Zheng S, et al. Serotypes, genotypes and antimicrobial resistance patterns of human diarrhoeagenic Escherichia coli isolates circulating in southeastern China [J]. Clin Microbiol Infect, 2013,[Epub ahead of print]. doi:10.1111/1469-0691.12188.
[4] Liu XT, Chen Q, Sun H, et al. Adherence characteristics to HEp-2 cells and genes associated with aggregative adherence in EAEC strains isolated from China [J]. Journal of Pathogen Biology, 2012,7(12):893-896.(in Chinese)刘学通,陈强,孙晖,等. 我国EAEC分离株对HEp-2细胞的黏附特征及集聚性黏附相关基因分析[J].中国病原生物学杂志,2012,7(12):893-896.
[5] Jin D, Zhao AL, Bai XN, et al. Pulsed field gel electrophoresis typing on non O157 Shiga toxin producing Escherichia coli isolates [J]. Chinese Journal of Epidemiology, 2013,34(5):495-498. (in Chinese)金东,赵爱兰,白向宁,等. 非O157产志贺毒素大肠埃希菌分离株脉冲场凝胶电泳分析[J].中华流行病学杂志,2013,34(5):495-498.
[6] Rohde H, Qin J, Cui Y, et al. Open source genomic analysis of Shiga toxin producing E. coli O104:H4 [J]. N Engl J Med, 2011,365(8):718-724.
[7] Frank C, Werber D, Cramer JP, et al. Epidemic profile of Shiga toxin producing Escherichia coli O104:H4 outbreak in Germany [J]. N Engl J Med, 2011,365(19):1771-1780.
[8] Pang H, Zhao AL, Bai XN, et al. Detection and analysis of diarrheagenic Escherichia coli from stool specimens of patients with infectious diarrhea in Changzhi area [J]. Chinese Journal of Zoonoses, 2013,29(5):520-522.(in Chinese)庞慧,赵爱兰,白向宁,等.长治地区腹泻患者致泻性大肠埃希菌的检测与分析[J].中国人兽共患病学报,2013,29(5):520-522.
[9] Xu J. PulseNet China [J]. Emerging Microbes & Infections, 2012,1:e29.
[10] Aslania MM, Alikhanib MY, Zavarib A, et al. Characterization of enteroaggregative Escherichia coli (EAEC) clinical isolates and their antibiotic resistance pattern [J]. Int J Infect Dis, 2011,15(2):e136-e139.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 孙晖 | |
| 刘学通 | |
| 赵爱兰 | |
| 金东 | |
| 熊衍文 | |
| 卢珊 | |
| PubMed | |
| Article by SUN Hui | |
| Article by LIU Xue-tong | |
| Article by ZHAO Ai-lan | |
| Article by JIN Dong | |
| Article by XIONG Yan-wen | |
| Article by LU Shan | |