Preparation of antisera against PEtN modification on O-antigen of Shigella flexneri
WANG Jian-ping, LUO Xia, XU Jian-guo, SUN Qiang-zheng
Institute for Communicable Disease Prevention and Control, Chinese Center fro Disease Control and Prevention, Beijing 102206, China
Abstract
Objective To prepare specific antisera against PEtN modification on O-antigen of Shigella flexneri. Methods The strain 036_Yv carrying opt gene responding for PEtN modification on O-antigen was used to immunize rabbits to prepare antisera. After adsorbed using the host strain 036, the antisera was tested by slide agglutination assay by using 135 S. flexneri strains of different serotypes. Results The prepared antisera could specially agglutinate with S. flexneri strains with PEtN modification on O-antigen, and the agglutination titer was 1:32. Apart from serotype Xv, 4av and Yv, the antisera could not react with strains of other serotypes, indicating high specificity. Conclusion The specific antisera against PEtN modification on O-antigen of S. flexneri was successfully prepared, which can be used in Shigella detection and surveillance.
福氏志贺菌O-抗原磷酸乙醇胺修饰特异抗血清的制备
王建平, 罗霞, 徐建国, 孙强正
中国疾病预防控制中心传染病预防控制所, 北京 102206
摘要
目的 制备针对福氏志贺菌O-抗原磷酸乙醇胺(PEtN)修饰的抗血清。方法 用血清型Yv菌株036_Yv(O-抗原PEtN修饰)免疫兔子制备抗血清,用036_Yv 的宿主菌036(O-抗原无PEtN修饰)吸附后,制备针对O-抗原PEtN修饰的特异抗血清,并用135株福氏志贺菌检测血清的特异性。结果 制备的血清能够特异地与O-抗原存在PEtN修饰的福氏志贺菌发生凝集,效价为1:32;除了O-抗原携带PEtN修饰的福氏志贺菌血清型Xv,Yv和4av外,制备的血清不能与其他血清型发生交叉凝集,具有很好的特异性。结论 成功制备了针对福氏志贺菌O-抗原PEtN修饰的特异抗血清,可应用于痢疾检测和监测。
福氏志贺菌是发展中国家细菌性痢疾的主要病原菌 。根据O-抗原的差异,福氏志贺菌分为众多的血清型,目前共有19个血清型被报道 。除了6型外,所有的血清型的O-抗原包含四糖骨架重复单元,在四糖骨架的不同糖基上进行糖基化或/和乙酰化或/磷酸乙醇胺化(PEtN)修饰,形成了不同的血清型 。糖基化和乙酰化修饰是由血清型转换噬菌体携带的O-抗原修饰因子(gtr基因簇或单个oac基因)介导完成的[9],而PEtN修饰是由质粒携带的O-抗原磷酸乙醇胺转移酶编码因子(O-antigen phosphoethanolamine transferase, opt)介导在四糖骨架的第三个(rhamnose Ⅲ, RhaⅢ)和/或第二个鼠李糖(RhaⅡ)添加PEtN基团,导致Xv,4av和Yv血清型菌株或MASF Ⅳ-1 表面抗原的出现 。
目前,福氏志贺菌传统的血清分型方法是血清玻片凝集法,即用灭活菌株免疫动物制备特异的型和群抗血清,用抗血清与菌株凝集,根据凝集谱确定菌株的血清型。目前已有多个商品化的福氏志贺菌血清型试剂盒,包含常见的糖基化和乙酰化修饰形成的表面抗原(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、3;4、6、7;8)。但是,针对O-抗原PEtN修饰,除了单克隆抗体MASF IV-1外,没有特异的抗血清。单克隆抗体MASF IV-1价格昂贵,不易购得。在特殊情况下(PEtN修饰主要在RhaⅡ),MASF Ⅳ-1与菌株的凝集弱,这为血清型的判定带来困难。本研究根据福氏志贺菌O-抗原PEtN修饰机制,利用血清型Y菌株036的opt基因转化株(036_Yv)免疫兔子制备抗血清,经036吸附后,制备针对O-抗原PEtN修饰的特异抗血清,可以用于细菌性痢疾的检测和监测。
1 材料与方法
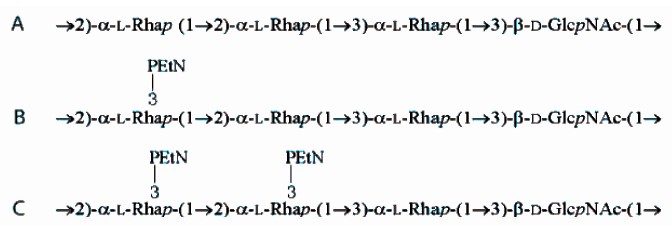
1.1 菌株和培养条件福氏志贺菌036_Yv(血清型Yv)由本实验室构建,它是由菌株036(血清型Y)通过转化质粒pSQZ而来 。菌株036和036_Yv的O-抗原结构已经明确,二者O-抗原的区别在于PEtN修饰[5](图1)。用于特异性分析的135株福氏志 贺菌和4株其他菌属菌株均分离自腹泻患者(表1),本实验室保存。福氏志贺菌用LB液体或固体培养基在37 ℃培养。
图1 福氏志贺菌血清型Y菌株036(A)和Yv菌株036_Yv(B和C)的O-抗原结构图
Figure 1 Structures of the O-polysaccharides from S. flexneri serotypes 036_Y (A) and 036_Yv(B and C)
表1 抗血清与135株福氏志贺菌的凝集结果
Table 1 Result of slide agglutination of antisera with 135 S. flexneri strains
| 血清型 | MASF Ⅳ-1和Ⅳ凝集特性 | 菌株数 | 凝集菌株数 | |
| MASF Ⅳ-1 | Ⅳ | |||
| 1a | - | - | 10 | 0 |
| 1b | - | - | 7 | 0 |
| 1d | - | - | 4 | 0 |
| 7b | - | - | 2 | 0 |
| 2a | - | - | 16 | 0 |
| 2b | - | - | 10 | 0 |
| 3a | - | - | 5 | 0 |
| 3b | - | - | 1 | 0 |
| 4a | - | + | 4 | 0 |
| 4av | + | + | 3 | 3 |
| 4b | - | + | 4 | 0 |
| 5a | - | - | 4 | 0 |
| X | - | - | 12 | 0 |
| Xv | + | + | 21 | 21 |
| Y | - | - | 6 | 0 |
| Yv | + | + | 19 | 19 |
| 6 | - | - | 7 | 0 |
1.2 试验动物及免疫途径和免疫程序
免疫动物为成年雌性未受孕新西兰白兔,普通级,体重2.2 ~2.4 kg,购自北京芳元动物中心。挑取036_Yv单菌落到LB液体培养基(氨苄西林100 μg/ml),37 ℃振荡培养过夜。次日4000 r/min离心收集菌株,用PBS漂洗2次,调整菌液到合适的浓度,于60 ℃水浴1 h灭活。灭活菌液经兔耳缘静脉注射免疫,连续3周,每周2次,注射菌量分别为1×109、2×109、4×109、8×109、16×109、16×109 cfu。
1.3 抗血清的制备及吸附
在末次免疫后1周(第4周),通过心脏收集兔子的血液。置4 ℃下过夜。次日3000 r/min离心10 min分离血清。将过夜培养的036(血清Y型)离心,收集菌体,PBS洗涤2次。将分离的血清加入菌体沉淀中混合均匀(1 ml血清 ∶ 200 ml菌液收集物),室温下振荡30 min,500 r/min离心 30 min,收集上清。重复进行吸附,直至血清与036凝集试验呈阴性。制备的血清加入叠氮钠(终浓度0.04% NaN3)防腐,分装后置-20 ℃保存。以036_Yv来检测血清凝集效价,以出现凝集反应的最高稀释倍数判为凝集效价。
1.4 特异性检测
将制备的血清用生理盐水倍比稀释,与135株福氏志贺菌 和3株大肠埃希菌O157 ∶ H7及1株痢疾志贺菌1型进行玻片凝集试验,检测血清的特异性。
2 结果
分别在免疫前和免疫后1周采集兔子的血液分离血清,并与菌株036_Yv和036进行玻片凝集反应的结果发现,免疫前的兔血清与036和036_Yv均不发生凝集;而免疫后获得的血清能与上述两菌发生凝集,证实免疫菌株036_Yv激发了兔子的免疫反应。我们采用036_Yv的宿主菌036进行吸附,经过多次036吸附后,血清不与036发生凝集,
但能够与036_Yv发生凝集,去掉了血清中非PEtN修饰诱导的抗体。
进一步用制备的血清对135株福氏志贺菌进行血清学特异性检测。这些菌株分离自腹泻患者,包括目前福氏志贺菌已知的19种血清型中的17种,因此具有很好的代表性。结果发现,除MASF Ⅳ-1阳性菌株外(血清型Xv、Yv和4av),制备的血清不能与福氏志贺菌其他14种血清型菌株发生凝集(表1)。鉴于MASF Ⅳ-1与PEtN修饰的对应关系,我们认为血清是特异性针对O-抗原中的RhaIII的PEtN修饰。值得注意的是,与单克隆抗体MASF Ⅳ-1凝集弱的菌株51580_Xv,51581_Yv等,也能与制备的血清发生明显的凝集反应。另外,对4株其他菌属的菌株进行凝集反应发现,制备的血清不能与他们发生凝集。因此制备的血清具有很好的特异性,它可以用于检测福氏志贺菌O-抗原的RhaIII的PEtN修饰。
为检测制备血清的凝集效价,将血清用PBS进行倍比稀释,并与036_Yv菌株进行玻片凝集反应。结果发现在稀释倍数为32时,仍能观测到凝集现象,因此判定凝集效价为1 ∶ 32。
3 讨论
福氏志贺菌O-抗原PEtN修饰是最近发现的一种新的O-抗原修饰方式,是除糖基化和乙酰化外,福氏志贺菌O-抗原的第三种修饰方式 。这种修饰导致血清型Yv、Xv和4av菌株MASF Ⅳ-1(或E1037)抗原表位的出现,这些血清型菌株能够与单克隆抗体MASF Ⅳ-1反应 。目前,单克隆抗体MASF Ⅳ-1是鉴定福氏志贺菌PEtN修饰的唯一血清。但是,研究发现,某些菌株O-抗原尽管存在PEtN修饰,但是与MASF Ⅳ-1的凝集反应较弱,甚至阴性,这可能与菌株携带的不同opt基因(optRⅡ和optRⅢ)介导的对四糖骨架中RhaⅡ或RhaⅢ的修饰偏好性有关[5],这就造成了MASF Ⅳ-1凝集反应弱或假阴性。另外,目前,MASF Ⅳ-1单克隆抗体仅一家公司生产,价格昂贵,限制了其在基层疾控的实际应用。福氏志贺菌O-抗原PEtN修饰的菌株还能够与单价抗血清Ⅳ发生凝集,因此当使用单价抗血清时,血清型Yv和4av表现为血清型4a的凝集谱,因此被错误地鉴定为4a血清型。
传统的制备志贺菌抗血清方法是采用灭活的菌株免疫动物,然后用不同血清型菌株进行免疫吸附。由于吸附菌株和免疫菌株的差异,使血清中的非特异抗体不能被完全清除。本研究基于对MASF Ⅳ-1阳性菌株O- 抗原结构的认识,制备了针对 O-抗原PEtN修饰的特异抗血清。 所用的免疫菌株036_Yv是由036菌株经转化质粒pSQZ[5]而来。质粒pSQZ携带编码PEtN转移酶的基因opt。它介导菌株036_Yv O-抗原的PEtN修饰。因此,除了O-抗原的PEtN修饰差异外,036与036_Yv 的蛋白组分及O-抗原结构一致。用具有相同背景的036对036_Yv的免疫血清进行吸附,可以特异性地筛选出抗PEtN修饰的抗体。本研究中制备的抗血清只能与Xv,Yv和4av等存在PEtN修饰的血清型菌株发生凝集,而不与其他血清型福氏志贺菌发生凝集,因此具有很好的特异性。另外,制备的血清克服了单克隆抗体识别位点的单一性缺点,能够对RhaⅡ或RhaⅢ位点修饰的菌株凝集,因此具有很好的实用价值。
本研究制备的针对福氏志贺菌O-抗原PEtN修饰的抗血清,具有特异、廉价等优点,适合于细菌性痢疾的检测和监测,对于痢疾的防控具有重要意义。
参考文献
[1] Kotloff KL, Winickoff JP, Ivanoff B, et al.Global burden of Shigella infections: implications for vaccine development and implementation of control strategies[J]. Bull World Health Organ,1999,77(8):651-666.
[2] Shiferaw B, Shallow S, Marcus R, et al. Trends in population-based active surveillance for shigellosis and demographic variability in FoodNet sites, 1996-1999[J]. Clin Infect Dis,2004,38 Suppl 3:S175-180.
[3] El-Gendy A, El-Ghorab N, Lane EM, et al. Identification of Shigella flexneri subserotype 1c in rural Egypt[J]. J Clin Microbiol,1999,37(3):873-874.
[4] Foster RA, Carlin NI, Majcher M, et al. Structural elucidation of the O-antigen of the Shigella flexneri provisional serotype 88-893: structural and serological similarities with S. flexneri provisional serotype Y394 (1c)[J]. Carbohydr Res,2011,346(6):872-876.
[5] Knirel YA, Lan R, Senchenkova SN, et al. O-antigen structure of Shigella flexneri serotype Yv and effect of the lpt-O gene variation on phosphoethanolamine modification of S. flexneri O-antigens[J].Glycobiology,2013,23(4):475-485.
[6] Luo X, Sun QZ, Lan RT, et al. Emergence of a novel Shigella flexneri serotype 1d in China[J]. Diagn Microbiol Infect Dis,2012,74(3):316-319.
[7] Sun QZ, Lan RT, Wang YT, et al. Genesis of a novel Shigella flexneri serotype by sequential infection of serotype-converting bacteriophages SfX and SfI[J]. BMC Microbiol,2011,11:269.
[8] Sun QZ, Knirel YA, Lan RT, et al. A Novel Plasmid-Encoded Serotype Conversion Mechanism through Addition of Phosphoethanolamine to the O-Antigen of Shigella flexneri[J]. PLoS One,2012,7(9):e46095.
[9] Allison GE, Verma NK. Serotype-converting bacteriophages and O-antigen modification in Shigella flexneri[J].Trends Microbiol,2000,8(1):17-23.
[2] Shiferaw B, Shallow S, Marcus R, et al. Trends in population-based active surveillance for shigellosis and demographic variability in FoodNet sites, 1996-1999[J]. Clin Infect Dis,2004,38 Suppl 3:S175-180.
[3] El-Gendy A, El-Ghorab N, Lane EM, et al. Identification of Shigella flexneri subserotype 1c in rural Egypt[J]. J Clin Microbiol,1999,37(3):873-874.
[4] Foster RA, Carlin NI, Majcher M, et al. Structural elucidation of the O-antigen of the Shigella flexneri provisional serotype 88-893: structural and serological similarities with S. flexneri provisional serotype Y394 (1c)[J]. Carbohydr Res,2011,346(6):872-876.
[5] Knirel YA, Lan R, Senchenkova SN, et al. O-antigen structure of Shigella flexneri serotype Yv and effect of the lpt-O gene variation on phosphoethanolamine modification of S. flexneri O-antigens[J].Glycobiology,2013,23(4):475-485.
[6] Luo X, Sun QZ, Lan RT, et al. Emergence of a novel Shigella flexneri serotype 1d in China[J]. Diagn Microbiol Infect Dis,2012,74(3):316-319.
[7] Sun QZ, Lan RT, Wang YT, et al. Genesis of a novel Shigella flexneri serotype by sequential infection of serotype-converting bacteriophages SfX and SfI[J]. BMC Microbiol,2011,11:269.
[8] Sun QZ, Knirel YA, Lan RT, et al. A Novel Plasmid-Encoded Serotype Conversion Mechanism through Addition of Phosphoethanolamine to the O-Antigen of Shigella flexneri[J]. PLoS One,2012,7(9):e46095.
[9] Allison GE, Verma NK. Serotype-converting bacteriophages and O-antigen modification in Shigella flexneri[J].Trends Microbiol,2000,8(1):17-23.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 王建平 | |
| 罗霞 | |
| 徐建国 | |
| 孙强正 | |
| PubMed | |
| Article by WANG Jian-ping | |
| Article by LUO Xia | |
| Article by XU Jian-guo | |
| Article by SUN Qiang-zheng | |