-
1 材料与方法
- 1.1 毒株来源
- 1.2 参考抗原与抗血清制备
- 1.3 病毒的复核鉴定及抗原性分析
- 1.4 病毒RNA的提取及基因扩增
- 1.5 PCR产物纯化及序列测定
- 1.6 序列分析
- 2.1 我国大陆地区B型流感病毒的流行情况
- 2.2 我国大陆地区B型流感病毒的抗原性分析
- 2.2.1 Victoria系流感病毒的抗原性分析结果
- 2.2.2 Yamagata系流感病毒的抗原性分析结果
- 2.3 我国大陆地区B型流感病毒的基因特性分析
- 2.3.1 Victoria系流感病毒的基因特性分析结果
- 2.3.2 Yamagata系流感病毒的基因特性分析结果
- 2.3.3 耐药位点分析
3 讨论
流行性感冒(流感)为第一个实行全球性监测的传染病,可造成世界范围内的广泛流行。每次流感流行后,总会造成不同程度的超额死亡和巨大的经济损失[1][2]。根据流感病毒内部蛋白抗原性的不同,可分为A、B、C三个型。自1983年以来,B型流感病毒根据其抗原性和基因特性分为两大谱系,代表株分别为B/Yamagata/16/88和B/Victoria/2/87,简称为Yamagata系和Victoria系[3]。
自20世纪90年代后,Yamagata和Victoria两个系的病毒共同流行,但在世界各地会呈现不同的流行比例。世界卫生组织(WHO)于2012年2月将疫苗组分中的B型Victoria系病毒更换为B型Yamagata系病毒B/Wisconsin/01/2010[4]。更换疫苗组分后,我国在本监测年度内流感病毒的流行趋势与变异情况以及流行病毒与疫苗株的匹配性如何?本文通过研究我国大陆地区2012-2013监测年度内B型流感病毒的流行情况、抗原性及基因特性,对上述问题作出阐述。
1 材料与方法1.1 毒株来源
所有流感毒株均来自中国流感监测网络,该监测网络覆盖中国大陆31个省(自治区、直辖市),目前包括408家网络实验室和554家哨点医院。
依据《全国流感监测技术指南》(《指南》),每年4月1日所在周至次年4月1日所在周前一周为一个流感监测年度,因此本监测年度流感毒株的采样日期为2012年3月26日至2013年3月31日。
1.2 参考抗原与抗血清制备参考抗原采用国内代表株和WHO推荐的国际疫苗株。其中国际疫苗株B/Wisconsin/01/2010为美国疾病预防控制中心(CDC)提供,中国的国内代表株由国家流感中心筛选。所有参考抗原和参考抗血清均由国家流感中心制备,方法见参考文献[5]。
1.3 病毒的复核鉴定及抗原性分析网络实验室的流感毒株上送至国家流感中心后,对血凝(HA)滴 度≥8的毒株利用雪貂抗血清,通过血凝抑制(HI)实验分析流感病毒的抗原性,方法参见《指南》。
1.4 病毒RNA的提取及基因扩增取病毒培养液200 μl,使用德国QIAGEN公司的RNeasy Mini Kit试剂盒提取病毒RNA后使用QIAGEN公司One Step RT-PCR Kit进行基因扩增。具体操作方法参见试剂盒说明书。扩增引物来自http://gsc.jcvi.org/projects/msc/influenza网站,由大连宝生物公司合成。PCR反应条件为60 ℃ 1 min;42 ℃ 20 min;50 ℃ 20 min;95 ℃ 15 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,循环35次;72 ℃ 10 min;4 ℃保存。
1.5 PCR产物纯化及序列测定PCR产物使用USB公司的ExoSAP-IT试剂纯化。使用美国ABI公司的BigDye Terminator v3.1 Cycle Sequencing Kit进行测序反应,测序引物为M13 forward:tgt aaa acg acg gcc agt,M13 reverse:cag gaa aca gct atg acc;测序反应条件为96 ℃ 1 min;96 ℃ 10 s,50 ℃ 5 s,60 ℃ 4 min,循环25次。测序产物用美国ABI公司的BigDye Xterminator Kit进行纯化后,在该公司的3730XL全自动DNA测序仪上进行序列测定。具体操作步骤参考试剂盒及仪器操作说明书。
1.6 序列分析采用DNAStar软件中的Seqman程序对序列进行拼接。用Mega 5.0软件的Clustal W方法进行序列的比对,去除序列相同的毒株,采用Neighbor-joining方法进行种系进化分析,并对HA和NA氨基酸序列进行流感病毒分子特征分析。文中分析序列所用的国际株为B/Brisbane/60/2008、B/Wisconsin/01/2010、B/Maryland/3039/2012、B/South Dakota/3040/2012、B/Taiwan/94748/2012和B/Taiwan/94786/2012,其HA和NA基因的GenBank序列号分别为FJ766840、FJ766839、CY115183、CY115185、CY130168、CY130169、CY130170、CY130171、JX266905、JX266948、JX266904和JX266947。
2 结果2.1 我国大陆地区B型流感病毒的流行情况
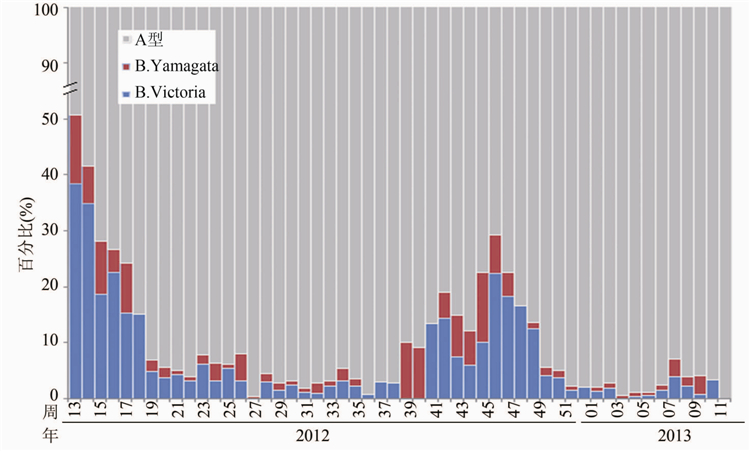
2012-2013监测年度,国家流感中心共收检9060株流感病毒,其中B型流感病毒900株(9.93%),B-Victoria系657株(7.25%),B-Yamagata系243株(2.68%)。从2012年第13周开始,B型毒株比例逐渐减少,而从第38周开始增多。在2013年1-3月流行的毒株中,B型流感毒株所占比例仍较低,仅为2.40%。其中Victoria系毒株明显多于Yamagata系毒株的数量,见图1。
图1 2012-2013监测年度我国流感毒株构成情况Figure 1 Proportion of influenza virus strains detecterd in China,2012-2013
2.2 我国大陆地区B型流感病毒的抗原性分析
根据WHO建议的标准,当待检病毒与参考雪貂抗 血清的HI效价低于参考病毒与参考抗血清自身 HI效价的8倍(含8 倍) 或以上时,则认为待检病 毒是该参考抗血清检测到的低反应株;反之,当相 差8倍以内时,则认为待检病毒是参考病毒的类 似株。
2.2.1 Victoria系流感病毒的抗原性分析结果本年度WHO推荐的三价流感疫苗组分不包含B型Victoria系。国家流感中心对全国436株B型Victoria系流感病毒进行抗原性分析,结果显示大部分毒株与上一年度疫苗株B/Brisbane/60/2008(83.5%)和我国流行代表株B/Chongqing-Yuzhong/1384/2010(94.7%)抗原性类似,且南北方省份差异无统计学意义,见表1。
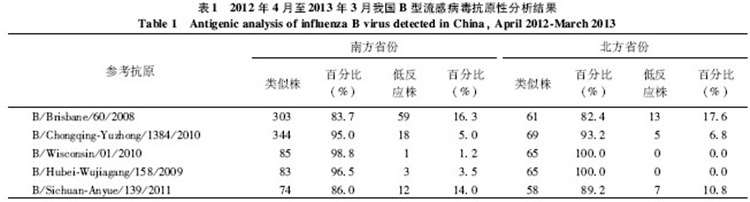
国家流感中心度收检的全国151株B型Yamagata系流感病毒进行了抗原性分析,结果显示150株(99.3%)为疫苗株B/Wisconsin/01/2010的类似株,只有1株(0.07%)为疫苗株的低反应株。148株(98.0%)病毒为疫苗种子株B/Hubei-Wujiagang/158/2009的类似株,只有3株(2.0%)低反应株。有132株(87.4%)病毒与我国流行代表株B/Sichuan-Anyue/139/2011的抗原分析结果显示南北方省份的毒株抗原性差异无统计学意义,见表1。
2.3 我国大陆地区B型流感病毒的基因特性分析2.3.1 Victoria系流感病毒的基因特性分析结果
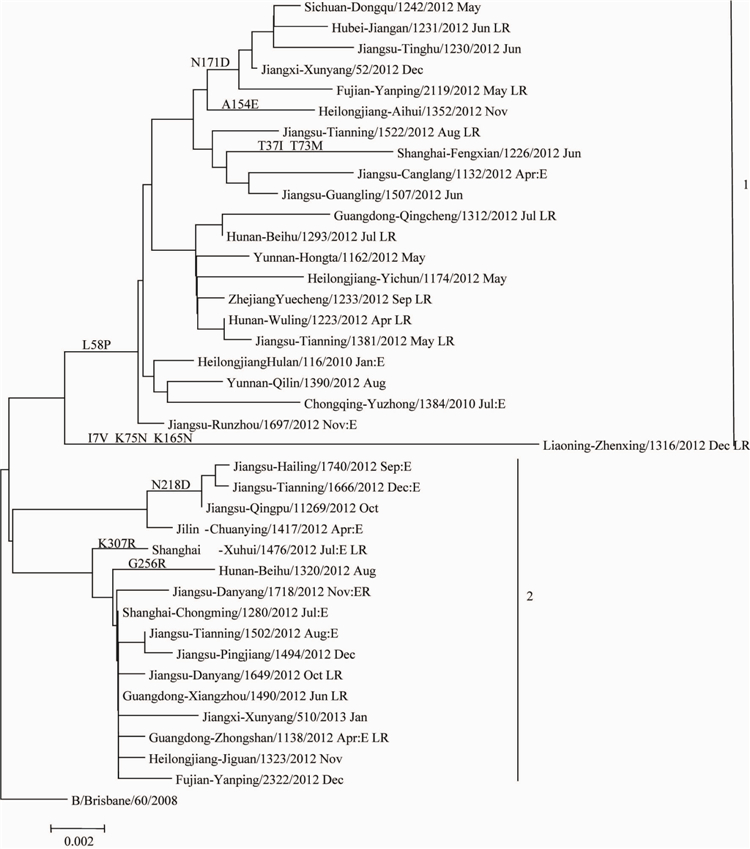
对本年度分离到的39株B型Victoria系流感病毒的HAI基因构建核苷酸进化树(图2),可以看出本检测年度流行的Victoria系流感病毒主要分为2个分支(Clade),分别命名为分支1和分支2.分支1内的毒株根据氨基酸的变异情况有进一步分为两组(Group),Group1的毒株剧哦与158P氨基酸变异。Group2只有1株B/liaoning-Zhenxing/1316/2012,具有17V、K75N和K165N氨基酸突变。而分支2的毒株没有形成共同的氨基酸变异。其中B/B/Brisbane/60/2008的低反应株在进化树上未形成独立分支,且这些低反应株没有共同但计算位点突变。
注:LR. B/Brisbane/60/2008的低反应株;R.HA-2/NA-1分支间重配株;E.鸡胚珠。图22012-2013年中国大陆B型Victoria系流感病毒HAI基因进化树
Figure 2 Phylogenetic tree of HAI gene of influnenza B Victoria linage virus detected in China,2012-2013
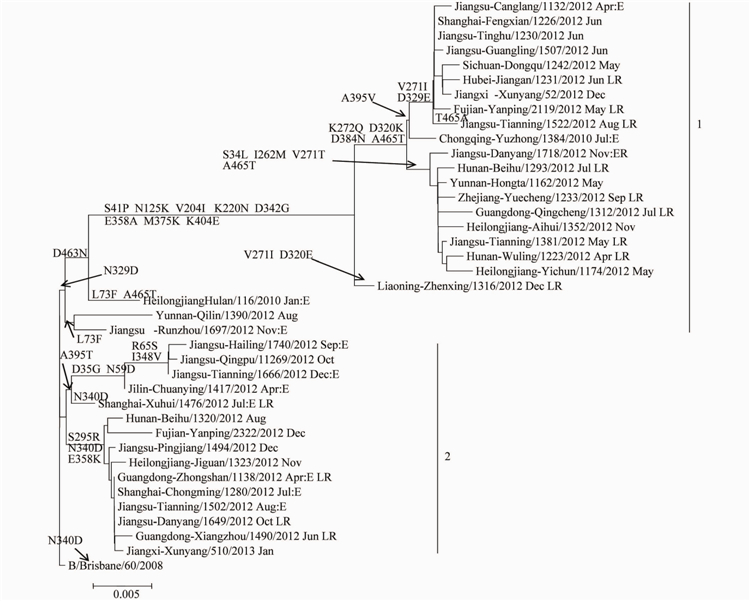
注:LR. B/Brisbane/60/2008的低反应株;R.HA-2/NA-1分支间重配株;E.鸡胚珠。
图32012-2013年中国大陆B型Victoria系流感病毒NA基因进化树
Figure 3 Phylogenetic tree of NA gene of influenza B Victoria linage virus detected in China,2012-2013
相应的NA基因进化树见图3.NA基因同样分为2个分支,分别为HAI基因的分支相对应。分支1的毒株有进一步分为2组,Group1具有D463N氨基酸的共同突变;Group2的2株病毒具有L73F和N3290氨基酸位点变异。分支2也分为2组,Group1的5株病毒均具有A395T变异,Group2的病毒具有S295RN340D和E358K位点突变。值得关注的是,有1株病毒B/Jiangsu-Danyang/1718/2012,其HAI基因在进化树上的分支2,NA基因位于进化树的分支1,标明病毒发生了重配。
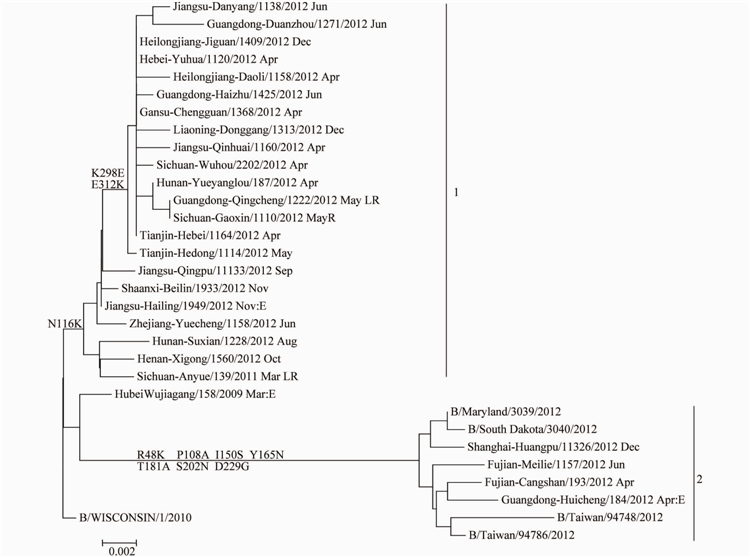
2.3.2 Yamagata系流感病毒的基因特性分析结果对本度分离到的25株B型Yamagata系流感病毒的HAI基因构建核苷酸进化树(图4),可以看出,本监测年度内分离到的Yamagata系流感病毒分为2个分支(Clade),分支1的毒株均具有N116K变异,分支2的毒株均具有R48K、P108A、I150S、Y165N、T181A、S202N和D229G氨基酸位点的共同变异。
我国分离到的B型Yamagata系流感病毒大部分处于分支1,只有极少数病毒(4株)位于分支2。我们从GenBank上下载了271株本年度国外分离的毒株构建HAI核苷酸进化树,只有6株病毒位于分支1,其余265株(98.7%)病毒均位于分支2,可见本年度国际流行的B型Yamagata系毒株绝大多数 位于分支2,这与我国流行情况打不相同。此外,本检测年度分离到的1株疫苗株B/Wisconsin/01/2010的低反应株B/Guangdong-Qingcheng/1222/2012,与大多数毒株一样,位于分支1。
对应的NA基因核苷酸进化树同样分为2大分支,见图5。我们发现Yamagata系病毒B/Sichuan-Gaoxin/1110/2012的NA基因位于B型Victoria系病毒的NA进化分支,标明此病毒发生了种系见得基因重配。
注:LR. B/Wisconsin/01/2010低反应株;R.种系间重配株;E.鸡胚珠。图42012-2013年中国大陆B型Yamagata系流感病毒HAI基因进化树
Figure 4 Phylogenetic tree of HAI gene of influenza B Yamagata linage virus detected in China,2012-2013
注:LR. B/Wisconsin/01/2010低反应株;R.种系间重配株;E.鸡胚珠。
图52012-2013年中国大陆B型Yamagata系流感病毒NA基因进化树
Figure 5 Phylogenetic tree of NA gene of influenza B Yamagata linage virus detected in China,2012-2013
2.3.3 耐药位点分析
在NA金银的E117A/D/G/V[6]、R150K[6-7]、D197E/N/Y[6]、R150K[7-8]、I221T/V[6,9]、H273Y[6]、R292K[10]、N294S[11]、R374K[6]、G407S[6]等位点,均未发生氨基酸位点的变异,表明本年度检测的所有型流感病毒均对神经氨酸酶抑制剂敏感。
3.讨论WHO在2012年2月见2012-2013年冬季北半球是用的三价流感疫苗组分中的B型Victoria系毒株跟换为Yamagata系毒株B/Wisconsin/01/2010。虽然在我国2012-2013检测年度中分离到的Yamagata系流感病毒中巨大多数为新疫苗株B/Wisconsin/01/2010(99.3%)以及作为种子株的疫苗类似株B/Hubei-Wujiagang/158/2009(98.0%)的类似株,但是本监测年度中我国Victoria系流感病毒的比例超过Yamagata系病毒而成为优势流行株。由于Victoria系和Yamagata系流感病毒之间缺乏交叉保护[13],导致本年度WHO推荐的B型流感疫苗组分与我国B型流感优势流行株匹配性不佳。但是由于本年度B型流感病毒占所有流感病毒的比例低于10%,因此并不会显著削弱三价流感疫苗的免疫保护效果。美国食品药物管理局已经批准了包括Yamagata和Victoria两系病毒在内的四价流感疫苗的生产[13],而最近的临床试验也表明,四价流感疫苗具有较好的免疫保护效果[14]。所以在目前通用型流感疫苗尚未面市的情况下,四价流感疫苗 是全球流感疫苗发展的必然趋势,我国也应该发展 使用四价流感疫苗,为普通人群尤其是高危人群提 供有效的保护。
我们通过比较发现,国外Yamagata系毒株基本位于分支2,与我国的流行情况并不相同,我国分离到的大部分B型Yamagata系毒株位于进化树的分 支1中,只有极少的病毒在分支2中。但由于分支 2中的病毒有可能会成为我国下一流感监测年度的 主要流行病毒,因此也应加强监测,并及时分析分 支1和分支2病毒的抗原性差异。通过上述分析, 应加强针对我国流行株的流感疫苗自主研发能力, 以便使疫苗株与我国流行株更为匹配。
[2] Wozniak Kosek A,Brydak LB. Virological monitoring of influenza activity and influenza like illness in the epidemic season 2011-2012 in Poland[J]. Adv Exp Med Biol, 2013,788: 77-82.
[3] Rota PA,Wallis TR,Harmon MW,et al. Cocirculation of two distinct evolutionary lineages of influenza type B virus since 1983[J]. Virology, 1990,175(1):59-68.
[4] WHO. Recommended composition of influenza virus vaccines for use in the 2012-2013 northern hemisphere influenza season[J]. Weekly Epidemiological Record, 2012,87(10):81-96.
[5] Guo YJ,Cheng XW. Influenza virus and its experimental technology[M]. Beijing: China Three Gorges Publishing House, 1997.(in Chinese)郭元吉,程小雯. 流行性感冒病毒及其实验技术[M]. 北京:中国三峡出版社,1997.
[6] Sheu TG,Deyde VM,Garten RJ,et al. Detection of antiviral resistance and genetic lineage markers in influenza B virus neuraminidase using pyrosequencing[J]. Antiviral Res, 2010,85(2):354-360.
[7] Oakley AJ,Barrett S,Peat TS,et al. Structural and functional basis of resistance to neuraminidase inhibitors of influenza B viruses[J]. J Med Chem, 2010,53(17):6421-6431.
[8] Escuret V,Frobert E,Bouscambert Duchamp M,et al. Detection of human influenza A(H1N1) and B strains with reduced sensitivity to neuraminidase inhibitors[J]. J Clin Virol, 2008,41(1):25-28.
[9] Sleeman K,Sheu TG,Moore Z,et al. Influenza B viruses with mutation in the neuraminidase active site, North Carolina, USA,2010-11[J]. Emerg Infect Dis, 2011,17(11):2043-2046.
[10] Jackson D,Barclay W,Zurcher T,et al. Characterization of recombinant influenza B viruses with key neuraminidase inhibitor resistance mutations[J]. J Antimicrob Chemother, 2005,55(2):162-169.
[11] Carr S,Ilyushina NA,Franks J,et al. Oseltamivir resistant influenza A and B viruses pre and postantiviral therapy in children and young adults with cancer[J]. Pediatr Infect Dis J, 2011,30(4):284-288.
[12] Belshe RB,Coelingh K,Ambrose CS,et al. Efficacy of live attenuated influenza vaccine in children against influenza B viruses by lineage and antigenic similarity[J]. Vaccine, 2010,28(9):2149-2156.
[13] FDA approves first quadrivalent vaccine to prevent seasonal influenza[EB/OL]. [2012-02-29]. http://www.fda.gov/newsevents/newsroom/pressannouncements/ucm294057.htm.
[14] Greenberg DP,Robertson CA,Noss MJ,et al. Safety and immunogenicity of a quadrivalent inactivated influenza vaccine compared to licensed trivalent inactivated influenza vaccines in adults[J]. Vaccine, 2013,319(5):770-776.