2. Dongpo District Center fro Disease Control and Prevention, Meishan, Meishan 610000, Sichuan, China
2. 眉山市东坡区疾病预防控制中心, 四川 眉山 610000
-
1 基本情况
- 2.1 引物序列
- 2.2 病原菌分离
- 2.3 PCR
- 2.4 多重-聚合酶链反应(multiple PCR,多重PCR)
- 2.5 脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)
- 2.6 聚类分析方法
- 3.1 病原菌分离结果
- 3.2 PCR和多重PCR检测结果
- 3.3 PFGE分型聚类结果
2 实验室检测
2013年6月13 15日,四川省眉山市某学校发生了一起发热、头痛、乏力、腹痛、腹泻、咽痛等症状的暴发疫情,经流行病学调查和实验室检测分析,证实为一起由鼠伤寒沙门菌污染食品引起的食源性疾病暴发疫情。鼠伤寒沙门菌是食品污染、食物中毒、水源性腹泻暴发及医院感染的常见病原菌,其引起的暴发疫情患者临床症状主要为腹痛、腹泻、发热等,患者出现腹泻症状(24 h内腹泻次数≥3次且性状改变)一般为95%~100%[1-6],此起疫情患者在初期出现的症状为发热、乏力和咽痛,后期才逐渐出现腹痛、腹泻等胃肠道症状,患者中只有56.4%(226人)腹泻,仅有31.2%(125人)在24 h内腹泻次数≥3次,且有7.7%出现咽痛的症状,与常见鼠伤寒沙门菌食源性疾病暴发患者出现症状不一致,并且此起疫情发生在学校,发病人数多达401例,年龄较低,均为幼儿、小学生和初中生,因此,疫情的准确快速诊断显得尤为重要,省、市疾病预防控制中心(CDC)接到报告后,迅速开展现场调查和实验室检测,实验室在采集到样本后的20 h便准确快速检出致病因子,快速诊断疫情。
1 基本情况该学校位于眉山市中心城区,设有高中部、初中部、小学部和学前班共计13个年级,在校学生1246人,教职员工175人。该校为全日制封闭式学校,学生全部住校,学生住宿比较密集。
学校使用城市集中供水,一个食堂,承担全部学生和老师的饮食供应,菜和汤在厨房集中制作好后,用大盆盛装分送到不同楼层的餐厅供学生和老师食用。餐厅一层为高中生就餐地点,餐厅二楼为初中生、小学生和学前班就餐地点,盛装食品大盆没有明显的生熟标志,据食堂工作人员描述,在装完生菜和生肉后只简单清洗后再用来盛装熟菜,因其体积较大,没有相应的消毒池而不进行消毒处理。该校6月12日食堂供应菜谱为早餐:盐蛋、粽子、稀饭、炒酸菜;午餐:青豆烧鸡、青椒烩肉、烩豇豆(实际做法为:豇豆煮熟后分装至2个大盆,然后加入佐料拌食,根据做法应为凉拌豇豆)、番茄汤;晚餐:蒜苔肉丝、炝连白、烩豆角、酸菜汤。
6月13日凌晨开始陆续有学生发病,初期症状为发热、头晕、头痛、乏力、咽痛,后续出现腹痛、腹泻、呕吐等胃肠道症状,至6月15日无新发病例,病例共计401例,高中生、厨房工作人员和教师未发病。患病学生广泛分布于初中、小学和学前班的各班级。
401例患者中,379例(94.5%)出现发热的症状,其中346例(86.3%)体温为38 ℃以上。226例(56.4%)出现腹泻症状,125例(31.2%)在24 h内腹泻次数≥3次,头痛206例(51.4%),乏力157例(39.2%),腹痛153例(38.2%),呕吐74例(18.5%),咽痛31例(7.7%)。
2 实验室检测采集22名食堂员工和9例患者肛拭子,18份食堂留样食品样本进行实验室检测。
2.1 引物序列运用聚合酶链反应(polymerase chain reaction,PCR)检测致泻性大肠埃希菌毒力基因,见表1,检测沙门菌invA基因引物序列(284 bp): 5′-GTG AAA TTA TCG CCA CGT TCG GGC AA-3′,5′-TCA TCG CAC CGT CAA AGG AAC C-3′。
表1 致泻性大肠埃希菌引物序列Table 1 Primer sequence for diarrheagenic Escherichia coli
| 引物名称 | 引物序列(5′~3′) | PCR 产物长度(bp) | 检测目标菌 |
| escV-F | ATT CTG GCT CTC TTC TTC TTT ATG GCT G | 544 | EPEC |
| escV-R | CGT CCC CTT TTA CAA ACT TCA TCG C | STEC | |
| bfpB-F | GAC ACC TCA TTG CTG AAG TCG | 910 | EPEC |
| bfpB-R | CCA GAA CAC CTC CGT TAT GC | ||
| stx1A-F | CGA TGT TAC GGT TTG TTA CTG TGA CAG C | 244 | STEC |
| stx1A-R | AAT GCC ACG CTT CCC AGA ATT G | ||
| stx2A-F | GTT TTG ACC ATC TTC GTC TGA TTA TTG AG | 324 | |
| stx2A-R | AGC GTA AGG CTT CTG CTG TGA C | ||
| elt-F | GAA CAG GAG GTT TCT GCG TTA GGT G | 655 | ETEC |
| elt-R | CTT TCA ATG GCT TTT TTT TGG GAG TC | ||
| estIa-F | CCT CTT TTA GYC AGA CAT CTG AAT CAA TTG | 157 | |
| estIa-R | CAG GCA GGA TTA CAA CAA AGT TCA CAG | ||
| estIb-F | TGT CTT TTT CAC CTT TCG CTC | 171 | |
| estIb-R | CGG TAC AAG CAG GAT TAC AAC AC | ||
| invE-F | CGA TCA AGA ATC CCT AAC AGA AGA ATC AC | 766 | EIEC |
| invE-R | CGA TAG ATG GCG AGA AAT TAT ATC CCG | ||
| astA-F | TGC CAT CAA CAC AGT ATA TCC G | 102 | EAEC |
| astA-R | ACG GCT TTG TAG TCC TTC CAT | ||
| aggR-F | ACG CAG AGT TGC CTG ATA AAG | 400 | |
| aggR-R | AAT ACA GAA TCG TCA GCA TCA GC | ||
| pic-F | AAA TGT CAG TGA ACC GAC GAT TGG | 1111 | |
| pic-R | AGC CGT TTC CGC AGA AGC C | ||
| uidA-F | AAA GTG TGG GTC AAT AAT CAG GAA GTG | 1487 | 通用 |
| uidA-R | ATG CCA GTC CAG CGT TTT TGC |
对患者和食堂员工肛拭子或粪便按照WS 271 2008进行腹泻病原菌分离培养,对食堂留样的食品样本按照GB 4789.4 2010、GB/T 4789.6 2003进行检测。同时,对所有样本先直接划线选择性平板(XLD、MAC、HE),待菌落生长后,挑取分离平板上生长的可疑沙门菌菌落直接进行沙门菌多价血清初步凝集试验,血清凝集的菌落纯化后进行生化鉴定。
2.3 PCR实验直接挑取选择性平板(XLD、HE)上可疑沙门菌菌落,采用PCR方法检测沙门菌invA基因,PCR反应体系为20 μl,反应条件为预变性94 ℃,10 min;后续循环94 ℃ 30 s,64 ℃ 30 s,72 ℃ 30 s,30个循环;延伸72 ℃,7 min[7]。
2.4 多重-聚合酶链反应(multiple PCR,多重PCR)实验直接挑取选择平板(HE、MAC、XLD)上可疑大肠埃希菌,每个样本挑取20个可疑菌落,采用多重PCR方法进行致泻性大肠埃希菌毒力基因检测,多重PCR反应体系为50 μl,反应条件为预变性94 ℃ 5 min。变性94 ℃ 30 s,复性63 ℃ 30 s,延伸72 ℃ 1.5 min,30个循环。最后72 ℃延伸5 min。
2.5 脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)实验按照美国CDC公布的沙门菌PFGE标准分型方法[8],对从食品和患者中分离的相同血清型的沙门菌进行PFGE分子分型试验。取新鲜琼脂培养物集菌均匀悬浊于2 ml细胞悬液 中,调节浓度,使其A值为4.2~4.4。取400 μl菌悬液37 ℃孵育5 min,分别加入蛋白酶K20 μl(储存液浓度为20 mg/ml)至终浓度 0.5 mg/ml,再与等体积1% Seakem Gold琼脂混合,加入模具。在室温下凝固后取出胶块加5 ml细胞裂解液 和25 μl蛋白酶K(终浓度0.1 mg/ml),混匀,54 ℃水浴轻摇2 h,转速约170 r/min。预热TE 50 ℃水浴15 min洗胶块4次。切2 mm胶块加入195 μl酶切缓冲液中,再加入5 μl XbaⅠ,37 ℃酶切2.30 h。酶切好的胶块粘在梳子上制胶、电泳,电泳时泵设为70,电泳温度14 ℃,电压梯度6 V/cm,脉冲时间 2.16 s~63.8 s,电场夹角120°,电泳时间19.5 h。 0.1 μg/ml GELred染色30 min,纯水中脱色30 min,凝胶成像仪上读取图像。
2.6 聚类分析方法使用BioNumerics(Version 6.0)数据库软件进行聚类分析,方法采用UPGMA(unweighted pair group method using arithmetic averages),聚类相似性系数(Dice,距离)采用的是基于条带比较的:Dice=2×N(N+M),式中N表示能匹配的条带的个数,M表示所有条带的个数(2个菌带型上的条带个数总和,再减去匹配的条带个数)。根据聚类结果,按不同菌株的相似性系数进行分型,<90%的定为不同的型,>90%而<100%的为不同的亚型,相似系数等于100%的不同菌株为同一亚型。
3 实验结果3.1 病原菌分离结果
对所有采集的样本进行常见腹泻致病菌检测,从总共9份患者粪便样本中的6份样本中检出鼠伤寒沙门菌,其在直接划线沙门菌分离平板上典型菌落极少,每个平板仅有1~2个疑似菌落,为劣势菌群,其中3份患者粪便同时检出致病性大肠埃希菌,从2份食品样本(凉拌豇豆和粽子)中检出鼠伤寒沙门菌,其余患者、留样食品样本和食堂职工肛拭子中均未检出常见腹泻致病菌。
3.2 PCR和多重PCR检测结果3份患者样本分离株致病性大肠埃希菌毒力基因escV基因阳性, 6例患者和2份食品(凉拌豇豆和粽子)分离株沙门菌invA基因阳性。
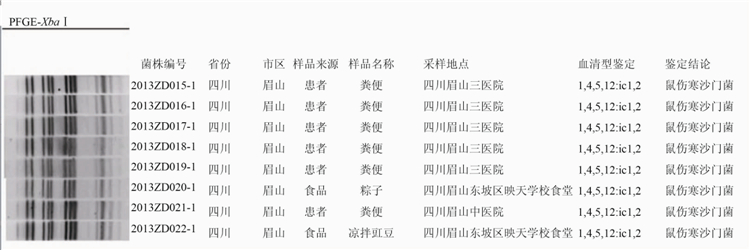
3.3 PFGE分型聚类结果对从6例患者和2份食品(凉拌豇豆和粽子)中分离出的8株鼠伤寒沙门菌基因组DNA经XbaⅠ酶切后,将PFGE图谱进行聚类分析,结果显示来自患者和食品中的共8株鼠伤寒沙门菌具有相同的PFGE带型,见图1。
图1 8株鼠伤寒沙门菌分离株PFGE聚类分析图谱Figure 1 Cluster analysis of 8 isolates of Salmonella typhimurium by PFGE
4 讨论
本起食源性疾病暴发事件的患者,在发病初期的临床症状多数表现为发热、头晕、头痛、乏力、部分患者咽喉痛,后期出现胃肠道症状,因此,事件初期的流行病学调查结果判断为呼吸道感染,通过实验室检测排除了由呼吸道病毒引起的呼吸道感染疫情。当患者出现腹泻症状后,采集患者样本进行实验室检测,仅从3份患者中检出不同血清型致病性大肠埃希菌,从食物样本中也未检出同血清型的致泻大肠埃希菌,不能判定其为事件的病原。从6例患者粪便和食品中检出PFGE型别一致的鼠伤寒沙门菌,结合流行病学调查结果,可判定该起疾病暴发由食用鼠伤寒沙门菌污染食品引起。
本次疫情发生在学校,患病学生年龄较低,人数多,并且多数学生临近中考,社会影响较大,实验室对病原的快速准确诊断对患者的处理与治疗、事件判定与控制、社会的稳定尤为重要。为此,本实验室采用多种检测方法和技术同时进行,对粪便样本增菌同时划线选择平板,待培养16 h后直接挑取平板上可疑沙门菌菌落进行血清凝集,血清学结果只能做病原方向提示,需要生化鉴定结果才能发出初步报告,而菌株纯化与生化鉴定耗时长,为此,实验室在凝集血清后对剩余菌苔进行纯化的同时开展沙门菌invA基因检测,invA基因与沙门菌对肠道上皮细胞的侵袭有关,具有属特异性,是沙门菌属侵袭性抗原保守基因,检测结果准确可靠。本次事件运用PCR方法对6份患者样本和2份可疑食品样本中分离的沙门菌可疑菌落进行invA基因快速检测,2 h便可出结果,与14 h后VITEK2全自动微生物鉴定系统鉴定结果完全一致,因此,在重大疫情或事件的病原检验中,多方法的联合应用与综合分析,获得快速可靠结果,可为患者的诊治和事件处置赢得时间。
实验室从粽子和凉拌豇豆中均检出鼠伤寒沙门菌,通过病例对照研究,粽子非高危食品(OR=0.6,95%CI为0.2~2.2)。可能在其储存过程中交叉污染所致,并不是引起本次食物中毒的原因食品。而病例发病前一天中午食用了凉拌豇豆的比例高于对照组(OR=3,95%CI为1.4~6.4),通过对该校食堂原料购制和凉拌豇豆制作过程进行调查,发现食堂使用装过生肉仅经简单冲洗的盆子进行凉拌豇豆拌制和盛装,拌制好后存放于室温直至食用。因此,可以推定导致本次食源性疾病暴发的原因是在食品在加工过程中生熟不分导致交叉污染,拌制豇豆一共用2个大盆分别盛装和拌制,在一层就餐的高中生没有患病,说明仅二层盛装凉拌菜的大盆受到污染而导致在二层进食的学生食用了被鼠伤寒沙门菌污染的凉拌豇豆而引发的食源性疾病暴发。
本文应用PFGE技术对来自同一起疫情的患者和食品中的鼠伤寒沙门菌分离株进行分子分型, 经聚类分析, 患者和食品分离株具有完全一致的PFGE 图谱,按Tenover等[8]提出的菌株同源性判断标准, 从基因组的DNA水平,提示它们为同源菌株, 结合流行病学调查,快速溯源。本起疫情分离株PFGE分子分型结果在国内首次实时在线上传国家中央数据库(TraNet China),对病例信息和实验室检验结果进行实时汇总比对分析。随着TraNet China 的进一步推广和成熟运用,将对我国食源性疾病监测、预警和控制发挥重要作用。
[2] Deng XC, Li JL, Qin ZY, et al. Investigation and analysis for an infectious diarrhea outbreak[J]. Journal of Applied Preventive Medicine, 2008, 14(2):102-103. (in Chinese) 邓星超, 李健龙, 秦忠营, 等.一起感染性腹泻暴发疫情调查分析[J].应用预防医学, 2008, 14(2):102-103.
[3] Pang HY, Tian JP, Sun B. Laboratory testing for a food poisoning caused by Salmonella typhimurium[J].Chinese Journal of Health Laboratory Technology, 2009, 19(12):2980-2981.(in Chinese) 庞惠勇, 田锦萍, 孙波.一起鼠伤寒沙门菌引起食物中毒的实验室检测[J]. 中国卫生检验杂志, 2009, 19(12):2980-2981.
[4] Xu H, Liao ZY.Investigation and laboratory analysis for a food poisoning caused by Salmonella typhimurium[J].Modern Preventive Medicine, 2010, 37(20):3944.(in Chinese) 许华, 廖周勇.一起由鼠伤寒沙门菌引起食物中毒的调查与实验室分析[J].现代预防医学2010, 37(20):3944.
[5] Shu KK. Investigation analysis for a food poisoning caused by Salmonella typhimurium[J].China Pharamceuticals, 2010, 19(12):6.(in Chinese) 舒开奎.1 起鼠伤寒沙门菌食物中毒的调查分析[J].中国药业, 2010, 19(12):6.
[6] Cao Y, Li L, Epidemiological investigation for a food poisoning caused Salmonella typhimurium[J]. Journal of Preventive Medicine Information, 2010, 26(5):413-414.(in Chinese) 曹妍, 李丽.一起鼠伤寒沙门菌引起食物中毒流行病学调查[J].预防医学情报杂志, 2010, 26(5):413-414.
[7] Ranh K, Grandis SA, Clarke RC, et al.Amplification of an invA gene sequence of Salmonella typhimurium by polymerase chain reaction as specific method of detection of Salmonella[J].Mol Cell Probes, 1992, 6(4):271-279.
[8] Tenover FC, Arbeit RD, Goering RV, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis: criteria for bacterial strain typing[J]. J ClinMicrobiol, 1995, 33(9):2233-2239.