1. Institute for Infectious Disease Control and Prevention, Henan Provincial Centers for Disease Control and Prevention, Zhengzhou 450016, Henan, China;
2. State Key Laboratory for Infectious Disease Prevention and Control, Department of Viral Encephalitis, Institute for Viral Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
Laboratory diagnosis of a human rabies case and its significance
LI Xing-le1, HUANG Xue-yong1, SUN Jian-wei1, LYU Xin-jun2
Abstract
Objective To evaluate the feasibility of laboratory diagnosis of human rabies and its significance for prevention and control of rabies. Methods Laboratory diagnosis of a human rabies cases was conducted by using reverse transcription polymerase chain reaction (RT-PCR) and rapid fluorescent focus inhibition test (RFFIT) to detect the saliva, cerebrospinal fluid (CSF), serum samples collected from the patients. Results The predicted segments of the nucleoprotein (N), RNA-dependent RNA polymerase (RdRp)/Large protein (L) genes of rabies virus were amplified from the saliva samples with RT-PCR. Sequencing and phylogenetic analysis confirmed the rabies virus infection. Rabies virus neutralizing antibody (RVNP) was detected with RFFIT in the serum sample. One close contact received rabies postexposure prophylaxis (PEP). The RVNP of the contact was positive. Conclusion A suspected human rabies case was laboratory confirmed. Laboratory test results has important significance for the treatment of rabies cases.
Keywords:
rabies
reverse transcription polymerase chain reaction
rapid fluorescent focus inhibition test
laboratory diagnosis
一例狂犬病病例的实验室诊断及其启示
李幸乐1, 黄学勇1, 孙建伟1, 吕新军2
1. 河南省疾病预防控制中心传染病预防控制所, 河南 郑州 450016;
2. 中国疾病预防控制中心病毒病预防控制所, 北京 102206
2. 中国疾病预防控制中心病毒病预防控制所, 北京 102206
收稿日期:2013-12-31
基金项目:农业公益性行业科研专项经费项目-狂犬病监测及疫情报告系统研究(No.201103032)
通讯作者:吕新军,Tel:010-58900840,Email:73xj@163.com
摘要
目的 通过1例人狂犬病病例的实验室确诊探讨人狂犬病病例实验室诊断的可行性及其对狂犬病防控的意义。方法 对存活疑似人狂犬病病例的唾液、脑脊液、血清标本采用反转录-聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)、快速荧光灶抑制试验(rapid fluorescent focus inhibition test,RFFIT)进行实验室确诊;通过RFFIT对密切接触个例血清抗狂犬病病毒中和抗体进行检测。结果 病例唾液标本用RT-PCR方法检测获得狂犬病病毒核蛋白、RNA聚合酶基因预期扩增片段,序列测定和分析进一步证实为狂犬病病毒。病例血清标本经RFFIT检测抗狂犬病病毒中和抗体阳性。1名病例密切接触者按照狂犬病暴露进行暴露后预防处置,血清抗狂犬病病毒中和抗体检测为阳性。结论 1例疑似人狂犬病病例经实验室诊断确诊为狂犬病病例,实验室检测结果对指导个案处置有现实意义。
内容大纲
-
1 材料与方法
- 1.1 个案信息及标本采集
- 1.2 病例标本的反转录-聚合酶链反应(RT-PCR)检测
- 1.3 核酸序列测定与分析
- 1.4 快速荧光灶抑制试验
- 2.1 病例标本RT-PCR检测结果
- 2.2 狂犬病病毒N蛋白基因测定序列分析
- 2.3 狂犬病病毒L蛋白基因测定序列分析
- 2.4 患者及密切接触者血清抗狂犬病病毒中和抗体检测结果
1 材料与方法
1.1 个案信息及标本采集 编号Henan-SSJ,女性,65岁,河南省许昌市人,2012年11月因发热、意识模糊入郑州大学第一附属医院感染科治疗,诊疗可排除其他原因导致的颅脑疾病,因病史有近期(2012年8月)被流浪犬咬伤记录而怀疑狂犬病,报告给河南省CDC传染病预防控制所,于患者存活期间采集1日内不同时间段唾液混合液标本1份、脑脊液标本1份、血清标本1份;患者密切接触者1人(患者儿子),在犬伤发生后以五针法方案全程接种辽宁成大速达狂犬病疫苗,全程接种疫苗后第2周采集血清标本1份;所有临床处置行为均在患者及家属知情的情况下遵照国际通行的医学伦理规则进行,标本冷藏送河南省CDC传染病预防控制所,-80 ℃冰箱保存备检。
1.2 病例标本的反转录-聚合酶链反应(RT-PCR)检测
患者唾液、脑脊液、血清标本的病毒RNA提取采用Qiagen公司(Düsseldorf, NordrheinWestfalen, German)QIAamp® Viral RNA Mini Kits病毒RNA提取试剂盒。采用Invitrogen公司(Carlsbad, California, USA)SuperScript® Ⅲ 1st Strand cDNA Synthesis Kits反转录试剂盒将病毒RNA反转录合成cDNA。聚合酶链反应(PCR)采用Promega公司(Madison, Wisconsin, USA)GoTaq® Green Master Mix试剂,分别采用针对狂犬病病毒核蛋白(Nucleoprotein, N)和依赖RNA的RNA聚合酶(RNA independent RNA Polymerase/Large protein,L)基因的特异性引物(表1)进行目的基因片段扩增[4]。
表1 病例标本PCR检测使用的引物(1)
Table 1 Primers used in PCR to detect case samples
| 目的 基因 | 引物 编号 | 引物序列(5′→3′) | 基因组 定位 |
| N蛋白 | PN1-1 | ATG TAA CAC CTC TAC AAT GG | 55~74 |
| PN1-2 | CAG TCT CYT CNG CCA TCT | 1570~1587 | |
| PN2-1 | AAG ATG TGY GCY AAY TGG AG | 644~663 | |
| PN2-2 | GCC CTG GTT CGA ACA TTC T | 881~899 | |
| L蛋白 | PL1/2-1 | ATG ACA GAC AAY YTG AAC AA | 7170~7189 |
| PL1-2 | TGA CCA TTC CAR CAR GTN G | 7489~7507 | |
| PL2-2 | GGT CTG ATC TRT CWG ARY AAT A | 7419~7440 |
扩增狂犬病病毒依赖RNA的RNA聚合酶基因时,外引物为PL1/2-1和PL1-2,内引物为PL1/2-1和PL2-2。内引物和外引物PCR反应条件均为:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火45 s,72 ℃延伸40 s,共35个循环;72 ℃延伸3 min。PCR产物长度约250 bp。扩增狂犬病病毒核蛋白基因时,外引物为PN1-1和PN1-2,内引物为PN2-1和PN2-2。外引物PCR反应条件为:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃ 延伸1 min 40 s,共35个循环;72 ℃延伸10 min。内引物PCR反应条件为:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸40 s,共35个循环;72 ℃延伸10 min。PCR产物长度约250 bp。
1.3 核酸序列测定与分析
扩增产物送北京擎科生物技术有限公司(昌平,北京,中国)。测序采用美国应用生物系统公司(Applied Biosystems)Ion ProtonTM测序仪以Sanger双脱氧链终止法进行。序列拼接采用BioEdit 5.0.6版本软件,序列排列采用Clustal X 2.1软件,系统进化分析采用Mega 4.1软件,依据软件使用说明进行操作。
1.4 快速荧光灶抑制试验
参照文献方法进行[5]。取一块96孔细胞培养板,按照预先设计的方案在相应孔内加入100 μl 10% FBS 的DMEM培养液,取待测血清和标准品、弱阳性血清、强阳性血清、阴性血清各50 μl 分别加入相应孔内,进行连续1 ∶ 3 倍比稀释,最后一孔弃去50 μl 混合液,同时设立细胞对照和CVS-11病毒对照;除细胞和病毒对照孔以外每孔加入稀释至80%细胞感染量的CVS-11毒种50 μl,37 ℃ 中和作用1 h;后每孔加入1 × 106/ml 的BSR细胞悬液50 μl,37 ℃ 5% CO2孵箱培养24 h;弃培养液,每孔加200 μl 磷酸盐缓冲液(0.01 mol/L, pH 7.2)洗1次,弃洗液;每孔加50 μl 80% 冷丙酮,4 ℃ 固定30 min;弃丙酮,室温干燥5 min;每孔加50 μl 以磷酸盐缓冲液(0.01 mol/L, pH 7.2)1 ∶ 60稀释的荧光标记抗狂犬病病毒核蛋白抗体LIGHT DIAGNOSTICSTM Rabies DFA 5100 Reagent (Millipore, Billerica, Massachusetts, USA)(含0.1%的1% EVAN's Blue),37 ℃湿盒孵育30 min;弃荧光标记抗狂犬病病毒核蛋白抗体,每孔加200 μl磷酸盐缓冲液(0.01 mol/L, pH 7.2)连续洗3次;每孔加50 μl 80%甘油,铺满孔底;倒置荧光显微镜下观察,在记录表中详细记录各样品50%分界点前后孔内荧光染色细胞百分比,代入计算公式内求取各样品中和抗体效价值,单位为IU/ml。中和抗体效价值≥0.5 IU/ml视为阳性[4]。
2 结果
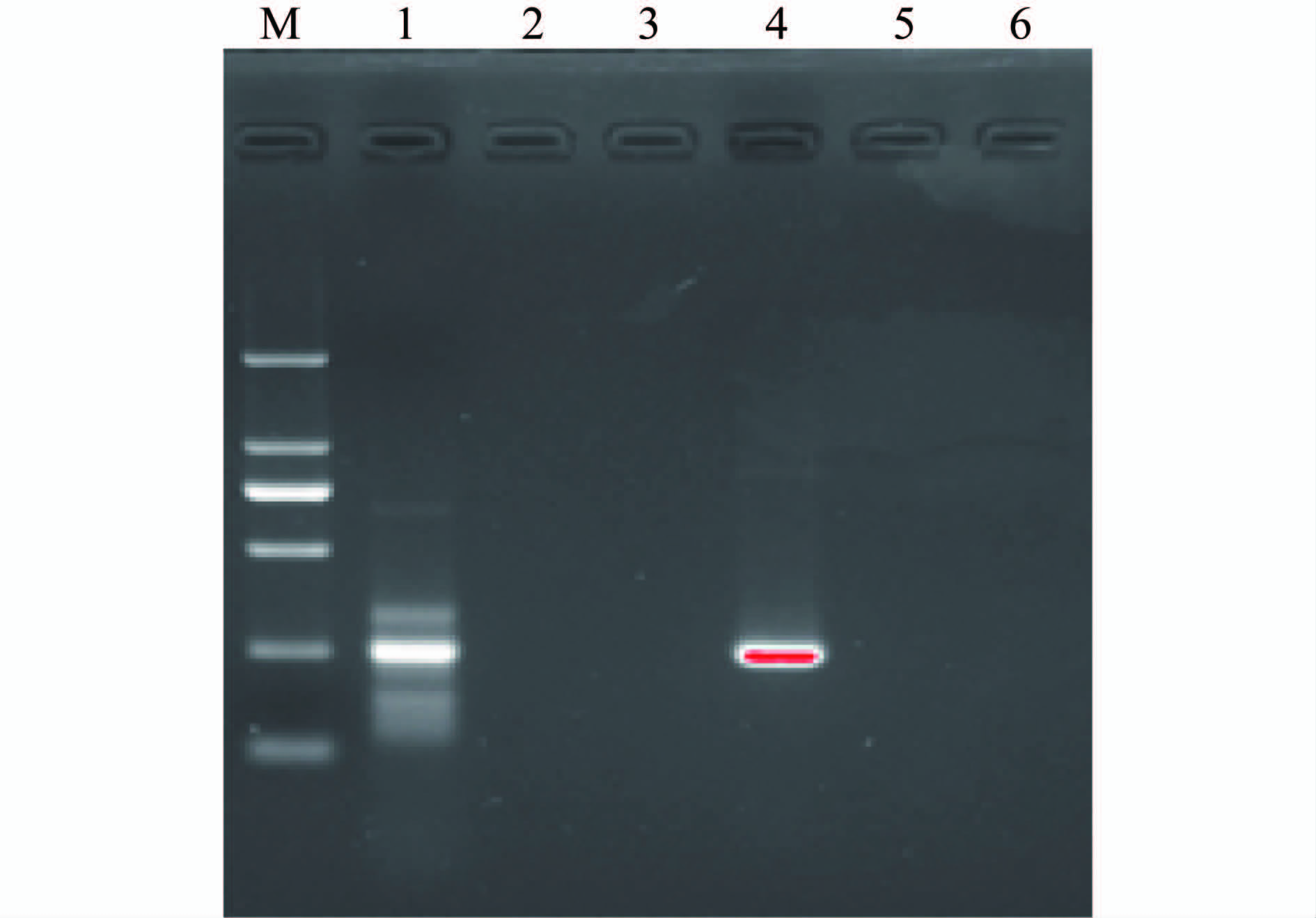
2.1 病例标本RT-PCR检测结果 从患者唾液、脑脊液、血清标本中分别提取病毒RNA,经反转录合成cDNA,采用针对狂犬病病毒L、N蛋白基因的序列特异性引物进行PCR扩增,1%琼脂糖凝胶电泳检测扩增产物。L蛋白基因PL1/2-1和PL2-2引物扩增产物长度约250 bp,N蛋白基因PN2-1和PN2-2引物扩增产物长度约250 bp(图1)。扩增产物采用特异性下游引物进行核酸序列测定,对所得序列进行系统进化分析。
图1 病例标本RT-PCR检测结果
Figure 1 Results of RT-PCR to detect case samples 注:M. DL2000 Marker; 1. 唾液PN2-1和PN2-2引物扩增产物; 2. 脑脊液PN2-1和PN2-2引物扩增产物; 3. 血清PN2-1和PN2-2引物扩增产物; 4. 唾液PL1/2-1和PL2-2引物扩增产物; 5.脑脊液PL1/2-1和PL2-2引物扩增产物; 6. 血清PL1/2-1和PL2-2引物扩增产物。
2.2 狂犬病病毒N蛋白基因测定序列分析
病例唾液标本RT-PCR产物经核酸序列测定获得的狂犬病病毒N蛋白基因核酸序列经NCBI网站BLAST比对,与中国国内狂犬病病毒株N蛋白基因同源区段核酸序列同源性为96%~98%,证实病例是被国内流行的狂犬病病毒感染。由于针对狂犬病病毒N蛋白基因的核酸序列系统进化分析众多且结果雷同,本研究不再采用测序所得狂犬病病毒N蛋白基因核酸序列进行系统进化分析,转而采用近年来受到关注的狂犬病病毒L蛋白基因核酸序列进行系统进化分析。
2.3 狂犬病病毒L蛋白基因测定序列分析
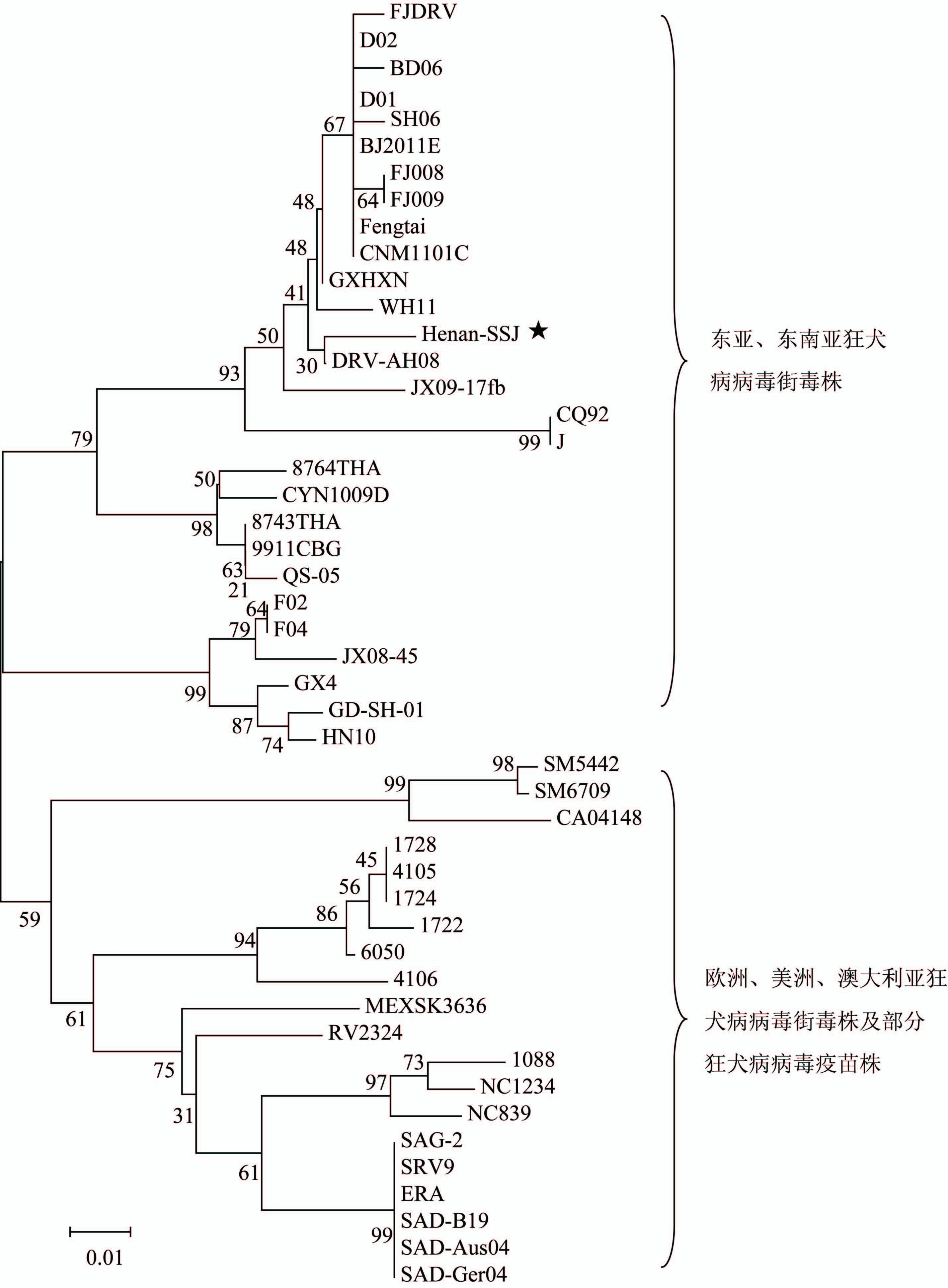
病例唾液标本RT-PCR产物经核酸序列测定获得的狂犬病病毒L蛋白基因核酸序列经NCBI网站BLAST比对,与世界范围内狂犬病病毒株L蛋白基因同源区段核酸序列同源性为86%~97%,由NCBI网站下载代表性狂犬病病毒L蛋白基因同源区段核酸序列和病例感染狂犬病病毒L蛋白基因核酸序列共同进行系统进化分析[6],绘制系统进化树,结果显示:来自东亚、东南亚地区、泰国、孟加拉国的狂犬病病毒株共同位于一个大的进化分支,来自中国的狂犬病病毒株除CYN1009D与来自泰国、孟加拉国的狂犬病病毒株形成一个单独的进化分支,其余来自中国的狂犬病病毒株分别形成2个单独的进化分支,病例感染狂犬病病毒与来自北京、上海、重庆、内蒙古、宁夏、安徽、湖北、江西、福建的狂犬病病毒共同位于一个进化分支内;而来自欧洲、美洲、澳大利亚的狂犬病病毒株共同位于另外一个大的进化分支(图2)。L蛋白基因同源区段的系统进化分析直观地揭示了狂犬病病毒株的地域分布差异。
2.4 患者及密切接触者血清抗狂犬病病毒中和抗体检测结果
患者与密切接触者(儿子)均采用RFFIT进行了抗狂犬病病毒中和抗体检测(表2)。患者被犬咬伤后未进行狂犬病暴露后预防处置,检测结果显示血清内抗狂犬病病毒中和抗体效价0.68 IU/ml(≥0.5 IU/ml),为阳性;患者儿子被同一只犬咬伤,但是进行了狂犬病暴露后预防处置,检测结果显示血清内抗狂犬病病毒中和抗体效价2.29 IU/ml(≥0.5 IU/ml),为阳性,持续观察至今身体健康。
表2 病例和密切接触者血清抗狂犬病病毒中和抗体检测结果
Table 2 Result of RVNP detection in serum samples
| 序号 | 人员 编号 | 既往 犬伤史 | 狂犬疫苗 接种史 | 检测结果 (IU/ml) |
| 1 | SSJ(1) | 是 | 无 | 0.68 |
| 2 | LPQ(1) | 是 | 有 | 2.29 |
图2 狂犬病病毒株L蛋白基因系统进化分析
Figure 2 Phylogenetic analysis of Large protein genes of rabies viruses
3 讨论
同欧美发达国家相比,国内人的狂犬病病例基本依赖临床诊断,这种状况往往被归咎于人文、传统、宗教、伦理等因素,而对狂犬病实验室诊断的现实意义认识不足这个因素一直被忽略了[4]。狂犬病患者唾液标本一直被视为病毒核酸检测的最佳样品,本案例中对病例唾液、脑脊液、血清标本的核酸检测只有唾液标本呈阳性,这种情况在实际工作中最常见[4]。病例感染狂 犬病病毒基因序列分析显示该狂犬病病毒株是国内固有流行株,提示当地犬的管理和免疫工作仍然需要强化[7]。病例是在临床诊疗并依据犬伤史怀疑为狂犬病之后进行的实验室诊断,血清RVNP检测阳性提示病例已经进入狂犬病中晚期,提示临床诊断很难做到病例的早期发现,在临床经验不足的情况下也容易出现误诊和漏诊 。
1名密切接触者在病例确诊后进行了必要的狂犬病暴露后预防处置,RVNP检测为阳性,提示狂犬病暴露后预防处置效果确切。通常情况下,由于抗原量的差异,狂犬疫苗接种诱导机体产生的RVNA水平较高,狂犬病患者中晚期病毒突破血脑屏障进入外周血刺激机体产生的RVNA水平较低,本案例中情况与此相符合[10]。本案例显示加强省级疾病预防控制机构狂犬病实验室检测能力不仅有助于提高狂犬病病例诊断的准确率,而且有助于提高狂犬病暴露后预防处置效率[11]。
本研究患者和患者儿子被同一只流浪犬咬伤,且该流浪犬未被捕获,可能继续伤害其他人,潜在危害较大。在狂犬病防治实践中,此类情况也较多见。因此,从根本上讲,只有将犬的管理和免疫工作做好才能有效防止人因犬伤而发生狂犬病。国际公认区域内犬接受兽用狂犬病疫苗免疫率超过70%就可以形成免疫屏障,防止人间狂犬病疫情的持续流行[12]。犬接受兽用狂犬病疫苗免疫率低被认为是国内人间狂犬病疫情持续流行的首要原因[13]。中国是发展中国家,区域发展不平衡,在犬的管理和免疫方面区域差异显著。北京、上海、广州、深圳等经济发达城市犬的管理和免疫工作贯彻较好,人间狂犬病疫情得到了较好的控制[12]。然而,国内多数地区,尤其是经济和社会发展水平一般的地区,在犬的管理和免疫方面存在不同程度的缺陷[14],类似本文案例的情况时有发生。规范的犬类管理措施目的是实现犬的身份管理,减少无主犬和流浪犬的数量,从而有助于提高犬接受兽用狂犬病疫苗的免疫率[15]。在犬类管理制度的完善、硬件设备的提升、广大养犬人意识的提高方面,国内和欧美发达国家存在较大差距,学习欧美发达国家成功经验,提升现有犬管理体系效率对国内狂犬病预防控制具有现实意义[16]。
在人间狂犬病暴露后预防处置方面,国内制订了完备的《狂犬病暴露后预防处置规范》[17],近年来国内狂犬病免疫制剂生产技术进步显著,国内企业生产的狂犬病免疫制剂已经获得国际认可[18]。然而,在实际操作中,被犬咬伤的病例有时会因为狂犬病免疫制剂价格较昂贵而放弃接受狂犬病暴露后预防处置,这种情况在家庭经济状况较差的个例中发生的可能性更大[19]。本案例中患者本人因为经济因素没有接受狂犬病暴露后预防处置,而让儿子接受了狂犬病暴露后预防处置,最终患者因狂犬病而死亡,患者儿子则免于发病,健康存活至今。这种情况的发生提示采取必要的措施使得应该得到狂犬病暴露后预防处置的个体不必因为经济因素而丧失宝贵的机会是必要的[20]。目前,国内部分经济较发达省市已经逐步将狂犬病暴露后预防处置纳入医疗保险范畴,极大地促进了狂犬病暴露后预防处置工作的有效实施。借鉴国内外的狂犬病防控经验,在提升犬的管理和免疫工作水平的同时,政府管理部门在经济发展许可的情况下,尽快将狂犬病暴露后预防处置纳入医疗保险处理的范畴,使得犬伤者可以在无负担或轻负担的情况下接受相应的医疗处治,同样有助于狂犬病防控目标的最终实现[21]。
参考文献
[1] Jiao W, Li H, Tao X, et al. Investigation and analysis of rabies viral infection and distribution in China in 2005-2012[J]. Virol Sin, 2013, 28(3):183-185.
[2] Zhang L. Building a better infectious disease surveillance system for China: An evaluation from a political perspective[M]. Berlin: VDM Verlag, 2009.
[3] Banyard AC, Horton DL, Freuling C, et al. Control and prevention of canine rabies: the need for building laboratory-based surveillance capacity[J]. Antiviral Res, 2013, 98 (3):357-364.
[4] Dacheux L, Wacharapluesadee S, Hemachudha T, et al. More accurate insight into the incidence of human rabies in developing countries through validated laboratory techniques[J]. PLoS Negl Trop Dis, 2010, 4(11):e765.
[5] Yu PC, Lyu XJ, Shen XX, et al. The establishment of a rapid fluorescent focus inhibition test for testing rabies virus neutralizing antibody[J]. Chinese Journal of Epidemiology, 2010, 31(4):438-441.(in Chinese) 于鹏程, 吕新军, 申辛欣, 等. 狂犬病毒中和抗体检测快速荧光灶抑制试验的建立[J]. 中华流行病学杂志, 2010, 31(4):438-441.
[6] Ming P, Yan J, Rayner S, et al. A history estimate and evolutionary analysis of rabies virus variants in China[J]. J Gen Virol, 2010, 91(Pt 3):759-764.
[7] Zhao J, Liu Y, Zhang S, et al. Analysis of an outbreak of human rabies in 2009 in Hanzhong district, Shaanxi province, China[J]. Vector Borne Zoonotic Dis, 2011, 11(1):59-68.
[8] Udow SJ, Marrie RA, Jackson AC. Clinical features of dog-and bat-acquired rabies in humans[J]. Clin Infect Dis, 2013, 57 (5):689-696.
[9] Wong TW, Chan PK, Fung KP. Human rabies in Hong Kong: a case review[J]. Ann Acad Med Singapore, 1987, 16(4):663-665.
[10] Johnson N, Cunningham AF, Fooks AR. The immune response to rabies virus infection and vaccination[J]. Vaccine, 2010, 28 (23):3896-3901.
[11] Si H, Guo ZM, Hao YT, et al. Rabies trend in China (1990-2007) and post-exposure prophylaxis in the Guangdong province[J]. BMC Infect Dis, 2008, 8:113.
[12] Hidano A, Hayama Y, Tsutsui T. Prevalence of immunity presumed using rabies vaccination history and household factors associated with vaccination status among domestic dogs in Japan[J]. Jpn J Infect Dis, 2012, 65(5):396-402.
[13] Hu RL, Fooks AR, Zhang SF, et al. Inferior rabies vaccine quality and low immunization coverage in dogs (Canis familiaris) in China[J]. Epidemiol Infect, 2008, 136(11):1556-1563.
[14] Wang C, Wang Y, Du X, et al. Rabies immunization status of dogs, Beijing, China[J]. Emerg Infect Dis, 2011, 17 (6):1129-1130.
[15] Larghi OP. Perspectives for rabies control and eradication from domestic species in developing countries[J]. Dev Biol (Basel), 2004, 119:205-212.
[16] Dodet B, Goswami A, Gunasekera A, et al. Rabies awareness in eight Asian countries[J]. Vaccine, 2008, 26(50):6344-6348.
[17] Ministry of Health of the People's Republic of China. Notice: The Ministry of Health issued on the Standard of rabies postexposure prophylaxis (2009 Edition).[EB/OL](2014-03-10).http://www. moh. gov.cn/mohbgt/s10695/200912/45090.shtml. 中华人民共和国卫生部. 卫生部关于印发《狂犬病暴露预防处置工作规范(2009年版)》的通知[S][EB/OL].(2014-03-10).http://www.moh.gov.cn/mohbgt/s10695/200912/45090.shtml.
[18] Liu H, Huang G, Tang Q, et al. The immunogenicity and safety of vaccination with purified Vero cell rabies vaccine (PVRV) in China under a 2-1-1 regimen[J]. Hum Vaccin, 2011, 7(2):220-224.
[19] Fang LX, Ping F, Ping DY, et al. Socioeconomic status is a critical risk factor for human rabies post-exposure prophylaxis[J]. Vaccine, 2010, 28(42):6847-6851.
[20] Shantavasinkul P, Wilde H. Postexposure prophylaxis for rabies in resource-limited/poor countries[J]. Adv Virus Res, 2011, 79:291-307.
[21] Aikimbayev A, Briggs D, Coltan G, et al. Fighting rabies in Eastern Europe, the Middle East and Central Asia-experts call for a regional initiative for Rabies Elimination[J]. Zoonoses Public Health, 2013. doi: 10.1111/zph.12060.
[2] Zhang L. Building a better infectious disease surveillance system for China: An evaluation from a political perspective[M]. Berlin: VDM Verlag, 2009.
[3] Banyard AC, Horton DL, Freuling C, et al. Control and prevention of canine rabies: the need for building laboratory-based surveillance capacity[J]. Antiviral Res, 2013, 98 (3):357-364.
[4] Dacheux L, Wacharapluesadee S, Hemachudha T, et al. More accurate insight into the incidence of human rabies in developing countries through validated laboratory techniques[J]. PLoS Negl Trop Dis, 2010, 4(11):e765.
[5] Yu PC, Lyu XJ, Shen XX, et al. The establishment of a rapid fluorescent focus inhibition test for testing rabies virus neutralizing antibody[J]. Chinese Journal of Epidemiology, 2010, 31(4):438-441.(in Chinese) 于鹏程, 吕新军, 申辛欣, 等. 狂犬病毒中和抗体检测快速荧光灶抑制试验的建立[J]. 中华流行病学杂志, 2010, 31(4):438-441.
[6] Ming P, Yan J, Rayner S, et al. A history estimate and evolutionary analysis of rabies virus variants in China[J]. J Gen Virol, 2010, 91(Pt 3):759-764.
[7] Zhao J, Liu Y, Zhang S, et al. Analysis of an outbreak of human rabies in 2009 in Hanzhong district, Shaanxi province, China[J]. Vector Borne Zoonotic Dis, 2011, 11(1):59-68.
[8] Udow SJ, Marrie RA, Jackson AC. Clinical features of dog-and bat-acquired rabies in humans[J]. Clin Infect Dis, 2013, 57 (5):689-696.
[9] Wong TW, Chan PK, Fung KP. Human rabies in Hong Kong: a case review[J]. Ann Acad Med Singapore, 1987, 16(4):663-665.
[10] Johnson N, Cunningham AF, Fooks AR. The immune response to rabies virus infection and vaccination[J]. Vaccine, 2010, 28 (23):3896-3901.
[11] Si H, Guo ZM, Hao YT, et al. Rabies trend in China (1990-2007) and post-exposure prophylaxis in the Guangdong province[J]. BMC Infect Dis, 2008, 8:113.
[12] Hidano A, Hayama Y, Tsutsui T. Prevalence of immunity presumed using rabies vaccination history and household factors associated with vaccination status among domestic dogs in Japan[J]. Jpn J Infect Dis, 2012, 65(5):396-402.
[13] Hu RL, Fooks AR, Zhang SF, et al. Inferior rabies vaccine quality and low immunization coverage in dogs (Canis familiaris) in China[J]. Epidemiol Infect, 2008, 136(11):1556-1563.
[14] Wang C, Wang Y, Du X, et al. Rabies immunization status of dogs, Beijing, China[J]. Emerg Infect Dis, 2011, 17 (6):1129-1130.
[15] Larghi OP. Perspectives for rabies control and eradication from domestic species in developing countries[J]. Dev Biol (Basel), 2004, 119:205-212.
[16] Dodet B, Goswami A, Gunasekera A, et al. Rabies awareness in eight Asian countries[J]. Vaccine, 2008, 26(50):6344-6348.
[17] Ministry of Health of the People's Republic of China. Notice: The Ministry of Health issued on the Standard of rabies postexposure prophylaxis (2009 Edition).[EB/OL](2014-03-10).http://www. moh. gov.cn/mohbgt/s10695/200912/45090.shtml. 中华人民共和国卫生部. 卫生部关于印发《狂犬病暴露预防处置工作规范(2009年版)》的通知[S][EB/OL].(2014-03-10).http://www.moh.gov.cn/mohbgt/s10695/200912/45090.shtml.
[18] Liu H, Huang G, Tang Q, et al. The immunogenicity and safety of vaccination with purified Vero cell rabies vaccine (PVRV) in China under a 2-1-1 regimen[J]. Hum Vaccin, 2011, 7(2):220-224.
[19] Fang LX, Ping F, Ping DY, et al. Socioeconomic status is a critical risk factor for human rabies post-exposure prophylaxis[J]. Vaccine, 2010, 28(42):6847-6851.
[20] Shantavasinkul P, Wilde H. Postexposure prophylaxis for rabies in resource-limited/poor countries[J]. Adv Virus Res, 2011, 79:291-307.
[21] Aikimbayev A, Briggs D, Coltan G, et al. Fighting rabies in Eastern Europe, the Middle East and Central Asia-experts call for a regional initiative for Rabies Elimination[J]. Zoonoses Public Health, 2013. doi: 10.1111/zph.12060.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 李幸乐 | |
| 黄学勇 | |
| 孙建伟 | |
| 吕新军 | |
| PubMed | |
| Article by LI Xing-le | |
| Article by HUANG Xue-yong | |
| Article by SUN Jian-wei | |
| Article by LYU Xin-jun | |