1. State Key Laboratory for Communicable Disease Prevention and Control, Institute for Communicable Disease Prevention and Control, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
2. Department of Microbiology, Guiyang Medical University, Guiyang 550004, Guizhou, China
Novel multiplex real-time TaqMan PCR assay for detection of Listeria monocytogenes and Listeria ivanovii in simulated fecal samples
XU Hua-qing1,2, WANG Yan1, WANG Yi1, DAI Hang1, WANG He2, YE Chang-yun1
Abstract
Objective To establish a novel multiplex real-time fluorescent TaqMan PCR assay for the rapid detection of Listeria monocytogenes and Listeria ivanovii in simulated feces samples. Methods One pair of primers and TaqMan probes were respectively designed on hly gene in L. monocytogenes and smcL gene in L.ivanovii. Standard curve was produced. A real-time PCR assay to detect fecal samples containing L. monocytogenes and L. ivanovii was established. The specificity of the primers and probes was tested by using other Listeria spieces strains and other entero-pathogenic bacteria. With two enrichment steps, DNA from fecal samples contaminated artificially with different concentrations of L. monocytogenes and L. ivanovii were examined by using real-time PCR and traditional detection tests. Results Positive results were detected in the samples containing L. monocytogenes and L. ivanovii, but negative in the samples of other bacteria. The lowest detection limits of this assay were 2.45×103 cfu/g for fecal sample with L.monocytogenes, and 2.92×103 cfu/g for fecal sample with L. ivanovii. The whole process can be finished within 3 hours for fecal samples. Positive results were obtained in the samples with 6 cfu/g of L. monocytogenes and 5 cfu/g of L. ivanovii by using real-time PCR assay after sample enrichment. Conclusion The novel multiplex real-time TaqMan PCR for the detection of L. monocytogenes and L. ivanovii in simulated fecal samples showed high specificity and simplicity, and this simple and reliable assay can be used in the rapid detection of clinical samples to facilitate the survey of carriage or infection status of L. monocytogenes and L. ivanovii in population in China.
模拟粪便标本单增李斯特菌和伊氏李斯特菌TaqMan双重实时荧光定量-聚合酶链反应检测方法
许华青1,2, 王艳1, 王毅1, 代航1, 王和2, 叶长芸1
1. 中国疾病预防控制中心传染病预防控制所, 传染病预防控制国家重点实验室, 北京 102206;
2. 贵阳医学院微生物学教研室, 贵州 贵阳 550004
2. 贵阳医学院微生物学教研室, 贵州 贵阳 550004
收稿日期:2013-11-14
基金项目:国家科技重大传染病防治专项(No.2011ZX10004-001,2013ZX10004-101)
通讯作者:叶长芸,Tel:010-58900747,Email:yechangyun@icdc.cn
摘要
目的 建立一种TaqMan双重实时荧光定量-聚合酶链反应(real-time PCR),用于模拟粪便标本中单增李斯特菌和伊氏李斯特菌的快速检测。方法 以单增李斯特菌特异基因hly和伊氏李斯特菌特异基因smcL作为靶基因,合成2对引物和其相应的荧光探针,制作标准曲线,建立从模拟粪便标本中直接检测单增李斯特菌和伊氏李斯特菌的TaqMan 双重real-time PCR。利用李斯特菌属中其他种李斯特菌及常见致病菌验证引物、探针的特异性;通过制备模拟粪便标本并对其进行二次增菌后,分别提取DNA,采用TaqMan双重real-time PCR进行检测,以达到快速检测单增李斯特菌和伊氏李斯特菌的目的。结果 采用本研究建立的TaqMan双重real-time PCR对模拟粪便标本的检测结果显示特异性良好,与其他种李斯特菌和其他病原菌均无交叉反应。模拟粪便标本中单增李斯特菌和伊氏李斯特菌的检测下限分别为2.45×103 cfu/g和 2.92×103 cfu/g;模拟粪便标本在3 h内可得出检测结果,当模拟粪便标本中单增李斯特菌含量为6 cfu/g和伊氏李斯特菌含量为5 cfu/g时,经过增菌后使用双重real-time PCR可检测出阳性结果。结论 本研究建立了以单增李斯特菌的特异基因hly和伊氏李斯特菌的特异基因smcL为靶基因的TaqMan双重real-time PCR检测方法,该方法具有特异性好、敏感性高、快速易操作等优点,可用于临床、食品及环境标本的快速诊断,以及我国人群中单增李斯特菌和伊氏李斯特菌的携带或感染状况的调查分析。
内容大纲
-
1 材料与方法
- 1.1 主要仪器设备与试剂
- 1.2 菌株
- 1.3 引物与TaqMan探针设计
- 1.4 反应体系及反应参数
- 1.5 质粒的构建及提取
- 1.6 质粒拷贝数的计算
- 1.7 标准曲线的制备
- 1.8 特异性评价
- 1.9 粪便模拟标本制备及单增李斯特菌和伊氏李斯特菌的检测
- 1.10 模拟粪便标本增菌后单增李斯特菌和伊氏李斯特菌的检测
- 1.10.1 培养液
- 1.10.2 用于增菌的模拟粪便标本的制备
- 1.10.3 增菌培养后单增李斯特菌和伊氏李斯特菌的TaqMan双重real-time PCR检测
- 2.1 标准曲线的制备
- 2.2 引物及探针特异性检测
- 2.3 粪便模拟标本中单增李斯特菌和伊氏李斯特菌的直接检测结果
- 2.4 模拟粪便标本增菌后单增李斯特菌和伊氏李斯特菌real-time PCR检测结果
李斯特菌的传统诊断方法包括细菌分离、生化鉴定、溶血实验(Christie, Atkins, Munch-Petersen test, CAMP)和血清分型等,费时费力,且结果受主观影响较大 。随着分子生物学技术的发展,越来越多分子诊断和分型的方法应用于食品和临床微生物学诊断[14]。国内外有关于单增李斯特菌和伊氏李斯特菌的单重实时荧光定量-聚合酶链反应(real-time fluorescence quantitative-polymerase chain reaction,FQ-PCR)检测技术的研究报道 ,但目前国内还没有从粪便标本中同时检测单增李斯特菌与伊氏李斯特菌的方法,本研究的目的在于建立一种TaqMan双重real-time PCR方法,能同时区分单增李斯特菌与伊氏李斯特菌这两种对人类致病的李斯特菌,可用于临床李斯特菌病的早期快速诊断,对李斯特菌病的预防及控制提供参考依据,同时为了解我国人群中单增李斯特菌和伊氏李斯特菌感染状况提供技术支持。
1 材料与方法
1.1 主要仪器设备与试剂 Rotor-Gene Q荧光定量PCR仪及Rotor-Gene Q Software VIRTUAL MODE-Two step,核酸浓度测定仪NanoDrop-1000 Spectrophotometer,QIAamp DNA Stool Mini Kit9 (QIAGEN),小量质粒提取试剂、核酸纯化试剂盒、pMD18-T Vector、 JM109感受态细胞、real-time PCR 反应试剂Premix Ex TaqTM,均购自大连宝生物工程有限公司,DNA基因组提取试剂盒购自康为世纪生物科技有限公司。
1.2 菌株
实验用单增李斯特菌参考菌株ATCC54003,伊氏李斯特菌参考菌株ATCC BAA678,其他种李斯特菌属的菌株(西尔李斯特菌、威氏李斯特菌、英诺克李斯特菌、格氏李斯特菌各1株)为本实验室鉴定并保存。其他肠道致病菌核酸由中国疾病预防控制中心(CDC)传染病预防控制所相关实验室提供,包括副溶血弧菌、霍乱弧菌、志贺菌、O157 ∶ H7大肠埃希菌、小肠结肠炎耶尔森菌、甲型副伤寒、伤寒沙门菌、变形杆菌、牛链球菌、猪链球菌、粪链球菌各1株。
1.3 引物与TaqMan探针设计
针对单增李斯特菌引物探针来自文献[15]、伊氏李斯特菌的特异引物及探针设计:Primer Express3.0设计引物和TaqMan探针,在GenBank(http://blast.ncbi.nlm.nih.gov/Blast.cgi)上进行回检。得到特异性引物及探针序列,见表1。
表1 引物及探针
Table 1 Primers and probes
| 细菌种类 | 引物名称 | 引物序列(5′~3′) |
| 单增李斯特菌 | hlyQF | CAT GGC ACC ACC AGC ATC T |
| hlyQR | ATC CGC GTG TTT CTT TTC GA | |
| Taqman探针 | FAM-CGC CTG CAA GTC CTA AGA CGC CA-BHQ | |
| 伊氏李斯特菌 | smcLF | TGT TGG TTT TTT CGA CAA TAG G |
| smcLR | ACC CGT AAT TGG GAG TAA ACA T | |
| Taqman探针 | HEX-CAG CCA CTC CAC CAT CTT CCA AAG CA-BHQ |
1.4 反应体系及反应参数
real-time PCR反应体系如下:Premix(Takara)Ex taqTM(2×)10 μl,单增李斯特菌的上下游引物各400 nmol/L,探针200 nmol/L;伊氏李斯特菌上下游引物各400 nmol/L,探针200 nmol/L;在制作标准曲线时,单增李斯特菌浓度范围为3.94×108~3.94×102拷贝/ml、伊氏李斯特菌浓度范围为7.27×108~7.27×102拷贝/ml,将二者以2 ∶ 1配比混合后作为模板进行TaqMan双重real-time PCR检测,相同稀释度的单增李斯特菌质粒DNA 2 μl、伊氏李斯特菌质粒DNA 1 μl混合加入后取1 μl作为模板,补充去离子水至 20 μl;模拟粪便标本DNA模板 1 μl,补充去离子水至 20 μl;模拟粪便标本检测时DNA模板1 μl,补充去离子水至 20 μl,反应条件采用两步法PCR扩增标准程序:95 ℃ 10 s;95 ℃ 5 s,60 ℃ 20 s,40个循环。
1.5 质粒的构建及提取
参照文献方法[15],提取伊氏李斯特菌目的基因的质粒,-20 ℃保存;单增李斯特菌特异片段质粒由本实验室构建[15],伊氏李斯特菌特异片段质粒的构建:①以smcLF和smcLR为引物,伊氏李斯特菌参考菌株BAA678的DNA为模板,扩增目的基因,电泳检测产物片段;②切胶回收,纯化PCR产物;③连接到T载体;④将已连接外源片段的质粒载体导入JM109感受态细胞;⑤筛选阳性克隆子,用PCR进行验证,并对扩增产物进行测序验证克隆片段正确性;⑥提取质粒,-20 ℃保存,含有重组子的阳性菌-70 ℃保存。
1.6 质粒拷贝数的计算
用NanoDrop-1000 Spectrophotometer 测定含有单增李斯特菌和伊氏李斯特菌目的基因的质粒浓度分别为119 ng/μl和 245.8 ng/μl,根据质粒的分子质量将质粒样品浓度换算为拷贝数:拷贝数(拷贝/ml)=(质量/分子质量)×6.02×1023, 含单增李斯特菌目的基因的质粒分子质量为660×(2692+64)=1 818 960,含伊氏李斯特菌特异基因的质粒分子质量为660×(2692+123)=2 036 100,其中660是每个碱基的平均分子量,2692为T载体的碱基数。通过计算得出含单增李斯特菌特异基因的质粒拷贝数为3.94×1013拷贝/ml,含伊氏李斯特菌质粒拷贝数为7.27×1013拷贝/ml。
1.7 标准曲线的制备
将含单增李斯特菌与伊氏李斯特菌特异基因的质粒提取物进行10×倍比稀释后,使浓度分别达到3.94×108~3.94×102拷贝/ml,7.27×108~7.27×102拷贝/ml,将二者以2 ∶ 1配比混合后作为模板进行TaqMan双重real-time PCR检测,同时做3个平行样品。
1.8 特异性评价
将李斯特菌其他种属或阳性对照的DNA模板进行双重real-time PCR检测,以验证引物及探针的特异性。
1.9 粪便模拟标本制备及单增李斯特菌和伊氏李斯特菌的检测
①粪便模拟标本的制备[16]:分别挑取单增李斯特菌和伊氏李斯特菌单菌落、接种至脑心液体培养基,37 ℃恒温摇床过夜培养后,分别吸取50 μl单增李斯特菌原液,100 μl伊氏李斯特菌原液加入至2管5 ml新鲜液体脑心培养基中,37 ℃恒温摇床培养至A600值达0.6,分别取单增李斯特菌和伊氏李斯特菌悬液1 ml,10倍比稀释至浓度为 10-3~10-8的菌液。再分别称取7管健康人粪便(约0.2 g/管),其中一管加250 μl磷酸盐缓冲液(PBS)作为空白对照,其他管中分别加入10-3~10-8单增李斯特菌10×倍比稀释菌液100 μl和伊氏李斯特菌10×倍比稀释菌液150 μl;同时采用平板计数法,对各管中所加入的细菌进行计数,粪便中的菌浓度以cfu/g表示。②粪便中李斯特菌DNA的提取:按照QIAamp DNA Stool Mini Kit操作提取。③TaqMan双重real-time PCR检测,同时做3个平行样品。
1.10 模拟粪便标本增菌后单增李斯特菌和伊氏李斯特菌的检测
1.10.1 培养液
一步和二步增菌培养液为Fraser肉汤与相应的Half Fraser添加剂以及Fraser添加剂(OXOID)制备而成。
1.10.2 用于增菌的模拟粪便标本的制备
按1.9方法将单增李斯特菌和伊氏李斯特菌原液10×倍比稀释至浓度为10-4~10-8菌液,菌液的浓度通过琼脂平板法测定。另取健康人的粪便分装约1 g/管,重复1次,其中1管加入200 μl无菌PBS作为空白对照(共11管),其余1 ∶ 1加入10-4~10-8倍比稀释的单增李斯特菌和伊氏李斯特菌液 (每1管内有相同稀释浓度的单增李斯特菌和伊氏李斯特菌),每个浓度加2管作为平行样,粪便中的菌浓度以cfu/g为单位。
1.10.3 增菌培养后单增李斯特菌和伊氏李斯特菌的TaqMan双重real-time PCR检测[17]
用无菌棉签多点沾取模拟标本,放入5 ml Half-fraser增菌液中,30 ℃,220 r/min恒温摇床培养24 h;取1 ml培养物提取DNA,利用单增李斯特菌和伊氏李斯特菌双重real-time PCR方法进行检测;另取一步增菌液中的500 μl 培养物接种至5 ml Fraser 增菌液中,进行二步增菌,与一步增菌相同条件,培养24 h;然后取1 ml 培养物提取DNA,用TaqMan双重real-time PCR方法进行检测。
2 结果
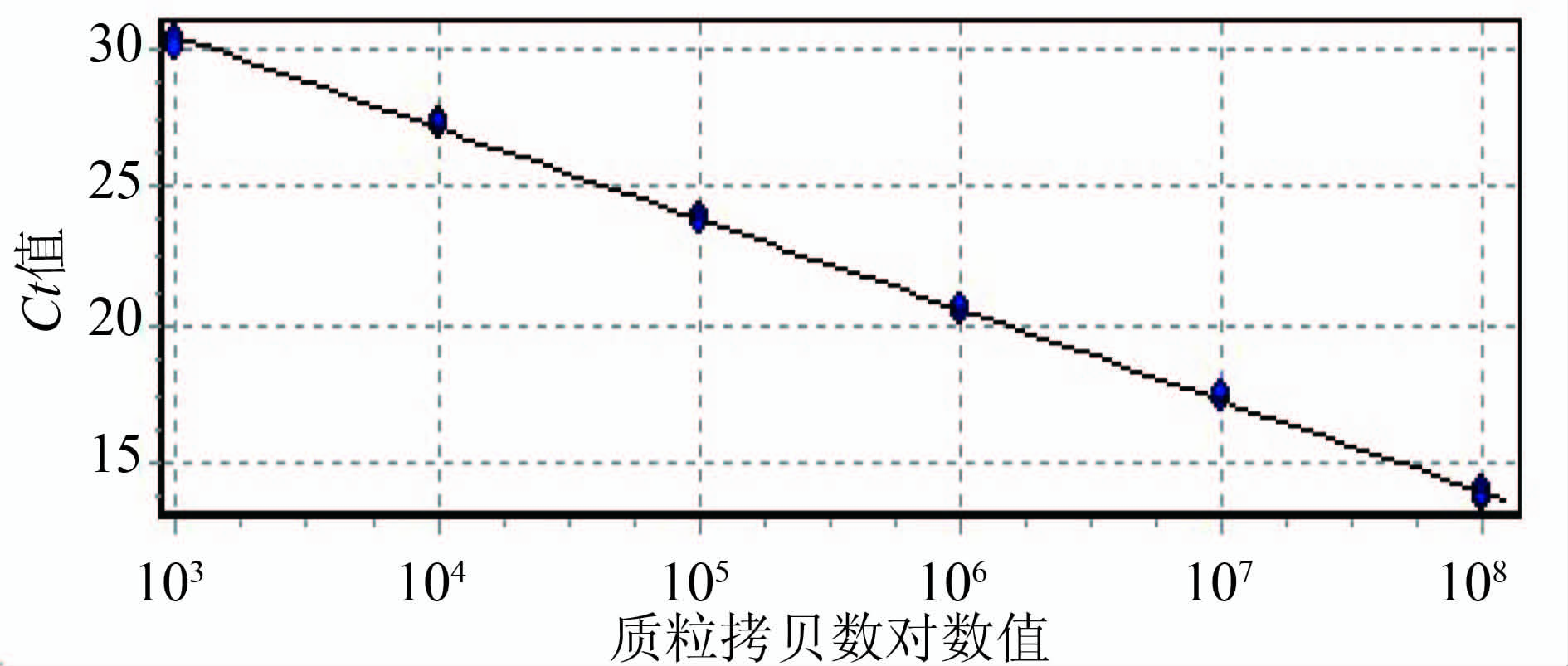
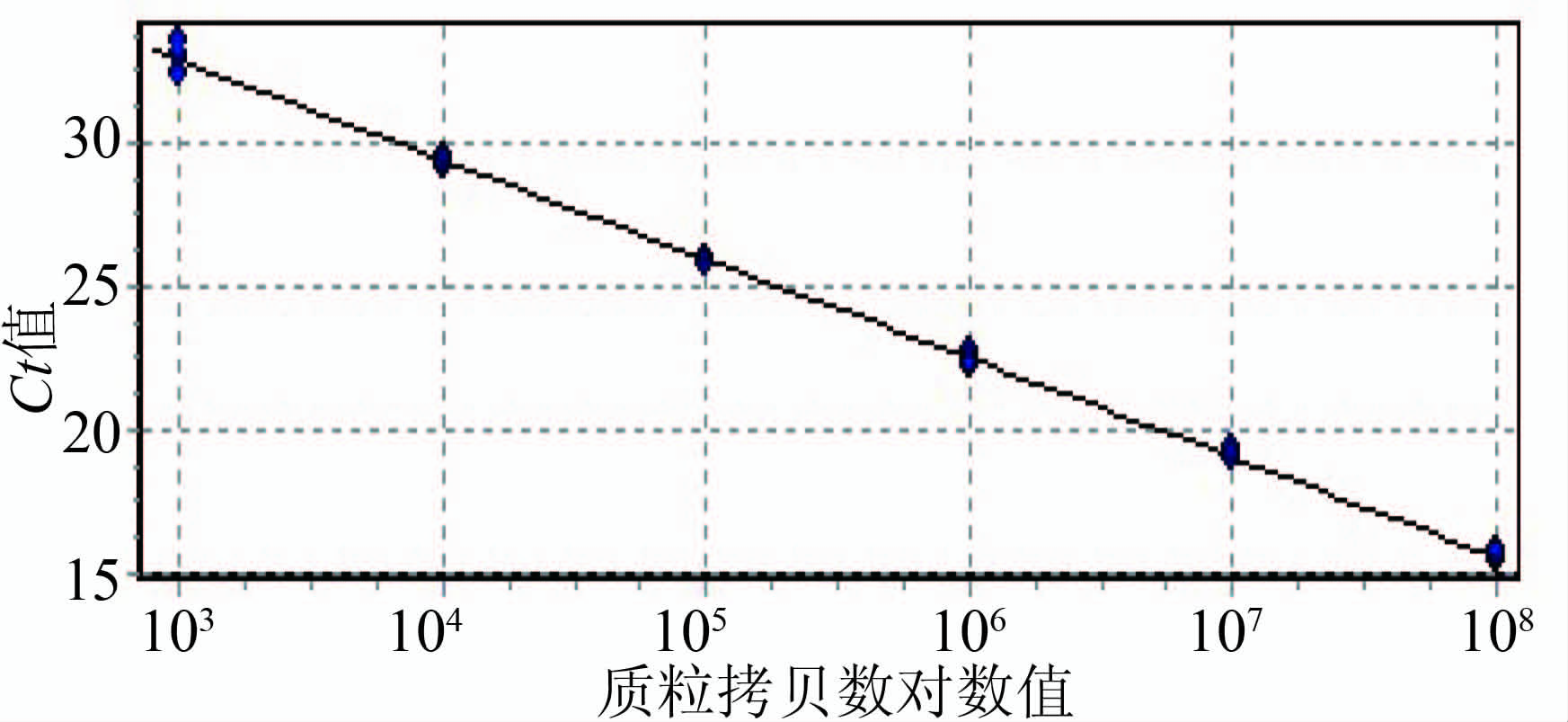
2.1 标准曲线的制备 单增李斯特菌与伊氏李斯特菌特异基因的质粒提取物进行10×倍比稀释后,使浓度分别达到3.94×108~3.94×102拷贝/ml,7.27×108~7.27×102拷贝/ml,因为二者以2 ∶ 1配比混合后取1 μl作为模板进行TaqMan双重real-time PCR检测,故在单增李斯特菌质粒拷贝数为7.88×108~7.88×102拷贝/ml,对应的Ct值显示检测下限为7.88×103拷贝/ml,见表2。伊氏李斯特菌质粒拷贝数为7.27×101~7.27×108拷贝/ml时,对应的即检测下限为7.27×103拷贝/ml,见表3。由质粒浓度对数值及其对应Ct值绘制的标准曲线得出单增李斯特菌及伊氏李斯特菌 标准曲线的公式分别为y=-3.351x+41.027、y=3.370x+42.656,R2>0.99,扩增效率分别为0.99、0.98,见图1~4。
表2 含单增李斯特菌特异基因的质粒样本稀释倍比拷贝数的Ct值
Table 2 L. monocytogenes plasmid concentration with corresponding value of Ct
| 统计参数 (拷贝/ml) | 7.88×108 | 7.88×107 | 7.88×106 | 7.88×105 | 7.88×104 | 7.88×103 | 7.88×102 |
| 样本 | 14.05 | 17.71 | 21.11 | 24.28 | 27.82 | 30.89 | 34.21 |
| 重复1 | 14.26 | 17.51 | 20.80 | 24.36 | 27.60 | 30.75 | 33.25 |
| 重复2 | 14.12 | 17.79 | 20.90 | 24.26 | 27.84 | 30.86 | |
| 平均值 | 14.14 | 17.67 | 20.94 | 24.30 | 27.75 | 30.83 |
表3 含伊氏李斯特菌特异基因的质粒样本稀释倍比拷贝数的Ct值
Table 3 L. ivanovii plasmid concentration with corresponding value of Ct
| 统计参数 (拷贝/ml) | 7.27×108 | 7.27×107 | 7.27×106 | 7.27×105 | 7.27×104 | 7.27×103 | 7.27×102 |
| 样本 | 15.48 | 19.14 | 22.65 | 25.71 | 29.40 | 32.28 | 36.45 |
| 重复1 | 15.79 | 19.14 | 22.22 | 25.84 | 29.13 | 32.99 | |
| 重复2 | 15.61 | 19.28 | 22.30 | 25.75 | 29.32 | 32.17 | |
| 平均值 | 15.63 | 19.19 | 22.39 | 25.77 | 29.28 | 32.48 |
2.2 引物及探针特异性检测
实验中单增李斯特菌和伊氏李斯特菌核酸样品检测均为阳性,非单增李斯特菌及伊氏李斯特菌的其他李斯特菌、副溶血弧菌、霍乱弧菌、志贺菌、大肠埃希菌O157 ∶ H7、小肠结肠炎耶尔森菌、甲型副伤寒、伤寒沙门菌、变形杆菌、牛链球菌、猪链球菌、粪链球菌的核酸样品检测结果均为阴性。
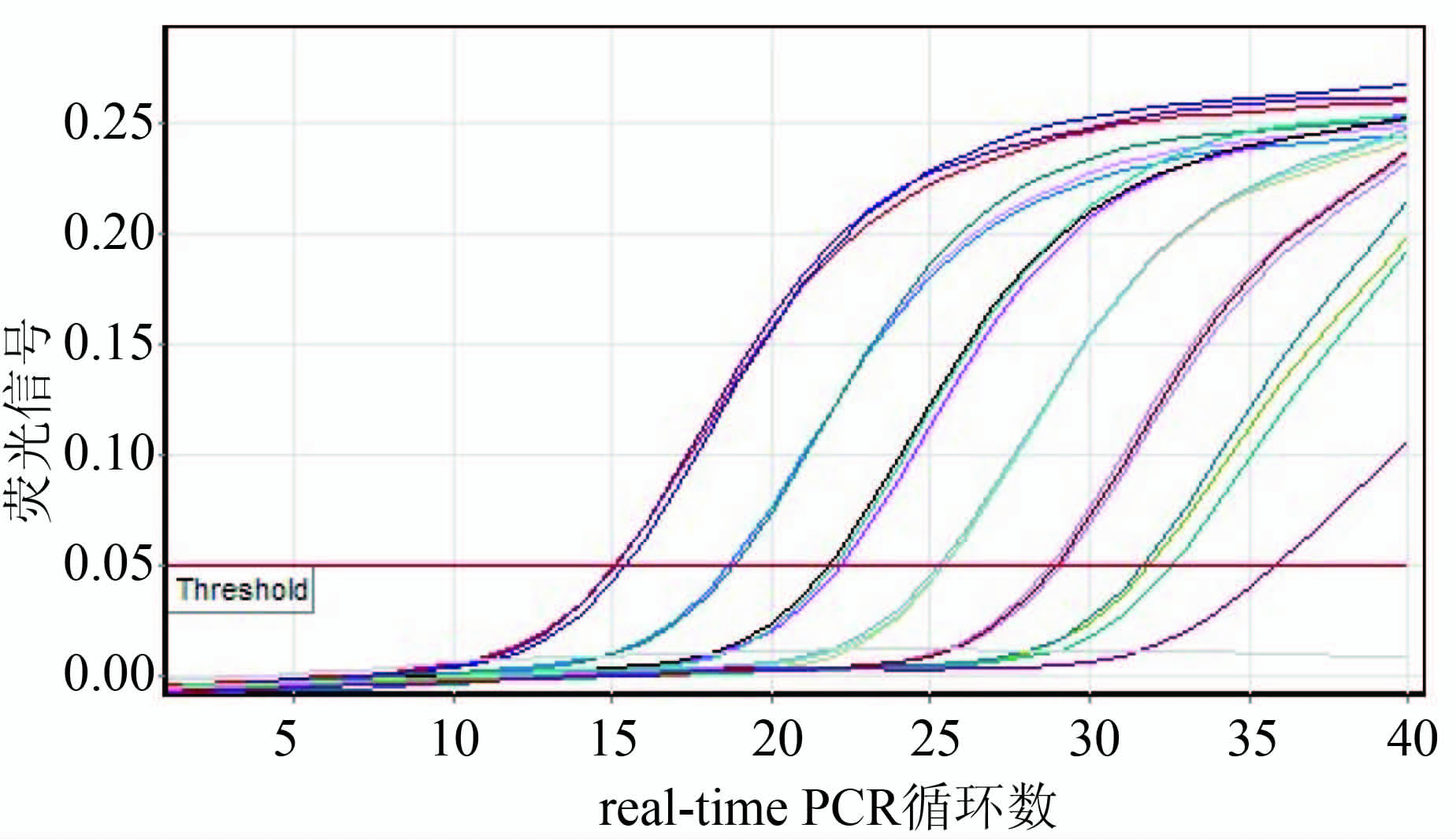
图1 单增李斯特菌标准品荧光信号图
Figure 1 Fluorescent graph of standard L. monocytogenes
图2 含单增李斯特菌特异基因的质粒拷贝数对数值及其对应Ct值的标准曲线
Figure 2 Standard curve information:slope (standard curve slope);r (regression coefficient) for L. monocytogenes plasmid
图3 伊氏李斯特菌标准品荧光信号图
Figure 3 Fluorescent graph of standard L. ivanovii
图4 含伊氏李斯特菌特异基因的质粒拷贝数对数值及其对应Ct值的标准曲线
Figure 4 Standard curve information:slope (standard curve slope);r (regression coefficient) for L. ivanovii plasmid
2.3 粪便模拟标本中单增李斯特菌和伊氏李斯特菌的直接检测结果
模拟粪便标本中单增李斯特菌和伊氏李斯特菌的检测下限分别为2.45×103cfu/g(表4)和2.92×103cfu/g(表5)。
表4 粪便模拟标本中单增李斯特菌菌量与对应的Ct值
Table 4 Amount of L. monocytogenes in simulated fecal samples with corresponding value of Ct
| 统计参数 (拷贝/ml) | 2.45×105 | 2.45×104 | 2.45×103 | 2.45×102 |
| 样本 | 27.49 | 30.83 | 33.28 | 38.09 |
| 重复1 | 27.55 | 30.69 | 33.58 | |
| 重复2 | 27.53 | 30.66 | 34.09 | |
| 平均值 | 27.52 | 30.73 | 33.98 |
表5 粪便模拟标本中伊氏李斯特菌菌量与对应的Ct值
Table 5 Amount of L. ivanovii in simulated fecal samples with corresponding value of Ct
| 统计参数 (拷贝/ml) | 2.92×105 | 2.92×104 | 2.92×103 | 2.92×102 |
| 样本 | 31.43 | 34.05 | 37.62 | |
| 重复1 | 31.40 | 34.83 | 38.91 | |
| 重复2 | 31.67 | 35.08 | 38.43 | |
| 平均值 | 31.40 | 34.65 | 38.32 |
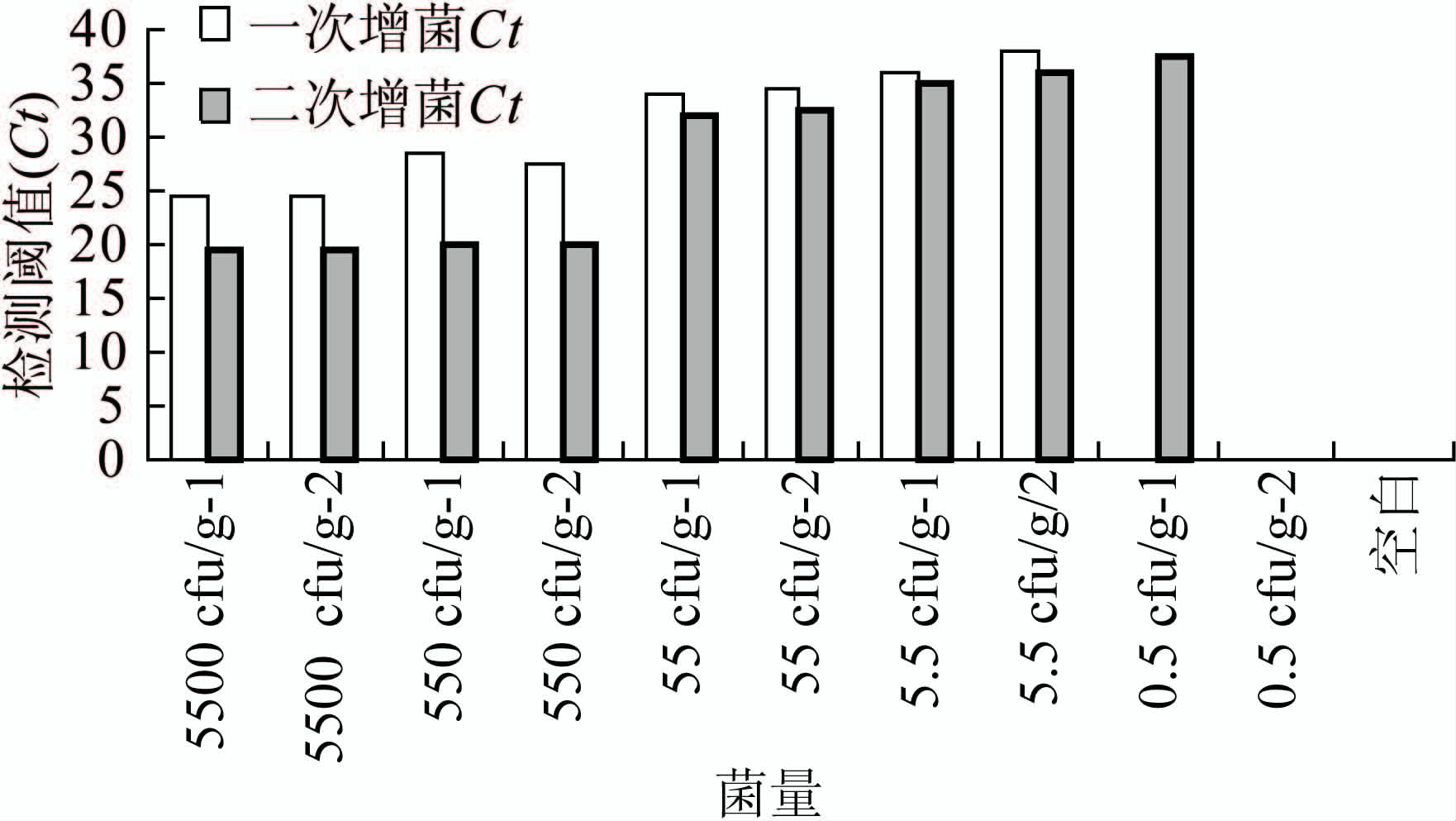
2.4 模拟粪便标本增菌后单增李斯特菌和伊氏李斯特菌real-time PCR检测结果
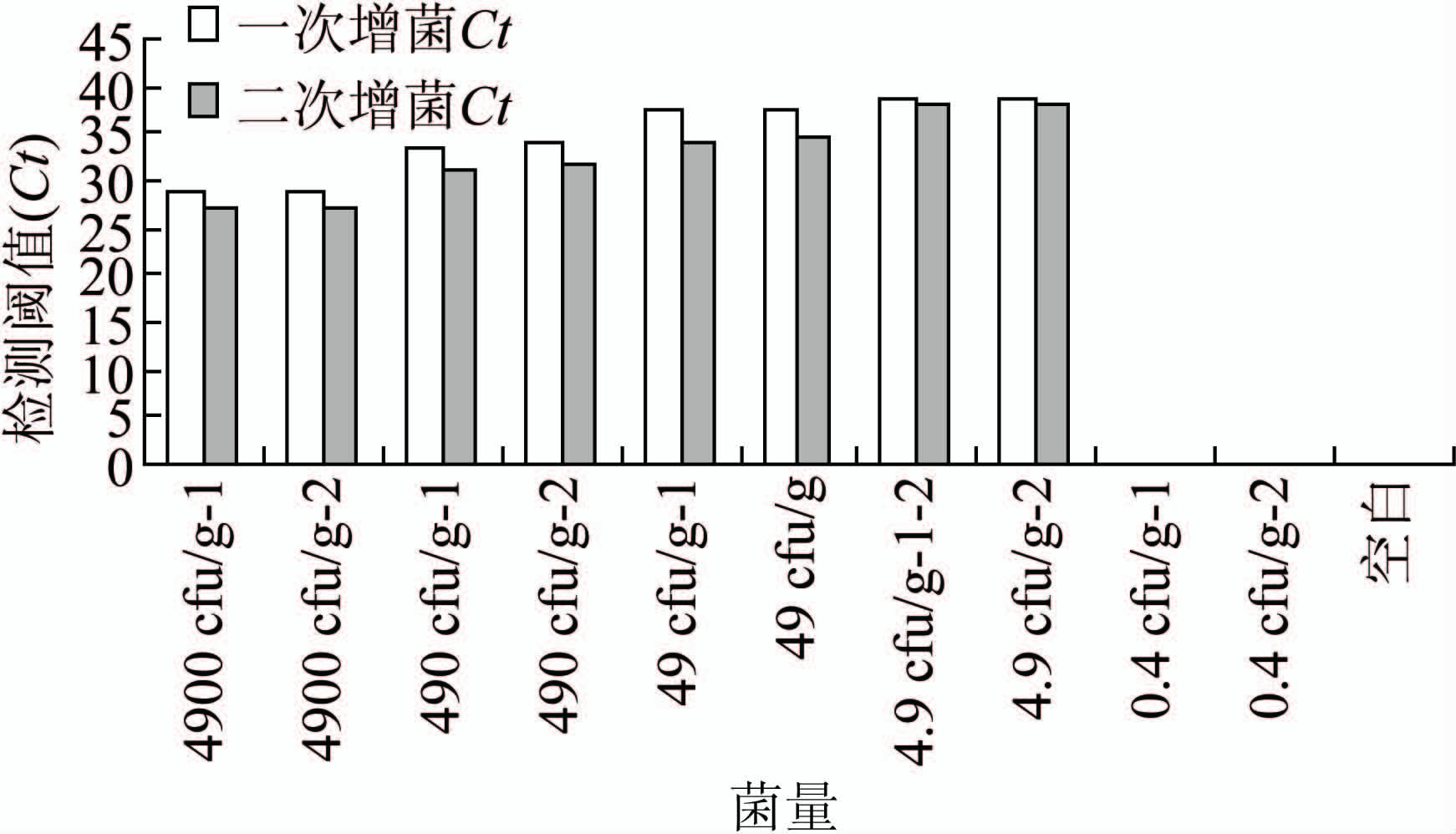
模拟标本中加入的5个稀释梯度的菌量(10-4~10-8倍比稀释菌液),分别在10-6稀释度经过平板计数法得出:加入10-6稀释度时粪便中单增李斯特菌浓度为55 cfu/g、伊氏李斯特菌浓度为49 cfu/g,粪便中含单增李斯特菌5个稀释梯度的菌量(10-4~10-8倍比稀释菌液)粪便中菌液浓度分别为5500、550、55、5.5 和0.5 cfu/g,同样得出:模拟标本中粪便中含伊氏李斯特菌5个稀释梯度的菌量(10-4~10-8倍比稀释菌液)粪便中菌液浓度分别为4900、490、49、4.9 和0.4 cfu/g,见图5、6。每个样本所提取的DNA 重复做3次PCR检测,3 次结果检出阈值(cycles of threshold,Ct)均<40 判为阳性。经过二次增菌的模拟粪便标本单增李斯特菌和伊氏李斯特菌的real-time PCR 检测下限分别为6、5 cfu/g粪便。
图5 单增李斯特菌不同菌量模拟粪便标本real-time PCR检出情况
Figure 5 Result of real-time PCR in detection on different concentration of L. monocytogenes in simulated fecal samples
图6 伊氏李斯特菌不同菌量模拟粪便标本real-time PCR检出情况
Figure 6 Result of real-time PCR in detection on different concentration of L. ivanovii in simulated fecal samples
3 讨论
针对单增李斯特菌特异的溶血素(Listeriolysin O,LLO)编码基因hly和伊氏李斯特菌特异的鞘磷脂酶C的编码基因smcL,建立了一种同时检测这两种病原细菌的双重real-time PCR检测方法。hly位于PrfA依赖型毒力基因簇(LIPI-1),smcL位于伊氏李斯特菌属特异性的毒力岛2(LIPI-2) 。相对于其他基因而言,本研究选取的靶基因hly的核苷酸序列更为保守、种属特异性更强,利于探针的设计和更好地避免假阳性结果产生[2]。
在结果中单增李斯特菌与伊氏李斯特菌在模拟粪便标本中的检测下限分别为2.45×103 cfu/g和2.92×103 cfu/g,前者与文献报道的单重real-time PCR检测下限6.35×103 cfu/g为同一数量级[15],通过模拟人粪便标本,证实直接从粪便标本中提取DNA 进行real-time PCR 检测,需达到103以上数量级(单增李斯特菌2450 cfu/g 粪便,伊氏李斯特菌2920 cfu/g 粪便)含菌量才能被检测到。当粪便标本中菌含量较低时,对标本进行增菌则非常有必要,本研究表明当粪便标本中单增李斯特菌、伊氏李斯特菌的活菌含量分别为6 cfu/g粪便、5 cfu/g 粪便时,使用增菌培养后可检测到相应的细菌核酸为阳性。我们的实验结果还显示,对于某些菌含量极低(如每克粪便含个位级cfu)的粪便标本,二步增菌则可以明显提高检出效率,当标本中李斯特菌含量极低时,增菌时间应该适当延长。本实验室使用该方法对部分动物粪便标本进行了检测,证实了本方法的可行性。临床无菌部位标本的菌群组成较粪便标本简单,也可以参照本方法进行单增李斯特菌的检测[16]。
本研究建立的方法可从粪便这样复杂的标本中同时检测单增李斯特菌和伊氏李斯特菌的存在,为进一步分离获得该2种病原菌提供了参考依据,可用于提高临床感染标本中这2种致病性李斯特菌的检出率,同时为了解我国人群中单增李斯特菌和伊氏李斯特菌的携带及感染状况,及由其导致的食物中毒事件的病原学调查提供了基础 。
参考文献
[1] Gonzáez-Zorn B, Domínguez-Bernal G, Suárez M, et al. The smcL geneof Listeria ivanovii encodes a sphingomyelinase C that mediates bacterial escape from the phagocytic vacuole[J]. Mol Microbiol, 1999, 33(3):510-523.
[2] Vázquez-Boland JA, Kuhn M, Berche P, et al. Listeria pathogenesis and molecular virulence determinants[J]. Clinical Microbiology Reviews, 2001, 14(3):584-640.
[3] Yucel N, Citak S, Onder M. Prevalence and antibiotic resistance of Listeria Species in meat products in Ankara, Turkey[J]. Food Microbiol, 2005, 22(2):241-245.
[4] McLauchlin J. Listeria monocytogenes, recent advances in the taxonomy and epidemiology of listeriosis in humans[J]. Appl Bacteriol, 1987, 63:1-11.
[5] Rodríguez-Lázaro D, López-Enríquez L, Hernández M. smcL as a novel diagnostic marker for quantitative detection of Listeria ivanovii in biological samples[J]. Journal of Applied Microbiology ISSN, 2010, 109(3):863-872.
[6] Guillet C, Join-Lambert O, Le Monnier A, et al. Human listeriosis caused by Listeria ivanovii[J]. Emerg Infect Dis, 2010, 16(1):136-138.
[7] Cummins AJ, Fielding AK, McLauchlin J. Listeria ivanovii infection in a patient with AIDS[J]. J Infect, 1994, 28(1):89-91.
[8] Snapir YM, Vaisbein E, Nassar F. Low virulence but potentially fatal outcome-Listeria ivanovii[J]. Eur J Intern Med, 2006, 17 (4):286-287.
[9] Lessing MP, Curtis GD, Bowler IC. Listeria ivanovii infection[J]. J Infect, 1994, 29:230-231.
[10] Gill PA, Boulton JG, Fraser GC, et al. Bovine abortion caused by Listeria ivanovii[J]. Aust Vet J, 1997, 75(3):214.
[11] Domínguez-Bernal G, MÜller-Altrock S, González-Zorn Bet, et al. A spontaneous genomic deletion in Listeria ivanovii identifies LIPI-2, a species-specificpathogenicity island encoding sphingomyelinase and numerous internalins[J].Molecular Microbiology, 2006, 59(2):415-432.
[12] Donnelly CW. Detection and isolation of Listeria monocytogenes from food samples: implications of sublethal injury[J]. J AOAC Int, 2002, 85(2):495-500.
[13] McLauchlin J. The identification of Listeria species[J]. Int J Food Microbiol, 1997, 38(1):77-81.
[14] Rodríguez-Lázaro D, Lombard B, Smith H, et al. Trends in analytical methodology in food safety and quality: monitoring microorganisms and geneticlymodified organisms[J]. Trends Food Sci Technol, 2007, 18:306-319.
[15] Wang Y, Zhao AL, Ye CY. Real-time PCR-based method for the detection of Listeria monocytogenes in simulated clinical sample[J]. Chinese Journal of Zoonoses, 2009, 25(6):511-514. (in Chinese) 王艳, 赵爱兰, 叶长芸.荧光定量PCR技术用于模拟临床标本单增李斯特菌检测的研究[J].中国人兽共患病学报, 2009, 25(6):511-514.
[16] Wang Y, Chen Q, Li AH, et al. Isolation and identifica-tion of Listeria monocytogenes in artificial fecal samples[J]. Disease Surveillance, 2012, 27(6):475-477.(in Chinese) 王艳, 陈强, 李爱华, 等.模拟粪便标本中的单增李斯特菌的分离和检测[J].疾病监测, 2012, 27(6):475-477.
[17] Hou RS, Wang L, Zhang Q, et al. Application of multiplex PCR for detection of pathogens[J]. Chinese Journal of General Practice, 2011, 8(9):1288-1290. (in Chinese) 侯瑞生, 王丽, 张勤, 等.多重PCR技术及其在病原体检测中的应用[J].中华全科医学, 2011, 8(9):1288-1290.
[2] Vázquez-Boland JA, Kuhn M, Berche P, et al. Listeria pathogenesis and molecular virulence determinants[J]. Clinical Microbiology Reviews, 2001, 14(3):584-640.
[3] Yucel N, Citak S, Onder M. Prevalence and antibiotic resistance of Listeria Species in meat products in Ankara, Turkey[J]. Food Microbiol, 2005, 22(2):241-245.
[4] McLauchlin J. Listeria monocytogenes, recent advances in the taxonomy and epidemiology of listeriosis in humans[J]. Appl Bacteriol, 1987, 63:1-11.
[5] Rodríguez-Lázaro D, López-Enríquez L, Hernández M. smcL as a novel diagnostic marker for quantitative detection of Listeria ivanovii in biological samples[J]. Journal of Applied Microbiology ISSN, 2010, 109(3):863-872.
[6] Guillet C, Join-Lambert O, Le Monnier A, et al. Human listeriosis caused by Listeria ivanovii[J]. Emerg Infect Dis, 2010, 16(1):136-138.
[7] Cummins AJ, Fielding AK, McLauchlin J. Listeria ivanovii infection in a patient with AIDS[J]. J Infect, 1994, 28(1):89-91.
[8] Snapir YM, Vaisbein E, Nassar F. Low virulence but potentially fatal outcome-Listeria ivanovii[J]. Eur J Intern Med, 2006, 17 (4):286-287.
[9] Lessing MP, Curtis GD, Bowler IC. Listeria ivanovii infection[J]. J Infect, 1994, 29:230-231.
[10] Gill PA, Boulton JG, Fraser GC, et al. Bovine abortion caused by Listeria ivanovii[J]. Aust Vet J, 1997, 75(3):214.
[11] Domínguez-Bernal G, MÜller-Altrock S, González-Zorn Bet, et al. A spontaneous genomic deletion in Listeria ivanovii identifies LIPI-2, a species-specificpathogenicity island encoding sphingomyelinase and numerous internalins[J].Molecular Microbiology, 2006, 59(2):415-432.
[12] Donnelly CW. Detection and isolation of Listeria monocytogenes from food samples: implications of sublethal injury[J]. J AOAC Int, 2002, 85(2):495-500.
[13] McLauchlin J. The identification of Listeria species[J]. Int J Food Microbiol, 1997, 38(1):77-81.
[14] Rodríguez-Lázaro D, Lombard B, Smith H, et al. Trends in analytical methodology in food safety and quality: monitoring microorganisms and geneticlymodified organisms[J]. Trends Food Sci Technol, 2007, 18:306-319.
[15] Wang Y, Zhao AL, Ye CY. Real-time PCR-based method for the detection of Listeria monocytogenes in simulated clinical sample[J]. Chinese Journal of Zoonoses, 2009, 25(6):511-514. (in Chinese) 王艳, 赵爱兰, 叶长芸.荧光定量PCR技术用于模拟临床标本单增李斯特菌检测的研究[J].中国人兽共患病学报, 2009, 25(6):511-514.
[16] Wang Y, Chen Q, Li AH, et al. Isolation and identifica-tion of Listeria monocytogenes in artificial fecal samples[J]. Disease Surveillance, 2012, 27(6):475-477.(in Chinese) 王艳, 陈强, 李爱华, 等.模拟粪便标本中的单增李斯特菌的分离和检测[J].疾病监测, 2012, 27(6):475-477.
[17] Hou RS, Wang L, Zhang Q, et al. Application of multiplex PCR for detection of pathogens[J]. Chinese Journal of General Practice, 2011, 8(9):1288-1290. (in Chinese) 侯瑞生, 王丽, 张勤, 等.多重PCR技术及其在病原体检测中的应用[J].中华全科医学, 2011, 8(9):1288-1290.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 许华青 | |
| 王艳 | |
| 王毅 | |
| 代航 | |
| 王和 | |
| 叶长芸 | |
| PubMed | |
| Article by XU Hua-qing | |
| Article by WANG Yan | |
| Article by WANG Yi | |
| Article by DAI Hang | |
| Article by WANG He | |
| Article by YE Chang-yun | |