2. Public Health School, Jiamusi University, Jiamusi 154007, Heilingjiang, China
2. 佳木斯大学公共卫生学院, 黑龙江 佳木斯 154007
-
1 材料与方法
- 1.1 实验所用菌株
- 1.2 引物的设计及合成
- 1.3 纯菌DNA模板的提取
- 1.4 粪便模拟标本的制备
- 1.4.1 不同浓度梯度菌液制备
- 1.4.2 TaqMan rRT-PCR反应模板的制备
- 1.4.3 增菌液的制备
- 1.5 临床患者样品核酸制备
- 1.6 双重TaqMan荧光定量PCR 反应体系的建立
- 1.7 基因扩增及序列分析
- 2.1 双重TaqMan荧光定量PCR体系的建立
- 2.2 双重TaqMan rRT-PCR特异性及灵敏性检测
- 2.2.1 纯菌样品的双重TaqMan rRT-PCR特异性及灵敏性检测
- 2.2.2 双重TaqMan rRT-PCR重复性评价
- 2.2.3 临床样品双重TaqMan rRT-PCR特异性及灵敏性检测
- 2.3 双重TaqMan rRT-PCR检测下限测定
- 2.3.1 纯菌样本中双重TaqMan rRT-PCR的检测下限
- 2.3.2 粪便模拟标本中双重TaqMan rRT-PCR的检测下限
伤寒、甲型副伤寒是由伤寒沙门菌及甲型副伤寒沙门菌引起的急性肠道传染病,均经消化道传播,临床症状相似,均表现为不明原因发热、脾大、玫瑰疹、血检白细胞减少等,单以临床症状难以区分,鉴别诊断主要依靠病原学分离培养。目前伤寒、甲型副伤寒在非洲、东南亚以及我国广西、贵州等地持续多发,并引起暴发流行,是发展中国家威胁人群健康的重要公共卫生问题。据世界卫生组织统计2000年全球大约有2170万病例,其中216 510人死亡[1]。我国2012年伤寒及副伤寒全国累计发病数超过1万例,各省(直辖市、自治区,台湾及西藏除外)均有病例报告[2]。目前对于甲型副伤寒沙门菌、伤寒沙门菌及其他非沙门菌的鉴别主要通过细菌培养、生化反应和血清型鉴定,需时较长。因此,对伤寒、甲型副伤寒的快速灵敏诊断一直是该病以及相关传染病检测、监测和应急中亟待解决的问题。
目前,已有针对伤寒及甲型副伤寒沙门菌的多个基因包括invA、prt、fliC-d和viaB的单重或多重PCR检测这2种病原体[3-6]。该方法虽然能准确、可靠地鉴定伤寒沙门菌,但需时相对较长,且易污染。也有利用实时荧光定量反转录-聚合酶链反应方法(rRT-PCR)[6]及反转录环介导等温扩增技术(RT-LAMP)检测血液中的伤寒沙门菌的报道[7],但需要使用特殊试剂盒提取血液RNA,且特异性存在一定的局限性。考虑到伤寒及甲型副伤寒沙门菌在肠道内增殖且可大量随粪便外排这一特点,及粪便样本的易获得性、非侵入性和荧光定量PCR仪器在基层医院的大量应用,发展以粪便检测为基础的双重TaqMan荧光定量PCR检测方法同时识别伤寒和甲型副伤寒沙门菌,能够有效缩短疾病诊断周期、提高诊断效率,在节约样本、降低检测费用等方面具有一定优势。
本实验所用的伤寒及甲型副伤寒沙门菌菌株均为本实验室保存,分离自1962 2010年我国伤寒、副伤寒高发的5个省份的患者。其他作为检测特异性评价的菌株包括伤寒沙门菌44株,甲型副伤寒沙门菌30株,肠道常见病原菌包括非伤寒沙门菌、志贺菌四群、致泻性大肠埃希菌(EPEC、EIEC、EHEC、EAEC、ETEC)、产毒性O1群霍乱弧菌、O139群霍乱弧菌、副溶血性弧菌及引起发热并可在血液标本中分离到的肺炎链球菌、伯氏疏螺旋体、钩端螺旋体、嗜肺军团菌、脑膜炎奈瑟菌、立克次体、布鲁氏菌等菌株(表1),均来自中国疾病预防控制中心传染病预防控制所。
分别将伤寒沙门菌Ty2及甲型副伤寒沙门菌ATCC9150的全基因序列与GenBank中已发表的其他微生物基因组序列及人类基因组序列进行比对,发现STY1633基因仅存在于伤寒沙门菌中,SPA4289为甲型副伤寒沙门菌的特异基因,因此根据GenBank中STY1633及SPA4289的序列,利用Beacon Designer 7.0软件(ABI公司)设计相应的荧光定量PCR引物及TaqMan 探针,STY1633的引物序列为:ST71-F:ACG GCG AGG ATG GTG TTA T,ST71-R:CGA GGT TTT TCC CTT TGA GAG,探针ST71-P:Quasar-AGG TTG CCG CTG ATA TCT CTC T-BHQ2。SPA4289的引物序列为:SPA-F:GTT GCG TGT TAA AGA TTC,SPA-R:GGG GAA TAA AAT TTA TTA GGG,探针SPA-P:ROX-CCT GTC ACT ATA CGG AAC AAG AAC T-BHQ2。引物由TaKaRa生物技术有限公司合成。
DNA提取使用Wizard® genomic DNA purification Kit (Promega公司),操作步骤均严格按照该说明书进行。
挑取伤寒沙门菌CT18及甲型副伤寒沙门菌ATCC9150单个菌落接种在LB(Luria-Bertani)液体培养基,37 ℃振荡培养至A值达0.8(菌量约为1×108cfu/ml)。此时的菌液作为原液,将其倍比稀释获得自107cfu/ml~1/32×100cfu/ml不同浓度梯度菌液。取系列稀释菌液进行菌落计数,测定模拟标本中准确细菌含量。
取1.4.1中各浓度梯度菌液各500 μl与适当克数的健康人的粪便标本混合,混匀后,取一接菌环接种科玛嘉沙门菌显色平板,37 ℃过夜培养,观察目标菌生长情况。同时取粪便与菌液的混匀样品100 μl加入200 μl TE,涡旋振荡,1000 r/min,离心1 min后去沉淀(粪便残渣)。将保留下来的上清,8000 r/min离心5 min后弃上清,再将沉淀用1 ml TE重悬。振荡离心同上,弃上清,保留沉淀并用100 μl TE悬菌。经100 ℃水浴沸煮10 min后离心,留上清,此为增菌前样品,用做双重TaqMan rRT-PCR反应模板。
将1.4.2中剩余的粪便与菌液的混合物中加入6 ml亚硒酸盐增菌液,37 ℃过夜培养。第2天取一接菌环增菌液接种科玛嘉沙门菌显色平板,37 ℃过夜培养,观察目标菌生长情况。同时取1 ml该增菌液,按1.4.2中步骤制备增菌后样品DNA用于双重TaqMan rRT-PCR反应。
取约0.2 g患者粪便用1 ml TE重悬后,按1.4.2中的步骤进行核酸样品的制备。
使用Premix Ex Taq(TaKaRa公司)进行双重TaqMan荧光定量PCR核酸扩增。反应体系(总体积20 μl)组成为:2×Premix mixture 10 μl,引物71-F及71-R各2 pmol,探针ST71-P 1 pmol,引物SPA-F及SPA-R各2 pmol,探针SPA-P 2 pmol,模板DNA 2 μl。使用CFX96荧光PCR仪(Bio-Rad 公司),扩增条件为95 ℃ 30 s,95 ℃ 5 s,65 ℃ 25 s,共40个循环,递增频率为0.05 s。退火是检测荧光信号。对于Ct值≤35的扩增结果判定为阳性。
以提取的菌株DNA为模板,使用高保真酶pyrobest(TaKaRa公司)进行常规PCR扩增,扩增产物行琼脂糖凝胶电泳,检测PCR片段长度。并将PCR产物纯化后,送上海生工生物有限公司进行序列测定(ABI3730),获得的序列利用DNAstar软件进行比对分析。PCR反应体系(总体积50 μl)组成为:10×pyrobest buffer 5 μl,4种dNTP各200 μmol/L,引物71-F及71-R各400 μmol/L,模板DNA 100 ng。扩增条件为95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,共35个循环。
首先利用纯菌染色体DNA对伤寒沙门菌及甲型副伤寒沙门菌进行单探针TaqMan荧光定量PCR体系的引物浓度及探针浓度进行筛选,获得Ct值最小的最优引物及探针浓度组合,然后将优化好的伤寒及甲型副伤寒单重TaqMan实时rRT-PCR体系以1 ∶ 1体积混合,获得方法1.6中所示的反应体系。
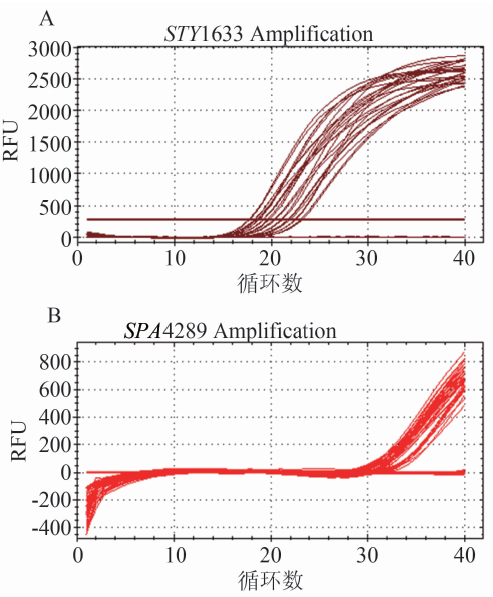
本研究共进行了48种162株细菌的双重TaqMan rRT-PCR(表1),其中44株伤寒沙门菌及30株甲型副伤寒沙门菌均阳性(图1),沙门菌属其他34种常见血清型均扩增阴性,其他常见腹泻病原包括霍乱弧菌、副溶血性弧菌、志贺菌、致泻性大肠埃希菌亦扩增阴性。而且,临床其他常见发热病原菌包括金黄色葡萄球菌、肺炎链球菌、伯氏疏螺旋体、钩端螺旋体、嗜肺军团菌、脑膜炎奈瑟菌、立克次体、布鲁氏菌均扩增阴性,特异性、敏感性均为100%,说明本研究建立的双重TaqMan rRT-PCR具有较高的特异性及灵敏性。
对44株及30株双重TaqMan rRT-PCR扩增阳性的伤寒沙门菌及甲型副伤寒沙门菌进行常规PCR扩增(图2),2%琼脂糖凝胶电泳显示片段大小约200 bp,与理论值(伤寒沙门菌为210 bp,甲型副伤寒沙门菌为177 bp)一致。对回收的PCR产物进行序列测定,经DNAstar软件比对发现,所有伤寒沙门菌菌株的扩增序列完全一致,不存在单个或多个核苷酸的点突变及缺失、插入情况。同时考虑2种病原菌株分离时间(1959 2010年)及地域(5个省份)的广泛性,进一步说明本研究建立的双重TaqMan rRT-PCR具有较高的特异性及代表性。
表1 双重TaqMan rRT-PCR特异性及敏感性检测Table 1 Sensitivity and specificity of dual TaqMan fluorescent qPCR assay
| 菌株类型 | 菌株数 | 双重TaqMan rRT-PCR |
| 沙门菌属 | ||
| 伤寒沙门菌 | 44 | + |
| 甲型副伤寒沙门菌 | 33 | + |
| 乙型副伤寒沙门菌 | 2 | - |
| 丙型副伤寒沙门菌 | 1 | - |
| 猪霍乱沙门菌 | 1 | - |
| 鼠伤寒沙门菌 | 10 | - |
| 肠炎沙门菌 | 10 | - |
| 德尔卑沙门菌 | 2 | - |
| 汤姆逊沙门菌 | 2 | - |
| 山夫登堡沙门菌 | 2 | - |
| 韦太夫雷登沙门菌 | 2 | - |
| 阿贡纳沙门菌 | 2 | - |
| 阿伯丁沙门菌 | 1 | - |
| 鸭沙门菌 | 1 | - |
| 火鸡沙门菌 | 1 | - |
| 圣地亚哥沙门菌 | 1 | - |
| 乌干达沙门菌 | 1 | - |
| 肯塔基沙门菌 | 1 | - |
| 蒙得维的亚沙门菌 | 1 | - |
| 斯坦利沙门菌 | 1 | - |
| 波摩那沙门菌 | 1 | - |
| 波茨坦沙门菌 | 1 | - |
| 姆班达卡沙门菌 | 1 | - |
| 伊斯坦布尔沙门菌 | 1 | - |
| 非丁伏斯沙门菌 | 1 | - |
| 利奇菲尔德沙门菌 | 1 | - |
| 印第安纳沙门菌 | 1 | - |
| 盖茨黑德沙门菌 | 1 | - |
| 维尔肖沙门菌 | 1 | - |
| 威廉斯堡沙门菌 | 1 | - |
| 旺滋沃思沙门菌 | 1 | - |
| 胥伐成格隆沙门菌 | 1 | - |
| 利文斯通沙门菌 | 1 | - |
| 利物浦沙门菌 | 1 | - |
| 斯坦利维尔沙门菌 | 1 | - |
| 都柏林沙门菌 | 1 | - |
| 其他肠道病原菌 | ||
| O1群霍乱弧菌 | 2 | - |
| O139群霍乱弧菌 | 2 | - |
| 副溶血性弧菌 | 4 | - |
| 痢疾志贺菌 | 1 | - |
| 福氏志贺菌 | 1 | - |
| 鲍氏志贺菌 | 1 | - |
| 宋内志贺菌 | 1 | - |
| 致泻性大肠埃希菌 | 5 | - |
| 其他常见发热病原 | ||
| 肺炎链球菌 | 1 | - |
| 伯氏疏螺旋体 | 1 | - |
| 钩端螺旋体 | 1 | - |
| 嗜肺军团菌 | 1 | - |
| 脑膜炎奈瑟菌 | 1 | - |
| 立克次体 | 2 | - |
| 布鲁氏菌 | 3 | - |
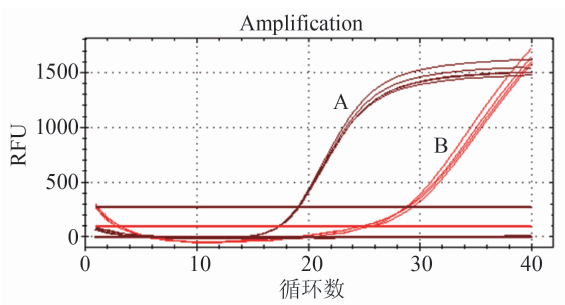
因双重TaqMan rRT-PCR体系中加入了2对引物,彼此容易因结构相似而互相影响其稳定性,从而影响PCR产 物的扩增。在经优化后的PCR体系中分别加入STY1633及SPA4289的模板DNA,每个体系重复4个样本,待反应结束后经仪器检测的荧光信号Ct值之间差异不超过0.5即认为该引物的重复性好。由图3中的扩增曲线可见A及B的扩增起点分别都是重合的,而且结果证明Ct值(A:19.1、19.2、19.0、19.1,B:28.9、29.1、28.9、29、0)彼此相差均不超过0.3,可见该双重TaqMan rRT-PCR体系稳定,重复性好,适合反复应用于标本检测中。
图1 双重TaqMan rRT-PCR检测纯培养伤寒及甲型副伤寒沙门菌
Figure 1 Dual TaqMan fluorescent qPCR amplification of STY1633(A) and SPA4289 (B) in pure cultured S. typhi and S. paratyphi A isolates
注:M: Marker DL2000, lanes 1~21/22: PCR amplicons。
图2 STY1633及SPA4289 PCR产物琼脂糖凝胶电泳(部分)
Figure 2 Agarose electrophoresis of PCR amplicons of STY1633 and SPA4289 in S. typhi and S. paratyphi A isolates
图3 双重TaqMan rRT-PCR对STY1633及SPA4289的重复性检测
Figure 3 Reproducibility of dual TaqMan fluorescent qPCR amplification of STY1633(A) and SPA4289 (B)
以10份伤寒患者、20份甲型副伤寒患者粪便粗提的核酸为模板进行双重TaqMan rRT-PCR检测,结果均为阳性。48份非伤寒病原菌感染粪便包括嗜水气单胞菌感染4例,类志贺邻单胞菌感染3例,志贺菌感染2例,肠炎沙门菌感染2例,副溶血性弧菌感染1例,致泻性大肠埃希菌感染5例,其余样品为未知病原致发热及腹泻样品,结果目的基因均扩增阴性,进一步说明针对双重TaqMan rRT-PCR反应具有较高的特异性及灵敏性。
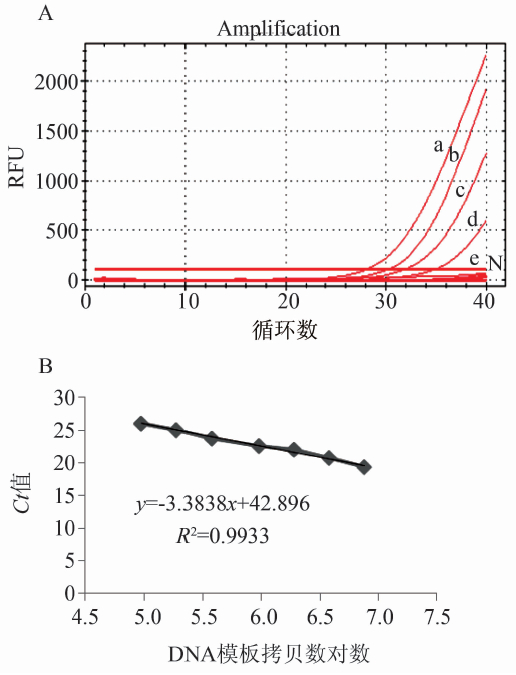
分别对2种纯菌DNA的下限进行检测,其中伤寒沙门菌的检测下限是1 pg/反应,即194拷贝/反应,甲型副伤寒沙门菌是2.5 pg/反应,485拷贝/反应(图4),与文献报道一致[4-7]。以时间(min)为纵轴,甲型副伤寒沙门菌模板DNA拷贝数的对数为横轴,获得拟合曲线方程为y=-3.3838x+42.896,R2=0.9933,说明引物扩增效率较高。同理获得伤寒沙门菌拟合曲线方程为y=-3.4811x+45.02,R2=0.9977,说明引物扩增效率也较高。上述实验均进行了三次独立重复实验,结果一致。
分别以伤寒及甲型副伤寒的粪便模拟本增菌前及增菌后粗制核酸为模板进行双重TaqMan rRT-PCR检测,结果显示该方法对伤寒的增菌前粪便样品的检测下限为102 cfu/g,增菌后的检测下限是1 cfu/g;甲型副伤寒的增菌前粪便样品的检测下限为104 cfu/g,增菌后的检测下限是10 cfu/g。而粪便样品直接划线分离培养的灵敏度为105 cfu/g。可见本体系的建立提高了病原菌的检测下限。
本研究小组前期建立了基于STY1633基因的rRT-PCR方法检测血液中的伤寒沙门菌[6],考虑伤寒与甲型副伤寒在临床症状上难以区分,且两者对临床常用氟喹诺酮类药物的敏感性不同,而如果通过特异基因的检测能够实现两者快速鉴别的话,将对疫苗应用及临床用药起到早期指导作用。通过比对GenBank中所有伤寒沙门菌已知序列及甲型副伤寒沙门菌已知序列,获得它们共有的基因序列后再与其他血清型沙门菌及人类基因组进行比对,进而获得这2种病原菌特有而与人类及其他沙门菌无共有序列的特异基因,以该基因为靶点,设计合成双重TaqMan rRT-PCR引物及探针,通过纯菌DNA扩增反应进行引物及探针浓度优化,最后获得扩增效率最高及扩增时间最短(Ct值最小)的引物及探针,进行特异性、敏感性及实际标本检测评价。同时考虑患者粪便中往往含有大量病原菌,若能发展一个反应体系中同时检测粪便中2种病原菌,这样不仅提高了检测效率,缩短诊断周期、降低检测成本、使患者得到及时治疗、减少病原菌外排引起传播的机会,而且患者也更易于接受。
注:a~e分别为20、10、5、2.5和1 pg/test; N.阴性对照。
图4 纯菌样品中双重TaqMan rRT-PCR对甲型副伤寒SPA4289检测下限(A)及 拟合曲线(B)
Figure 4 Detection limit of SPA 4289 (A) of dual TaqMan fluorescent qPCR amplification and fitting curve (B) in pure cultured S. paratyphi A isolates
利用水解探针法即TaqMan技术进行核酸的检测,可实现多种病原同时检测的目的,虽然较SYBR染料法成本有所提高,但检测特异性及灵敏性会显著提高,同时由于减少了产物变性(溶解曲线)的过程,在检测时间上也明显少于SYBR染料法。本研究使用粗制的DNA为模板解决了使用试剂盒纯化核酸的高费用,降低了成本,而且节约了时间。传统的PCR扩增需1 h以上,加上电泳实验的时间共需2 h左右能得出结果。本研究之前建立的SYBR法rRT-PCR[7]可将时间缩短至75 min左右,然而双重TaqMan rRT-PCR在45 min左右即可完成全部扩增。
在粪便标本中进行核酸扩增检测病原菌感染,需设计筛选特异性高的引物,考虑伤寒及甲型副伤寒沙门菌属于肠道沙门菌属,故与其他肠道菌及沙门菌属其他血清型需要明确区分,避免假阳性反应。经过大量试验菌株扩增检测,双重TaqMan rRT-PCR法能将伤寒沙门菌及甲型副伤寒沙门菌进 行有效扩增区分,并与沙门菌属中其他常见的沙门菌血清型区分开,而且在肠道其他常见致泻性细菌,包括霍乱弧菌、志贺菌、副溶血性弧菌、致泻性大肠埃希菌中均无扩增。且在模拟粪便检测中表现出较高的敏感性,高于SYBR染料法检测底限为104 cfu/g[8]及多重荧光PCR检测底限为1×105 cfu/g的报道[3]。 由于伤寒及甲型副伤寒在临床上主要以急起高热为主要表现,因此需与其他引起类似症状的致病菌进行区别。本研究建立的双重TaqMan rRT-PCR对临床常见的以发热为主的8种主要病原均扩增阴性,且在实际伤寒及甲型副伤寒患者粪便标本检测中特异性、敏感性均达100%, 而且对其他病原导致的腹泻样本及发热样本的检测为阴性。上述结果说明我们建立的双重TaqMan rRT-PCR能够鉴别诊断粪便标本中的伤寒和甲型副伤寒沙门菌,在以发热症状为主的症候群监测、腹泻症候群监测及伤寒、副伤寒高发区人群带菌率调查方面及饮食从业人员体检的粪便样本检测等方面,具有潜在的应用价值。
总之,本研究建立了可同时检测粪便标本中伤寒及甲型副伤寒沙门菌的双重TaqMan rRT-PCR方法,并通过临床样品的检测验证,为伤寒及甲型副伤寒疾病的快速诊断提供了简易手段。
[2] Sun JL, Zhang J, Ma HL, et al. Epidemiological features of typhoid/paratyphoid fever in provinces with high incidence rate and in the whole country, in 2012[J]. Chin J Epidemiol,2013,34(12):1183-1188.(in Chinese)孙军玲,张静,马会来,等.2012年全国和高发省份伤寒、副伤寒流行特征分析[J]. 中华流行病学杂志,2013, 34(12):1183-1188.
[3] Grace YN, Li MN, Raymond L, et al. Development of a novel multiplex PCR for the detection and differentiation of Salmonella enterica serovars Typhi and paratyphi A [J]. Res Microbiol,2010,161(4):243-248.
[4] Tran N, Abhilasha K, sabina D, et al. The sensitivity of real-time PCR amplification targeting invasive Salmonella serovars in biological specimens [J]. BMC Infect Dis,2010,10(5):125-133.
[5] Massi MN, Shirakawa T, Gotoh A, et al. Quantitative detection of Salmonella enterica serovar Typhi from blood of suspected typhoid fever patients by real-time PCR [J]. Int J Med Microbiol,2005,295(2):117-120.
[6] Fan FX, Lou J, Chen JC, et al. Detection of Salmonella typhi in blood with real time fluorescent quantitative reverse transcriptive polymerase chain reaction[J]. Disease Surveilance,2012,27(6):471-474.(in Chinese)樊粉霞,娄静,陈建才,等. 利用实时荧光定量反转录-聚合酶链反应方法检测血液中伤寒沙门菌[J].疾病监测,2012, 27(6):471-474.
[7] Fan FX, Wang SJ, Lou J, et al. Establishment of RT-LAMP technique to detect Salmonella typhi pathogen in blood[J]. Disease Surveilance,2012,27(4):325-329. (in Chinese)樊粉霞,王淑京,娄静,等. 全血中伤寒沙门菌RT-LAMP检测方法的建立[J].疾病监测,2012,27(4):325-329.
[8] Xiao Y,Ren ZH,Fan FX,et al.Detection fo Salmonella typhi in stool samples with real-time fluorescent quantitative polymerase chain reaction[J].Disease Surveillance,2013,28(5):407-411.(in Chinese) 肖燕,任志鸿,樊粉霞,等. 利用实时荧光定量PCR法检测粪便标本中的伤寒沙门菌[J]. 疾病监测,2013,28(5):407-411.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 李杰 | |
| 肖燕 | |
| 樊粉霞 | |
| 阚飙 | |
| 闫梅英 | |
| PubMed | |
| Article by LI Jie | |
| Article by XIAO Yan | |
| Article by FAN Fen-xia | |
| Article by KAN Biao | |
| Article by YAN Mei-ying | |