扩展功能
文章信息
- 钱菁菁, 周翠, 陈栎江, 吴庆
- QIAN Jing-jing, ZHOU Cui, CHEN Li-jiang, WU Qing
- 鲍曼不动杆菌OXA型碳青霉烯酶基因型检测分析
- Detection of OXA-type carbapenemases genes of Aciuetobacter baumauuii
- 疾病监测, 2014, 29(7): 556-559
- Disease Surveillance, 2014, 29(7): 556-559
- 10.3784/j.issn.1003-9961.2014.07.013
-
文章历史
- 收稿日期:2014-4-25
- 退修日期:##TuiXiuRiQi##
- 录用日期:##LuYongRiQi##
鲍曼不动杆菌(Acinetobacter baumannii)属于不动杆菌属的一个常见菌种,是一种不发酵糖类、氧化酶阴性的革兰阴性球杆菌,广泛分布于自然界,是导致医院感染的重要的病原菌之一。碳青霉烯类抗生素作为重症鲍曼不动杆菌感染的首选药物,在临床大量使用后,筛选出耐碳青霉烯类药物的菌株,由于此类菌株一旦对碳青霉烯类抗生素耐药就意味着对现有的常用抗生素多数耐药甚至全部耐药 [1],从而给临床抗感染治疗带来了极大的困难。鲍曼不动杆菌耐药机制十分复杂,如水解酶的产生、青霉素结合蛋白的改变、膜孔道蛋白的缺失,药物主动外排泵的过度表达等,而其耐药性的表现通常是由其中一种或几种机制共同作用而导致 [2],其中产OXA型碳青霉烯酶(oxacillinases,又称苯唑西林酶)是鲍曼不动杆菌对碳青霉烯类抗生素耐药的主要机制 [3]。插入序列IS4家族成员常出现于碳青霉烯酶基因、AmpC基因的上游或下游,为其表达提供启动子。目前临床上对碳青霉烯酶的检测主要以基因检测为主,本研究针对鲍曼不动杆菌碳青霉烯酶相关耐药基因设计引物,对临床分离的200株鲍曼不动杆菌进行检测,并对检测结果进行研究分析,以了解其耐药机制及碳青霉烯酶在温州医科大学附属第一医院的流行分布情况。
1 材料与方法 1.1 材料 1.1.1 菌株来源收集温州医科大学附属第一医院2008年1月至2011年12月住院患者临床分离的鲍曼不动杆菌200株,所有菌株经分离纯化后储存于甘油肉汤中于-40 ℃保存,细菌的分离培养按照《全国临床检验操作规程》(3版) [4]进行。质控菌株:铜绿假单胞菌ATCC27583,购自卫生部临床检验中心。
1.1.2 主要仪器VITEK-60型全自动微生物分析仪购自法国梅里埃公司;DYY-III-8B型电泳仪购自北京市六一仪器厂;Eppendorf 5332型DNA扩增仪购自德国艾本德公司;WD-9413B型凝胶成像分析仪购自北京市六一仪器厂。
1.1.3 主要分子生物学试剂10×PCR buffer、dNTP Mixture、MgCl2、Taq酶、100 bp DNA ladder以及其他分子生物学试剂购自杭州博日生物技术公司;本研究使用PCR引物的序列及大小见表 1,由上海生工生物工程有限公司合成。
| 引物名称 | 引物序列 | 预期长度(bp) |
| OXA-23P1 | TAA TAA ATG AAA CCC CCG AG | 753 |
| OXA-23P2 | ATT AAA ACA GCT GAA TAT TAT | |
| ISAba1P1 | CCC TGA TCG GAT TGG AGA AC | 771 |
| ISAba1P2 | ATG GGC AAG GCT TTA GAT GC | |
| AssP1 | ATT AAG CAA TGT CCA AAG GAT AGG | 806 |
| AssP2 | AAT GAC CTT TTC TCG CCC TTC | |
| OXA-24P1 | AGC AAA TAA AGA ATA TGT CCC TGC | 496 |
| OXA-24P2 | CTC CAC CCA ACC AGT CAA CC | |
| OXA-51P1 | TGA CTG CTA ATC CAA ATC ACA GC | 607 |
| OXA-51P2 | TCT ACA TCC CAT CCC CAA CC | |
| OXA-58P1 | AAG TAT TGG GGC TTG TGC TG | 931 |
| OXA-58P2 | GAG GCA GGT TGG ACA TTT GA | |
| ISAba3P1 | TAG ATG TGC TAG ATA AGT TGG GTG | 620 |
| ISAba3P2 | TGC AAT TCG GGT GTA GTG AA |
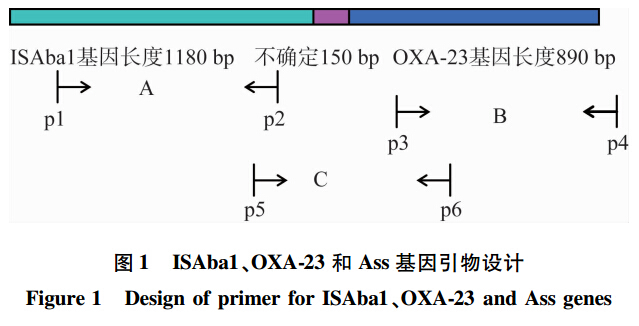
已确定的ISAba1基因长度为1180 bp,OXA-23基因长度为890~900 bp之间,而在两者之间还存在着约有150 bp左右不确定的辅助碱基,见图 1。为此设计了3对引物,除了可以对ISAba1和OXA-23基因完成单基因检测的2对引物P1和P2(A段序列)、P3和P4(B段序列)外,还在ISAba1基因的下游和OXA-23基因的上游(包括不确定的150 bp)之间的C段序列还设计了一对辅助性引物P5和P6(Assistant,Ass)。对这3段序列分别进行DNA测序,然后进行拼接,从而可以达到全长测序的目的。所有引物经Blastn比对,除目的基因外,不能与其他基因匹配,特异性强。
|
| 图1 ISAba1、OXA-23和Ass基因引物设计 Fig.1 Design of primer for ISAba1、OXA-23 and Ass genes |
所有实验菌株经纯化分离培养后由VITEK-60型全自动微生物分析仪进行再次鉴定确认。
1.2.2 聚合酶链反应(PCR)扩增检测采用煮沸裂解法提取PCR反应体系模板:挑取培养过夜的细菌制备浓菌悬液,100 ℃煮沸10 min使细菌DNA变性,13 000 r/min离心5 min,取上清液5 μl作为反应模板加入PCR反应体系。PCR反应体系中的各成分按照常规配比加入,反应体系总体积为25 μl;反应参数为:94 ℃预变性4 min,然后94 ℃变性1 min,55 ℃退火40 s,72 ℃延伸40 s,共35个循环,最后72 ℃延伸10 min,PCR扩增结束后,取5 μl产物置1.5%浓度的琼脂糖凝胶进行电泳,120 V×50 min,电泳完毕后置245 nm紫外灯下观察结果,并进行凝胶成像系统扫描成像。
1.2.3 扩增产物测序送由上海生工生物工程有限公司完成,测序结果与GenBank上注册的相应基因序列进行比对分析。
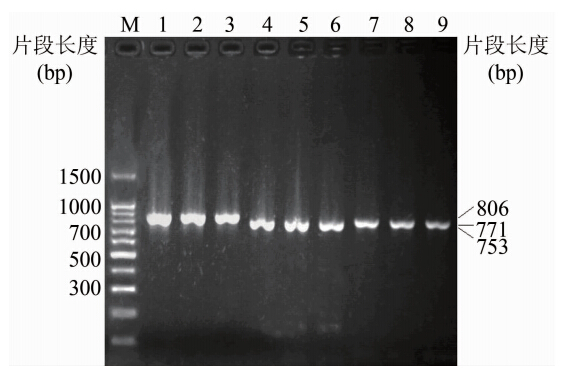
2 结果 2.1 PCR扩增结果200株鲍曼不动杆菌采用特异性引物对其OXA型碳青霉烯酶耐药基因及插入序列进行扩增,其中OXA-23基因阳性菌株155株,同时携带ISAba1基因143株;未检出OXA-24基因阳性株;200株鲍曼不动杆菌均携带OXA-51基因,其中和OXA-23基因组同时阳性155株;OXA-58基因阳性共检出8株,ISAba3阳性共检出12株,其中有8株两者同时阳性,具体结果见表 2,扩增产物见图 2、3。
| OXA型碳青霉烯酶-插入序列 | 株数(n) | 构成比(%) |
| OXA-23 | 155 | 77.5 |
| ISAba1 | 168 | 84.0 |
| ASS | 143 | 71.5 |
| OXA-24 | 0 | 0.0 |
| OXA-51 | 200 | 100.0 |
| OXA-58 | 8 | 4.0 |
| ISAba3 | 12 | 6.0 |
|
| ;注:M:100 bp DNA ladder;1~3:ISAba1(806 bp); 4~6:OXA-23(753 bp);7~9:Ass(771 bp)。 图2 ISAba1、OXA-23和Ass基因扩增产物电泳 Fig.2 Electropherogram of ISAba1,OXA-23 and Ass genes amplification products。 |

|
| 注:M:100 bp DNA ladder;1~2:OXA-51(607 bp); 3~5:OXA-58(931 bp);6~8:ISAba3(620 bp)。 图 3 OXA-51、OXA-58和ISAba3基因组扩增产物电泳结果 Figure 3 Electropherogram of OXA-51,OXA-58 and ISAba3 genes amplification products。 |
选择基因组同时阳性菌株3株(B67、B121、B56),对其PCR扩增产物进行核苷酸序列分析,再将测序结果进行软件拼接,拼接结果在GenBank序列数据库进行比对,结果显示:B67的核苷酸序列从第1位到937位为插入序列ISAba1基因,从第972位到1734位为OXA-23基因;B121的核苷酸序列从第1到929位为插入序列ISAba1基因,从第964位到1726位为OXA-23基因;B56的核苷酸序列从第1到929位为插入序列ISAba1基因,从第964位到1710位为OXA-23基因。 2.2.2 OXA-51、OXA-58及ISAba3基因的测序结果
随机选取OXA-51、OXA-58和ISAba3基因的PCR扩增产物,送上海生工生物工程有限公司进行DNA测序,测序结果经GenBank同源性比较,分别与注册号为AY750908.1、JX968506.1和JX968506.1的鲍曼不动杆菌一致性为99%、99%和100%。
3 讨论近年来随着对鲍曼不动杆菌耐药机制的不断研究探讨,其所产的OXA型碳青霉烯酶越来越受到关注,其中报道较多的有OXA-23、OXA-51、OXA-58、OXA-24等,这些酶的分布存在着较为明显的地域差异 CanKaoWenXian_6 ,其中在我国鲍曼不动杆菌中OXA-23的检出率最高。张永等 [7]对亚胺培南耐药的鲍曼不动杆菌的耐药基因进行相关检测未发现VIM、IMP等B类金属酶基因和OXA-24相关的耐药基因,经PCR扩增、产物测序、等电聚焦电泳等分析手段发现其研究的细菌均产OXA-23型碳青霉烯酶,推测产OXA-23型碳青霉烯酶为其对亚胺培南耐药的主要原因。廖晚珍等 [8]对鲍曼不动杆菌进行耐药基因型分析也得到了与张永类似的结论,提示产OXA-23型碳青霉烯酶是其医院鲍曼不动杆菌对碳青霉烯类抗生素的主要耐药机制。本研究对200株鲍曼不动杆菌进行4种碳青霉烯酶基因检测,其中OXA-23基因检出率最高,共检出阳性菌株155株(77.5%),鉴于温州医科大学附属第一医院鲍曼不动杆菌大多带有OXA-23基因,该基因编码的碳青霉烯酶应该是该院鲍曼不动杆菌耐碳青霉烯类抗生素的一个主要原因。
在本研究中,我们共实现了200株细菌OXA-23、ISAba1和Ass基因的检测,完成3株测序,共拼接出OXA-23-ISAba1完整基因组3株。研究结果表明,这种根据基因组功能不同进行分段引物设计的方法,不仅可以完成单独功能基因的检测和测序,还能够拼接出功能基因组全长序列,对于微生物耐药基因组上下游功能基因的分析研究提供了良好的理论和实践基础。
2006年Feizabadi等 [9]首次报道了OXA-51组基因只分布于鲍曼不动杆菌,可作其检测的标志物,之后Woodford等 [10]、王贺等 [11]的报道支持了这一观点。本研究应用PCR技术对200株鲍曼不动杆菌的OXA-51组基因进行扩增,结果显示200株鲍曼不动杆菌均携带OXA-51组基因,提示OXA-51组基因扩增可作为快速鉴定鲍曼不动杆菌的手段。
目前国内对OXA-24组碳青霉烯酶报道较少,郭萍等 [12]对145株鲍曼不动杆菌进行检测,仅发现1株携带了OXA-24基因。本研究对200株鲍曼不动杆菌进行OXA-24组碳青霉烯酶基因检测,未发现OXA-24组基因阳性菌株,推测产OXA-24型碳青霉烯酶并非温州医科大学附属第一医院鲍曼不动杆菌主要耐药机制。
OXA-58组基因目前国内检出率较低,刘原等 [13]首次在国内报道了在鲍曼不动杆菌中检测到OXA-58组基因,郭萍等 [12]在对126株耐美罗培南的鲍曼不动杆菌中仅发现了3株携带OXA-58基因,李春等 [14]在42株鲍曼不动杆菌中检测到OXA-58基因阳性3株。本研究对200株鲍曼不动杆菌进行OXA-58基因检测,共发现8株携带OXA-58基因,检出率和国内其他报道基本相符。本研究200株鲍曼不动杆菌中共检出12株ISAba3基因阳性,其中8株OXA-58基因同时阳性,可见两者之间存在着较高的相关性。
| [1] | Grosso F,Quinteira S,Peixe L.Emergence of an extreme-drug-resist(XDR) Acineto-bacter baumannii carrying blaoxa-23 in a patient with acute necrohaemorrhagic pancreatitis[J].Hosp Infect,2010,8(2):123-126. |
| [2] | Chiu CH,Lee HY,Tseng LY,et al.Mechanisms of resistance to ciprofloxacin,ampi-cillin/sulbactam and imipenem in Acinetobacter baumannii clinical isolates in Taiwan[J].Int J Antimicrob Agents,2010,35(4):382-386. |
| [3] | Mendes RE,Bell JM,Turnidge JD,et al.Emergence and widespread dissemination of OXA-23,-24/40 and-58 carbapenemases among Acinetobacter spp in Asia-Pacific nation:report from the SENTRY surveillance program[J].J Antimicrob Chemother,2009,63(1):55-59. |
| [4] | Ye YW,Wang YS.The operation rules of clinical examination[M]. Nanjing: Southeast University Press,1997.(in Chinese) 叶应妩,王毓三.全国临床检验操作规程[M].3版. 南京:东南大学出版社,1997. |
| [5] | Xu XL,Ye M,Sun YQ,et al.Analysis of zymogenic state and in vitro antimicrobial agent combination activity against Acinetobacter baumannii[J].Chinese Journal of Infection control,2008,7(5):333-336.(in Chinese) 徐修礼,叶明,孙怡群,等.鲍曼不动杆菌的产酶现状及抗菌药物体外联合抗菌活性研究[J].中国感染控制杂志,2008,7(5):333-336. |
| [6] | Xie XJ,Wu SY,Wang C,et al.Incidence of Metallo-beta-lactamase-producing pseudomonas aeruginosa and their antibiotic resistance[J].Chinese Journal of Nosocomiology,2009,19(14):1882-1883.(in Chinese) 谢小军,吴少苑,王冲,等.产金属β内酰胺酶铜绿假单胞菌的检出率与药敏分析[J].中华医院感染学杂志,2009,19(14):1882-1883. |
| [7] | Zhang Y,Tang YC,Lu J,et al.Molecular mechanisms of imipenem resistance in Acinetobacter baumannii[J].Chinese Journal of Antibiotics,2005,30(4):217-221,240.(in Chinese) 张永,唐英春,陆坚,等.鲍曼不动杆菌对亚胺培南耐药分子机制的研究[J].中国抗生素杂志,2005,30(4):217-221,240. |
| [8] | Liao WZ,Xia GJ,Peng WH,et al.The test of gene of carbapenemases resistance Acinetobacter baumannii and the clinical significance[J].Chinese Journal of Clinical Laboratory Science,2007,25(6):456-457.(in Chinese) 廖晚珍,夏国际,彭卫华,等.耐碳青霉烯酶类抗生素鲍曼不动杆菌的基因检测与临床意义[J].临床检验杂志,2007,25(6):456-457. |
| [9] | Feizabadi MM,Fatbollahzadeh B,Taherikalani M,et al.Antimicrobial susceptibility patterns and distribution of blaOXA gene among Acinetobacter spp. isolated from patients at Tehran hospital[J].Jpn J Infect Dis,2008,61(4):274-278. |
| [10] | Woodford N,Ellington MJ,Coelho JM,et al.Multiplex PCR for genes encoding prevalent OXA carbapenemases in Acinetobacter spp.int[J].Int J Antimicrob Agents,2006,27(4):351-353. |
| [11] | Wang H,Wang H,Xu YC,et al.Evaluation of the value of an automatic bacteria identification system and blaOXA-51-like gene amplification in the identification of acinetobacter species[J].Chinese Journal of Laboratory Medicine,2009,32(1):83-87.(in Chinese) 王贺,王辉,徐英春,等.自动化细菌鉴定仪和碳青霉烯酶基因OXA-51扩增在不动杆菌属细菌鉴定中的价值[J].中华检验医学杂志,2009,32(1):83-87. |
| [12] | Guo P,Wang H,Chen R,et al.Wide dissemination of OXA-51-like type of carbapenemase in Acinetobacter baumannii[J].Chinese Journal of Laboratory Medicine,2007,30(5):505-509.(in Chinese) 郭萍,王辉,陈端,等.OXA-51样D类碳青霉烯酶在鲍曼不动杆菌中广泛分布[J].中华检验医学杂志,2007,30(5):505-509. |
| [13] | Liu Y,Tan XS,Han XP.Carbapenemases and homology of imipenem resistant Acinetobacter baumannii isolates in Xi'an[J].Chinese Journal of Infection and Chemotherapy,2009,9(1):37-41.(in Chinese) 刘原,谭湘淑,韩新鹏.西安地区耐亚胺培南鲍曼不动杆菌的碳青霉烯酶及同源性研究[J].中国感染与化疗杂志,2009,9(1):37-41. |
| [14] | Li C,Wang ZX,Shen JL.Detection of OXA carbapenemases and molecular mechanism in nosocomial outbreak caused by multidrug resistant Acinetobacter baumannii strains[J].Chinese Journal of Clinical Laboratory Science,2010,28(5):383-385.(in Chinese) 李春,王中新,沈继录.多药耐药鲍曼不动杆菌OXA酶检测及医院内感染的分子机制[J].临床检验杂志,2010,28(5):383-385. |
 2014, Vol. 29
2014, Vol. 29


