扩展功能
文章信息
- 徐德顺, 陈莉萍, 朱晓娟
- XU De-shun, CHEN Li-ping, ZHU Xiao-juan
- 应用双重实时荧光定量反转录-聚合酶链反应方法同时检测A组轮状病毒和星状病毒
- Simultaneous detection of rotavirus group A and astrovirus by multiplex real-time RT-PCR
- 疾病监测, 2014, 29(12): 983-986
- Disease Surveillance, 2014, 29(12): 983-986
- 10.3784/j.issn.1003-9961.2014.12.016
-
文章历史
- 收稿日期:2014-09-06
胃肠炎是人类最常见的一种疾病,在全球范围内被认为是一个严重的公众健康问题,也是引起婴幼儿发病和死亡的一个主要原因。随着抗生素的广泛应用,人们生活水平的提高,卫生条件的改善,细菌性腹泻得到了有效控制,病毒感染被认为是急性胃肠炎最常见的病原[1, 2]。目前,能引起人类急性胃肠炎的病毒主要包括轮状病毒(Rotavirus,RVs)、诺如病毒(Norovirus,NVs)、星状病毒(Astmvims,AVs)等。这类病毒均具有较强的离体存活力和感染性,一般10~200个病毒粒子即可引发感染[3]。人体被上述病毒感染后的临床症状相似,主要是呕吐和腹泻,与其他病原造成的胃肠炎症状也难以区别。监测是确定病原体、流行株、发现变异株、预测和防控疫情的基础。因此,为了能够准确、快速地分析并掌握流行概况,筛查可疑病例,明确优势毒株,笔者采用特异性的TaqMan探针,建立了可同时检测轮状病毒A群和星状病毒的双重实时荧光定量反转录-聚合酶链反应(real time fluorescent quantitative reverse transcription polymerase chain reaction,rRT-PCR)检测方法,并成功应用于临床粪便标本的检测。 1 材料与方法 1.1 病毒株与临床标本
脊髓灰质炎病毒、肠道腺病毒、新肠道病毒68、埃可30、柯萨奇A1以及柯萨奇B5病毒株皆由浙江省疾病预防控制中心(CDC)病毒研究所提供。轮状病毒A群、星状病毒、GⅠ和GⅡ型诺如病毒阳性标本有本中心收集并验证。
收集临床上有水样便至少24 h,伴有恶心、呕吐和发热等症状且被诊断为非细菌性胃肠炎患者腹泻样本128份。粪样收集后在24 h内运回实验室,用病毒采样液 MEM 稀释成10%的悬液,4 ℃、10 000 r/min离心取上清,-20 ℃保存待用。 1.2 主要试剂和仪器
M-MLV反转录酶、dNTP、RNasin、Pgem-T Easy载体试剂盒和 RiboMAX Large Scale RNA Production System-T7 体外转录试剂盒均购自美国Promega公司;病毒RNA/DNA提取试剂为Roche公司生产High Puer Viral Nucleic Acid Kit试剂盒;RNA检测试剂盒:TaKaRa One Step RNA PCR Kit 为宝生物工程(大连)有限公司产品。荧光定量PCR仪:ABI7500 rRT-PCR仪。 1.3 病毒定量标准与病毒核酸提取
分别将轮状病毒A群和星状病毒进行RT-PCR扩增,转化和增菌培养,提取质粒DNA并测序验证。纯化、定量后,作为轮状病毒A群和星状病毒的体外转录标准品。病毒核酸按试剂盒说明书提取。将提取好的核酸进行分装,与-80 ℃冻存,作为RT-PCR模板备用。 1.4 引物与探针设计
选取Noortje等[4]设计的特异性引物和TaqMan探针,并用Oligo6.0软件对其进行评价。委托宝生物工程(大连)有限公司合成。上游引物(F)、下游引物(R)和探针(P)序列如下:轮状病毒,F1:5′-ACC ATC TTC ACG TAA CCC TC-3′,F2:5′-ACCA TCT ACA CAT GAC CCT C-3′,R1:5′-CAC ATA ACG CCC CTA TAG CC-3′,P1:5′-HEX-CAC ATA ACG CCC CTA TAG CC-BHQ1-3′;星状病毒,F3:5′-TCT YAT AGA CCG YAT TAT TGG-3′R2:5′-TCA AAT TCT ACA TCA TCA CCA A-3′,P2: 5′-FAM-CCC CAD CCA TCA TCA TCT TCA TCA-BHQ1-3′。 1.5 双重rRT-PCR扩增体系和条件
经优化的RT-PCR反应扩增体系:2×RT-PCR buffer 12.5 μl;EX Taq HS 0.5 μl;RT Enzyme MixⅡ 0.5 μl;RVsF1、RVsF2、RVsR、AVsF、AVsR各0.6 μl;RVsP、AVsP各0.3 μl;模板5 μl,DEPC水补足至25 μl。优化后的反应循环条件:42 ℃ 30 min,95 ℃ 5 min;95 ℃ 15 s,55 ℃ 45 s,共40个循环。在55 ℃进行HEX和FAM荧光检测。 1.6 双重rRT-PCR检测体系的评价
用建立的双重rRT-PCR检测体系对上述10种病毒核酸进行检测,验证体系的特异性。同时对10倍梯度稀释 (107~101拷贝/μl)的轮状病毒A群和星状病毒体外转录的标准品平行进行单一rRT-PCR与双重rRT-PCR反应,比较其灵敏度,并构建标准曲线和重复实验验证体系的稳定性。 1.7 临床样品检测
用建立的双重rRT-PCR方法对128份临床粪便样本进行检测,同时用硕世生物科技有限公司生产的轮状病毒A群和星状病毒单重rRT-PCR方法同步进行检测。对阳性样品进行测序验证。 1.8 测序验证
阳性标本经反转录后,进行正反向测序,与美国国立生物信息中心(NCBI)进行比对验证。序列测定委托宝生物工程(大连)有限公司完成。 2 结果 2.1 方法的特异度
利用建立起的双重rRT-PCR反应体系对10种相关病毒核酸进行检测,其中腺病毒的检测采用TaKaRa公司的Premix Ex TaqTM(Perfct Real Time)试剂盒。结果显示:轮状病毒A群和星状病毒所在的HEX和FAM检测通道出现相应的特异性荧光扩增曲线,其他病毒均未见扩增曲线。证明检测方法具有良好的特异性。 2.2 标准曲线的建立和敏感性测定
用双重rRT-PCR法分别对107~101拷贝/μl的轮状病毒A群和星状病毒体外转录标准品进行定量检测,模板的梯度稀释PCR扩增曲线如图 1~2所示,建立的双重rRT-PCR方法检测轮状病毒最低检出限为101拷贝,星状病毒最低检出限为102拷贝。与单一rRT-PCR方法敏感性相当。将阳性梯度的模板浓度和对应的Ct值进行标准曲线计算,2种病毒对应的标准曲线分别为:轮状病毒:Y=-3.07lgX+40.76,质粒标准曲线的方差系数为0.998;星状病毒:Y=-3.29lgX+41.58,质粒标准曲线的方差系数为0.997,其中Y为对应Ct值,lgX病毒RNA拷贝数的对数值。
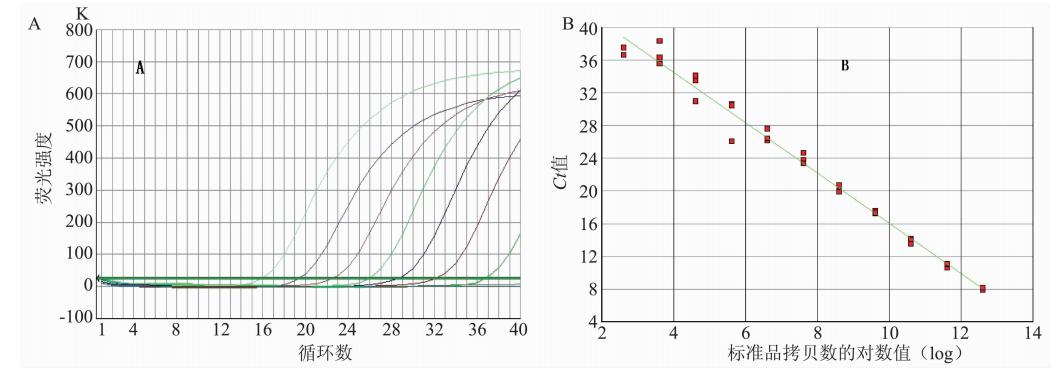 |
| 注:A.曲线从左到右依次代表浓度,分别为l×107,l×106,1×105、1×104、l×103、1×102、1×101拷贝/μl的标准品。 图 1 双重rRT-PCR检测轮状病毒A群核酸灵敏度和标准曲线 Figure 1 Sensitivity and standard curve of multiplex real-time RT-PCR assay to detect rotavirus group A |
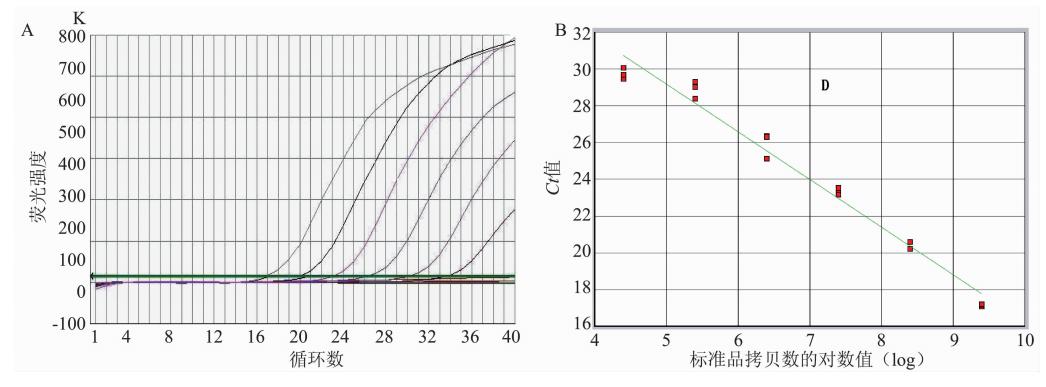 |
| 注:A. 曲线从左到右依次代表浓度,分别为l×107,l×106,1×105、1×104、l×103、1×102拷贝/μl的标准品。 图 2 双重rRT-PCR检测星状病毒核酸灵敏度和标准曲线 Figure 2 Sensitivity and standard curve of multiplex real-time RT-PCR assay to detect astrovirus |
取轮状病毒A群和星状病毒的4个不同浓度梯度(106、105、104和103拷贝/μl)的标准品,分别做3次重复试验,计算各检测项目的变异系数(CV/%),结果显示各稀释度的3个平行反应获得的Ct值变异系数均在2.0%以下,见表 1。
| 样本拷贝/μl | 重复性(Ct值) | Ct(x) | CV(%) | |||||||||||
| Ct1 | Ct2 | Ct3 | ||||||||||||
| RV | AV | RV | AV | RV | AV | RV | AV | RV | AV | |||||
| 106 | 19.20 | 20.46 | 19.18 | 20.32 | 19.12 | 20.30 | 19.17 | 20.36 | 0.21 | 1.91 | ||||
| 105 | 21.34 | 23.24 | 21.20 | 23.43 | 21.16 | 23.32 | 21.23 | 23.33 | 0.63 | 0.58 | ||||
| 104 | 24.58 | 26.75 | 24.32 | 26.23 | 24.42 | 26.46 | 24.44 | 26.48 | 0.76 | 1.98 | ||||
| 103 | 27.31 | 30.35 | 27.46 | 30.18 | 27.24 | 30.22 | 27.34 | 30.25 | 0.47 | 0.41 | ||||
采用本研究建立的双重rRT-PCR方法对128份临床腹泻标本进行检测,FAM和HEX通道均有扩增曲线,共27份(21.1%);在HEX通道呈现扩增曲线的为轮状病毒A群核酸阳性,共23份(18.0%);在FAM通道呈现扩增曲线的为星状病毒核酸阳性,共4份(3.1%)。用各自的单重rRT-PCR方法检测128份临床样本,结果检测到轮状病毒和星状病毒核酸阳性分别为23份和4份,单重和双重rRT-PCR方法检测结果一致。阳性样品经过测序,与NCBI进行比对,结果显示均为轮状病毒A群、星状病毒。 3 讨论
轮状病毒和星状病毒是世界范围内重要的胃肠炎病毒因子。人类轮状病毒A群已被确认为引起全世界婴幼儿急性胃肠炎最常见的原因,每年由轮状病毒引起的腹泻在世界范围内有14亿之多。星状病毒是仅次于轮状病毒引起婴幼儿病毒性胃肠炎的第2位病因,可散发或暴发流行 。由于这类病毒粒子在患者或无症状的携带者的粪便中被大量排放,污染食品、水和生活用品,导致病毒性腹泻的暴发流行,为防止病原更大规模扩散,需要短时间内作出准确诊断,阻断病原的传播。但腹泻病毒的传统检测方法在临床上存在诸多不足[7],rRT-PCR技术是采用荧光信号探针与实时定量检测相结合的核酸检测新技术,可对反应体系中的起始模板进行定量[8],因其灵敏度高,检测速度快,特异性强等优点,已在诺如病毒等病原体定量检测中得到了广泛的应用[9]。本研究建立的检测与鉴定轮状病毒A群和星状病毒双重rRT-PCR技术实现一管双检,有效地简化了实验过程,节省了实验试剂。
本研究建立的方法不仅能够在2~3 h内非常准确地检测与鉴定轮状病毒A群和星状病毒,而且与其单一rRT-PCR方法敏感度相当,最低检出限分别可达101拷贝和102拷贝。研究中建立的双重rRT-PCR定量标准曲线相关系数分别达到0.998和0.997,而且,同一稀释度重复3次Ct值的变异系数均>2.0%,说明此反应体系具有很高的精确度和良好的稳定性[10]。通过对10种相关病毒的检测结果显示,本研究所用的两套引物探针在双重PCR反应体系中无明显交叉反应,具有较好的特异性。
本研究建立的快速、准确、简便的轮状病毒A群和星状病毒双重rRT-PCR检测技术,为病毒性急性胃肠炎引起的腹泻及时防控和治疗赢得了时间,也可以应用于流行病学调查等研究,且双重rRT-PCR技术容易掌握,适合基层单位应用。
| [1] | Lopman BA,Reacher MH,Van Duijnhoven Y,et al.Viral gastroenteritis outbreaks in Europe,1995-2000[J].Emerg Infect Dis,2003,9(1):90-96. |
| [2] | Lopman B,vennema H,Kohli E,et al. Increase in viral gastroenteritis outbreaks in Europe and epidemic spread of new norovirus variant [J].Lancet,2004,363(9410):682-688. |
| [3] | Zeng JR,Li RJ,Chen YQ, et al. Construction and clinical application of a multiplex real-time reverse-transcript PCR for the detection of common diarrhea virus[J]. International Journal of Laboratory Medicine,2011,32(8):1461-1468.(in Chinese) 曾军荣,李榕娇,陈永强,等. 常见腹泻病毒多重荧光逆转录聚合酶链反应检测方法的建立及临床应用[J].国际检验医学杂志,2011,32(8):1461-1468. |
| [4] | Noortje M, van Maarseveen, Els Wessels, et al. Diagnosis of viral gastroenteritis by simultaneous detection of Adenovirus group F, Astrovirus, Rotavirus group A, Norovirus genogroups Ⅰ and Ⅱ, and Sapovirus in two internally controlled multiplex real-time PCR assays[J]. J Clin Virol,2010,49(3):205-210. |
| [5] | Kou XX, Wu QP, Wang DP, et al. Studies on simultaneous detection of three gastroenteritis virus in clinical samples by muptiplex RT-PCR[J]. Microbiology China,2007,34(3): 401-405. (in Chinese) 寇晓霞,吴清平,王大鹏,等. 多重RT-PCR 用于临床检测三种胃肠炎病毒的研究[J].微生物学通报,2007,34(3):401-405. |
| [6] | Jin Y, Zhang CF. Research progress of astrovirus infection[J]. Foreign Medical Pediatric Section,2002,29(1): 21-23. (in Chinese) 金玉,张春芳.星状病毒感染的研究进展[J].国外医学儿科学分册,2002,29(1):21-23. |
| [7] | Han Y,An SY,Wang ZS, et al. Research progress on detection methods of diarrhea virus[J].Chinese Journal of Health Laboratory Technology,2007,27(7):1323-1325. (in Chinese) 韩悦,安淑一,王作虪,等. 腹泻病毒检测方法的研究进展[J].中国卫生检验,2007,27(7):1323-1325. |
| [8] | Crotty PL,Staggs RA,Porer PT, et al. Quantitative analysis in molecular diagnostics[J]. Hum Pathol,1994,25(6):572-579. |
| [9] | Ji L,Han JK, Wu XF, et al.Simultaneous detection of Norovirus genogroup ⅠandⅡby multiplex real-time RT-PCR[J]. Chinese Journal of Zoonoses,2011,27(4):311-315. (in Chinese) 纪蕾,韩建康,吴晓芳,等.多重荧光RT-PCR同时检测GⅠ型和GⅡ型诺如病毒方法的建立[J].中国人兽共患病学报,2011,27(4):311-315. |
| [10] | Cheng XW, Wu CL,Lyu X, et al. Simultaneous and rapid detection of influenza virus A and B by fluorescent quantitative real-time PCR[J]. China Tropical Medicine,2005,5(9):1782-1785. (in Chinese) 程小雯,吴春利,吕星,等.荧光定量RT-PCR技术快速检测A、B型流感病毒的研究[J].中国热带医学杂志,2005,5(9):1782-1785. |
 2014, Vol. 29
2014, Vol. 29


