扩展功能
文章信息
- 郭倩, 李桂莲, 魏剑浩, 赵丽丽, 赵秀芹, 吴移谋, 万康林
- GUO Qian, LI Gui-lian, WEI Jian-hao, ZHAO Li-li, ZHAO Xiu-qin, WU Yi-mou, WAN Kang-lin
- 针对gyrA基因突变的反向斑点杂交技术快速检测结核分枝杆菌喹诺酮耐药性的研究
- Reverse dot blot hybridization of gyrA mutation for rapid detection of Mycobacterium tuberculosis resistance to quinolone
- 疾病监测, 2015, 30(3): 218-222
- Disease Surveillance, 2015, 30(3): 218-222
- 10.3784/j.issn.1003-9961.2015.03.013
-
文章历史
- 收稿日期:2014-11-26
2. 中国疾病预防控制中心传染病预防控制所, 传染病预防控制国家重点实验室, 北京 102206;
3. 感染性疾病诊治协同创新中心, 浙江 杭州 310003;
4. 温州医科大学检验医学院生命科学学院, 浙江 温州 325035
2. State Key Laboratory for Communicable Disease Prevention and Control, Institute for Communicable Disease Prevention and Control, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3. Collaborative Innovation Center for Infectious Disease Diagnosis/Treatment, Hangzhou 310003, Zhejiang, China;
4. Key Lab of Laboratory Medicine, Wenzhou Medical University, Wenzhou 325035, Zhejiang, China
近年来,耐多药结核病(multi-drug resistant tuberculosis,MDR-TB;指至少同时对利福平和异烟肼2种药物耐药)及广泛耐药结核病(extensively drug resistant tuberculosis,XDR-TB; 指耐多药结核分枝杆菌至少对任意1种氟喹诺酮类药物、3种二线注射药物卷曲霉素、卡那霉素和阿米卡星耐药)已成为结核病防治工作面临的严峻挑战[1]。据最新的全国结核病耐药基线调查报告显示,我国结核病患者中耐多药率为8.32%,广泛耐药率为0.68%,结核病耐药形势不容乐观[2]。因此快速、准确的药物敏感性检测方法对指导临床治疗、控制结核病流行具有极其重要的意义。目前临床上仍广泛采用以细菌培养为基础的传统药敏试验检测结核分枝杆菌的耐药性,药敏结果获得需要6~8周,不能及时有效的治疗结核病。随着现代分子生物学技术的发展,许多快速检测药物敏感性的技术得到发展和应用,反向斑点杂交技术(reverse dot blot hybridization,RDBH)就是其中之一。它的原理是将带有生物素标记的特异性引物扩增DNA模板,将扩增后的聚合酶链反应(polymerase chain reaction,PCR)产物与已通过共价键固定在膜上的寡核苷酸探针结合;通过链霉亲和素偶联的过氧化物酶和和显色剂结合,得到杂交信号,从而直观地判读结果。12~24 h内即可出结果,具有快速、灵敏、简便等特点[3],作为快速检测寡核苷酸突变及多态性分析的方法广泛用于分子生物学多个领域。
喹诺酮类药物由于其吸收好、不良反应少等特点已被广泛应用于抗结核治疗,然而,随着应用的扩大和不够规范的用药,导致耐药率日益增高[4]。据研究发现结核分枝杆菌DNA旋转酶A亚单位基因(gyrA)中的喹诺酮类药物耐药决定区(QRDR)突变导致DNA旋转酶发生构象改变被认为是喹诺酮耐药形成的主要原因[5, 6]。本研究拟用RDBH技术快速检测gyrA基因突变建立快速筛查喹诺酮类耐药结核分枝杆菌方法,并用测序及表型耐药检测方法对其进行评价。
1 材料与方法 1.1 材料 1.1.1 菌株来源结核分枝杆菌标准菌株H37Rv购自中国药品生物制品检定所,110株结核分枝杆菌临床分离株,包括59株喹诺酮耐药株和51株喹诺酮敏感株,由中国疾病预防控制中心(CDC)传染病预防控制所结核病室传代培养、保藏。
1.1.2 主要试剂及仪器药敏试验药物均购自Sigma公司。PCR引物及探针由上海生工生物工程技术有限公司合成。PCR试剂购自promega公司和赛百盛基因技术有限公司。产物送擎科生物技术有限公司测序。台式高速离心机、DNA自动扩增仪Eppendorf公司,凝胶成像系统英国Uni公司,斑点杂交器Immunetics公司,杂交箱Techne公司。
1.2 方法 1.2.1 比例法药敏试验采用比例法进行药物敏感性试验,含药培养基内药物终浓度分别为氧氟沙星(OFX)2 μg/ml、异烟肼 0.2 μg/ml、利福平 40 μg/ml、乙胺丁醇 2 μg/ml、链霉素 4 μg/ml[7]。
1.2.2 DNA模板的制备采用CTAB(十六烷基三甲基溴化铵,hexadecyltrimethy ammonium bromide)法提取结核分枝杆菌DNA,置-20 ℃保存备用[8]。
1.2.3 PCR扩增及测序用primer 5.0软件针对gyrA基因的QRDR进行引物设计,由上海生工生物工程技术有限公司合成。所用上游引物:5′-GAC TAT GCG ATG AGC GTG AT-3′;下游引物:5′-GGC TTC GGT GTA CCT CAT C-3′;扩增目的片段长度为303 bp,引物gyrA-F 5′端用生物素标记,利用生物学软件Blast对上述引物进行同源性分析,除结核分枝杆菌外,其他同源性均较低。PCR反应体系为50 μl体系,其中上、下游引物 2 μl(10 μmol/L),2 × Buffer 25 μl,MgCl2(25 mmol/L) 3 μl,GoTaq 热启动酶0.25 μl (6 U/μl),dNTP 1 μl(10 mmol/L),DNA模板1 μl (10~100 ng/μl),双蒸水定容至反应体积。扩增的反应条件为94 ℃预变性10 min;94 ℃ 1 min;57 ℃ 1 min;72 ℃ 1 min;35个循环;最后72 ℃延伸10 min后,在1.5%的琼脂糖凝胶中检测扩增产物后送擎科生物技术有限公司测序。
1.2.4 DNA序列分析将测序结果与结核分枝杆菌H37Rv(ATCC 27294)相应序列进行比对分析。
1.2.5 探针的设计与合成针对gyrA基因常见突变位点及突变类型设计了8条检测探针,序列见表1,其中包括1条野生型探针,7条突变型探针,5′端均用氨基标记,由上海生物工程技术有限公司合成。
| 探针 名称 | 密码子 | 基因型 | 序列 |
| pwt | 90~94 | 野生型 | C GCG TCG ATC TAC GAC A |
| pm1 | 90 | 突变型(GTG) | TC GTA GAT CGA CAC GTC G |
| pm2 | 91 | 突变型(CCG) | C GCG CCG ATC TAC GAC A |
| pm3a | 94 | 突变型(GGC) | GT GCC GTA GAT CGA CGC |
| pm3b | 94 | 突变型(GCC) | G TCG ATC TAC GCC ACC CTG |
| pm3c | 94 | 突变型(TAC) | ATC TAC TAC ACC CTG GTG C |
| pm3d | 94 | 突变型(AAC) | C GCG TCG ATC TAC AAC AC |
| pm3e | 94 | 突变型(CAC) | C GCG TCG ATC TAC CAC AC |
膜的制备:室温下用新鲜配制的16% (W/V) EDAC 孵育Biodyne C膜15 min以使膜活化;去离子水洗膜2 min,然后将膜置于miniblotter的支持垫上。用140 μl的0.5 mol/L NaHCO3 (pH 8.4)稀释探针至终浓度0.67 μmol/L。将NaHCO3稀释的探针依次加到miniblotter的槽中,室温下孵育10 min。吸去液体后,用新鲜配置的0.1 mol/L NaOH室温下孵育10 min。用2×SSPE/0.1% SDS在50 ℃洗膜5 min。杂交:在150 μl 2×SSPE/0.1% SDS中加入20 μl PCR产物。将稀释的PCR产物在100 ℃加热10 min,立即在冰上冷却。将膜和支持垫放入miniblotter,使槽和加入探针的方向垂直。将已冷却的PCR产物加到槽中,60 ℃杂交60 min。吸去样品,取出膜。洗膜:用2× SSPE/0.5% SDS在50 ℃洗膜两次,每次10 min。检测:5 μl streptavidin-Ap conjugate 加入20 ml 2× SSPE/0.5% SDS中,将膜置于此混合溶液中42 ℃孵育40 min。用2×SSPE/0.5% SDS在 42 ℃洗膜10 min,两次。用2×SSPE室温下洗膜5 min。将洗好的膜片夹入透明塑料片间,加入1.2 ml显色液(NBT/BCIP),Tris 1 ml,NBT、BCIP 100 μl,42 ℃避光显色约30 min,可见蓝紫色斑点,取出膜片,用蒸馏水漂洗后,晾干保存。结果判读:若野生型探针的杂交信号远强于突变型探针,说明该位点未发生突变,反之,判定该位点发生相应的突变。若野生型和突变型探针均未杂交显色,说明该位点突变类型未包含在所设计探针之中。
2 结果 2.1 表型药敏试验结果采用传统的细菌培养比例法检测本试验纳入得110株结核分枝杆菌临床分离株,59株对喹诺酮类药物氧氟沙星耐药,51株对氧氟沙星敏感。
2.2 DNA测序结果对gyrA基因测序,110株结核分枝杆菌临床分离株gyrA基因均发生95位密码子AGC→ACC突变,呈自然多态性。51株敏感株未发现其他基因突变。59株耐OFX菌株中,41株QRDR存在突变,总突变率为69.5%,其中90位点GCG-GTG 8株; 91位点TCG-CCG 6株;94位点具有6种突变类型。GAC→GCC和GAC→GGC为主要的突变类型,突变率分别为16.9%和15.3%;另外发现2株双位点突变,分别为Ala90Val+ Asp94Ala位点和Ser91Pro+ Asp94Ala位点,见表2。
| 突变位点 | 突变类型 | 突变 株数 | 突变率 (%) |
| 90 | GCG→GTG(Ala→Val) | 8 | 13.6 |
| 91 | TCG→CCG(Ser→Pro) | 6 | 10.1 |
| 94 | GAC→GGC(Asp→Gly) | 9 | 15.3 |
| 94 | GAC→GCC(Asp→Ala) | 10 | 16.9 |
| 94 | GAC→TAC(Asp→Tyr) | 3 | 5.1 |
| 94 | GAC→AAC(Asp→Asn) | 1 | 1.7 |
| 94 | GAC→CAC(Asp→His) | 1 | 1.7 |
| 94 | GAC→GTC(Asp→Val) | 1 | 1.7 |
| 90+94 | GCG→GTG(Ala→Val) GAC→GCC(Asp→Ala) | 1 | 1.7 |
| 91+94 | TCG→CCG(Ser→Pro) GAC→GCC(Asp→Ala) | 1 | 1.7 |
| 合计 | 41 | 69.5 |
见图1。
应用RDBH检测,51株敏感株菌野生型探针均杂交阳性,突变型探针均无杂交信号,判定为敏感株,59株耐药株中41株检测为阳性。与比例法结果比较,敏感度为69.49%(41/59),特异度为100%(51/51);而与DNA 测序结果比较,敏感度和特异度分别为97.56%(40/41)和98.55%(68/69),二者符合度达98.18%(108/110),见表3。
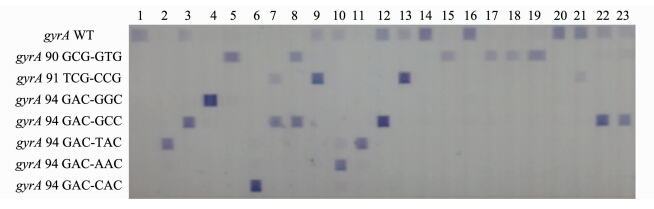
|
| 图 1 反向斑点杂交图谱 Fig.1 Reverse dot blot hybridization map 注:行:探针;1:H37Rv; 2~23:临床分离菌株。 菌株1、14、16、20、21与野生型探针杂交未突变;菌株5、15、17~19与pm1突变型探针杂交,突变类型为Ala90Val;菌株9、13与pm2突变型探针杂交,突变类型为Ser91Pro;菌株4与pm3a突变型探针杂交,突变类型为Asp94Gly;菌株3、12、22、23与pm3b突变型探针杂交,突变类型为Asp94Ala;菌株2、11与突变型探针pm3c杂交,突变类型为Asp94Tyr;菌株10与pm3d突变型探针杂交,突变类型为Asp94Asn;菌株6与pm3e突变型探针杂交,突变类型为Asp94His;菌株7与pm2、pm3b突变型探针杂交,突变类型为Ser91Pro、Asp94Ala;菌株8与pm1、pm3b突变型探针杂交,突变类型为Ala90Val、Asp94Ala。 |
| RDBH | gyrA基因测序 | OFX药敏结果 | ||
| 突变 | 未突变 | 耐药 | 敏感 | |
| 突变 | 40 | 1 | 41 | 0 |
| 未突变 | 1 | 68 | 18 | 51 |
| 合计 | 41 | 69 | 59 | 51 |
喹诺酮类药物是治疗结核病的二线药物,尤其是在治疗耐多药结核病MDR-TB(至少对异烟肼和利福平耐药的结核病)中发挥重要作用。现已证实,喹诺酮类药物主要作用于结核分枝杆菌的DNA旋转酶,阻碍DNA的复制和转录,从而导致DNA降解和细菌死亡。该酶以四聚体形式存在,由gyrA和gyrB基因编码。研究表明,73%~91%的基因突变主要集中于gyrA基因一段320 bp的核苷酸保守序列,即QRDR,因此gyrA基因突变被认为是喹诺酮类耐药形成的主要原因,而gyrB基因的改变通常只引起低水平耐药[4, 9, 10]。
测序结果显示,本次检测的59株耐药菌中有41株OFX耐药株QRDR存在基因突变,突变率为69.49%,略低于国内外相关研究[4, 11, 12],可能与区域性差异、样本选择、样本量大小等因素有关。41株gyrA基因突变株中,90位密码子发生 GCG→GTG突变的有8株,占13.6%,94位GAC→GCC、94位GAC→GGC 突变类型分别占16.9%、15.3%,说明此3种突变类型为gyrA基因的主要突变形式,与Takiff等[5]、Hu等[11]、Wang等[13]研究结果基本一致。另外,本研究还检测到2株双位点突变菌株,并能通过RDBH试验对此2株进行正确检测和判断,由此可见,在检测双突变位点上,RDBH技术仍具有很好的灵敏度。
反向斑点杂交技术用于结核分枝杆菌耐药性检测,目前国内外已有较多报道[14, 15, 16]。本研究显示,与传统药敏结果相比,RDBH试验的灵敏度为69.49%(41/59),特异度为100%(51/51)。结合测序结果分析,38株OFX耐药株的RDBH试验结果与测序结果完全一致,灵敏度和特异度分别为97.56%(40/41)和98.55%(68/69),二者符合度达98.18%。探究反向斑点杂交结果与表型药敏、测序结果不一致的原因,可能有以下几个方面:(1)本实验中有18株耐药菌株并没有发生突变,提示存在其他耐药机制和相关基因的可能性,如药物主动外排、膜通透性的改变和gyrB基因突变,有待进一步研究[17, 18];(2)DNA测序本身存在一定得漏检率,本试验中,有1株菌经测序无突变但pm3a突变型探针杂交阳性;(3)探针设计一定的局限性使“热点突变”区域内的个别突变类型未被检出,如一株菌的突变类型未包含在设计探针中,仅被判断为突变株。
世界卫生组织最新的结核病耐药监测指南中,传统药敏、液体药敏及分子线性探针被推荐为3种结核分枝杆菌药物敏感性试验检测方法[19]。传统药敏试验仍被作为金标准广泛用于临床,但其耗时长,结核病患者在初期得不到及时有效的治疗而延误病情。比较而言,MGIT 960液体自动培养法可在1~2周内获得结果,大大缩短了检测时间,却由于高昂的价格限制了其在结核病高发的发展中国家中的推广。分子线性探针,作为分子生物学快速发展中的产物,更具有广泛的临床应用前景。其中INNO-LiPA Rif. TB、GenoType MTBDRplus、Xpert MTB/RIF为目前成熟的商业方法,其最大的优势在于能从涂阳患者痰、支气管灌洗液、脑脊液等临床标本中直接进行检测,在一线药物中已经取得了良好的检测效果,几乎可以与表型试验相媲美,不过在二线抗结核药物中应用较少,因此本研究应用膜反向斑点杂交技术检测喹诺酮耐药性具有较大应用价值[20, 21]。RDBH技术是一种建立在PCR的基础上的对已知突变基因检测的方法[22, 23]。该方法具有快速、简便、经济、高效的特点,不需要昂贵的仪器设备,可一次性检测45个样本,对喹诺酮耐药菌株有70%左右的检出率,当然,这需要进一步扩大样本量进行验证。值得注意的是,RDBH的检出率与探针设计、杂交温度、洗膜液离子浓度密切相关,在前期试验中必须不断对探针、反应条件进行优化。在以后的研究中,可通过进一步扩大探针覆盖范围,优化反应条件,以达到更理想的效果。尽管RDBH技术相比于传统药敏方法有一定的优势,但本研究只能应用该方法对结核菌培养物进行检测,如何从痰标本中提取DNA模板并用RDBH技术对其直接进行分子检测,从而更快速的筛查耐药结核分枝杆菌是下一步研究的主要内容。
| [1] | WHO. Global tuberculosis report 2013[R]. Geneva: World Health Organization,2013. |
| [2] | Zhao YL, Xu SF, Wang LX, et al. National survey of drug-resistant tuberculosis in China[J]. N Engl J Med,2012,366(23):2161-2170. |
| [3] | Suresh N, Singh UB, Arora J, et al. Rapid detection of rifampicin-resistant Mycobacterium tuberculosis by in-house, reverse line blot assay[J]. Diagn Microbiol Infect Dis,2006,56(2):133-140. |
| [4] | Huang T-S, Kunin CM, Shin-Jung Lee S, et al. Trends in fluoroquinolone resistance of Mycobacterium tuberculosis complex in a Taiwanese medical centre: 1995-2003[J]. J Antimicrob Chemother,2005,56(6):1058-1062. |
| [5] | Takiff HE, Salazar L, Guerrero C, et al. Cloning and nucleotide sequence of Mycobacterium tuberculosis gyrA and gyrB genes and detection of quinolone resistance mutations[J]. Antimicrob Agents Chemother,1994, 38(4):773-780. |
| [6] | Mokrousov I, Otten T, Manicheva O, et al. Molecular characterization of ofloxacin-resistant Mycobacterium tuberculosis strains from Russia[J]. Antimicrob Agents Chemother,2008,52(8):2937-2939. |
| [7] | Canetti G, Froman S, Grosset J, et al. Mycobacteria: laboratory methods for testing drug sensitivity and resistance[J]. Bull World Health Organ,1963, 29(5):565-578. |
| [8] | Yu Q, Su YK, Lu B, et al. Genetic diversity of Mycobacterium tuberculosis isolates from Inner Mongolia, China[J]. PLoS One,2013,8(5):e57660. |
| [9] | Yin XM, Yu ZX. Mutation characterization of gyrA and gyrB genes in levofloxacin-resistant Mycobacterium tuberculosis clinical isolates from Guangdong province in China[J]. J Infect,2010,61(2):150-154. |
| [10] | Salah Eldin A, Mostafa NM, Mostafa SI. Detection of fluoroquinolone resistance in Mycobacterium tuberculosis clinical isolates as determined by gyrA/B gene mutation by using PCR technique[J]. Egyptian J Chest Dis Tubercul,2012,61(4):349-353. |
| [11] | Hu Y, Hoffner S, Wu L, et al. Prevalence and Genetic Characterization of Second-Line Drug-Resistant and Extensively Drug-Resistant Mycobacterium tuberculosis in Rural China[J]. Antimicrob Agents Chemother,2013,57(8):3857-3863. |
| [12] | Rodwell TC, Valafar F, Douglas J, et al. Predicting extensively drug-resistant Mycobacterium tuberculosis phenotypes with genetic mutations[J]. J Clin Microbiol,2014,52(3):781-789. |
| [13] | Wang HY, Zhang XC, Luo T, et al. Prediction of XDR/pre-XDR tuberculosis by genetic mutations among MDR cases from a hospital in Shandong, China[J]. Tuberculosis,2014,94(3):277-281. |
| [14] | Lin M, Zhu JJ, Wang Q, et al. Development and evaluation of a reverse dot blot assay for the simultaneous detection of common alpha and beta thalassemia in Chinese[J]. Blood Cells Mol Dis,2012,48(2):86-90. |
| [15] | Ajbani K, Shetty A, Mehta A, et al. Rapid diagnosis of extensively drug-resistant tuberculosis by use of a reverse line blot hybridization assay[J]. J Clin Microbiol,2011,49(7):2546-2551. |
| [16] | Yang YP, Corley N, Garcia-Heras J. Reverse dot-blot hybridization as an improved tool for the molecular diagnosis of point mutations in congenital adrenal hyperplasia caused by 21-hydroxylase deficiency[J]. Mol Diagn,2001,6(3):193-199. |
| [17] | Singh M, Jadaun GP, Ramdas, et al. Effect of efflux pump inhibitors on drug susceptibility of ofloxacin resistant Mycobacterium tuberculosis isolates[J]. Indian J Med Res,2011,133: 535-540. |
| [18] | Kim H, Nakajima C, Yokoyama K, et al. Impact of the E540V amino acid substitution in GyrB of Mycobacterium tuberculosis on quinolone resistance[J]. Antimicrob Agents Chemother,2011,55(8):3661-3667. |
| [19] | Zignol M, van Gemert W, Falzon D, et al. Surveillance of anti-tuberculosis drug resistance in the world: an updated analysis,2007-2010[J]. Bull World Health Organ,2012,90: 111-119D. |
| [20] | Zeka AN, Tasbakan S, Cavusoglu C. Evaluation of the GeneXpert MTB/RIF assay for rapid diagnosis of tuberculosis and detection of rifampin resistance in pulmonary and extrapulmonary specimens[J]. J Clin Microbiol,2011,49(12):4138-4141. |
| [21] | Skenders GK, Holtz TH, Riekstina V, et al. Implementation of the INNO-LiPA Rif. TB® line-probe assay in rapid detection of multidrug-resistant tuberculosis in Latvia[J]. Int J Tuberc Lung Dis,2011,15(11):1546-1552. |
| [22] | Wu XQ, Zhang JX, Chao LX, et al. Identification of rifampin-resistant genotypes in Mycobacterium tuberculosis by PCR-reverse dot blot hybridization[J]. Mol Biotechnol,2009,41(1):1-7. |
| [23] | Mokrousov I, Bhanu NV, Suffys PN, et al. Multicenter evaluation of reverse line blot assay for detection of drug resistance in Mycobacterium tuberculosis clinical isolates[J]. J Microbiol Methods,2004,57(3):323-335. |
 2015, Vol. 30
2015, Vol. 30


