扩展功能
文章信息
- 屠丽红, 张曦, 陈洪友, 宋元君, 陈敏
- TU Li-hong, ZHANG Xi, CHEN Hong-you, SONG Yuan-jun, CHEN Min
- 2005-2014年上海市O139群霍乱弧菌的分子特征和耐药性研究
- Molecular characteristics and antibiotic resistance of Vibrio cholerae O139 in Shanghai,2005-2014
- 疾病监测, 2015, 30(3): 223-227
- Disease Surveillance, 2015, 30(3): 223-227
- 10.3784/j.issn.1003-9961.2015.03.014
-
文章历史
- 收稿日期:2014-12-22
霍乱弧菌是一种革兰阴性细菌,根据O抗原的不同分为210多个血清群,O1和O139群产毒株是引起霍乱流行的主要血清型菌株[1]。1993年5月,我国新疆局部地区首次出现O139群霍乱弧菌暴发性流行,随后内地一些地区以及东南沿海地区出现流行或散发,而且从一些水体和食品中也分离到O139群菌株[2]。1962年O1群埃尔托型霍乱弧菌传入上海,霍乱开始流行。随着霍乱弧菌的流行蔓延,上海市共经历3次流行高峰,主要出现在20世纪60年代、70年代末至80年代以及90年代。1994年在上海市发现了首例O139群霍乱病例,之后发生多起散发O139群霍乱疫情。自1994年后上海市出现多菌群(型)混合流行的局面。2005年后O139群霍乱弧菌为该市优势菌群,O1群霍乱弧菌以引起散发腹泻病例为主。
本研究对2005 -2014年上海市分离的O139群霍乱弧菌菌株进行分子特征和耐药性研究,包括毒力及相关基因检测、脉冲场凝脉电泳 (pulsed field gelelectrophoresis,PFGE)、多位点序列分型(multilocus sequence typing,MLST)和药物敏感试验,为上海市霍乱防控提供技术依据。
1 材料与方法 1.1 材料 1.1.1 菌株来源收集上海市自2005-2014年霍乱疫情及外环境(水体)和食品(水产)监测中分离的O139群霍乱弧菌86株。所有菌株经分离纯化后储存于甘油肉汤中于-80 ℃保存,其中分离自患者的菌株共44株,占51.2%;水产36株,占41.9%;水体6株,占6.9%,见表1。PFGE分型标准菌株为沙门菌H9812,药敏实验质控菌株为大肠埃希菌ATCC 25922,为本实验室自行保存。
| 年份 | 菌株来源 | 总计 | ||
| 患者 | 水产 | 水体 | ||
| 2005 | 19 | 9 | 0 | 28 |
| 2006 | 3 | 1 | 1 | 5 |
| 2007 | 1 | 2 | 2 | 5 |
| 2008 | 6 | 1 | 0 | 7 |
| 2009 | 4 | 3 | 1 | 8 |
| 2010 | 1 | 4 | 0 | 5 |
| 2011 | 1 | 1 | 1 | 3 |
| 2012 | 4 | 11 | 1 | 16 |
| 2013 | 4 | 4 | 0 | 8 |
| 2014 | 1 | 0 | 0 | 1 |
| 合计 | 44 | 36 | 6 | 86 |
双洗平板购自上海市疾病预防控制中心(CDC)培养基供应中心;革兰阴性鉴定板条购自法国生物梅里埃公司;霍乱弧菌诊断血清购自中国药品生物制品检定所;药敏纸片、MH琼脂购自英国Oxiod公司;限制性内切酶XbaⅠ、NotⅠ、100 bp DNA Ladder Marker、Taq Premix、琼脂糖购自宝生物工程(大连)有限公司;Seakem Gold低熔点琼脂糖购自美国Cambrex Bio Science Rockland公司;细菌基因组DNA提取试剂盒(QIAmp DNA Mini Kit)购自Qiagen公司。引物序列由上海生工生物工程有限公司完成。
1.1.3 主要仪器设备PCR基因扩增仪(Bio-Rad DNA Engine Dyad)、脉冲场凝胶电泳仪(Bio-Rad CHEF Mapper)、凝胶成像系统(Bio-Rad GEL Doc2000)。
1.2 方法 1.2.1 菌株复苏及鉴定甘油肉汤中于-80 ℃保存的菌株,接种于双洗平板进行分离培养。所有菌株按照WS 289-2008《霍乱诊断标准》方法进行生化和血清学鉴定。
1.2.2 毒力及相关基因检测菌株37 ℃培养过夜,使用细菌基因组DNA抽提试剂盒提取基因组DNA,-20 ℃保存。对86株霍乱弧菌进行6种毒力及相关基因分析,包括霍乱毒素基因(ctxA)、溶血素基因(hlyA)、毒素协调菌毛基因(tcpA)、调控蛋白基因(toxR)以及编码霍乱毒素基因的CTXφ基因组基因(zot、ace),根据参考文献合成引物序列[3, 4, 5]。扩增条件:94 ℃预变性2 min;94 ℃ 1 min,56 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃,4 min。扩增产物用0.5×TBE配制的1%含Goldview染液的琼脂糖凝胶中电泳,以100 bp DNA Ladder Marker为参照,于凝胶成像系统中观察结果。
1.2.3 PFGE分型按照PulseNet监测网络中霍乱弧菌PFGE标准分型方法(NotⅠ 酶切)[6]。PFGE图像应用BioNumerics软件(Version 6.0,Applied Maths)处理,聚类方法采用非加权组平均法(UPGMA)。
1.2.4 MLST按照http://pubmlst.org/vcholera/标准操作。引物序列合成参考标准操作。扩增条件:94 ℃预变性2 min;94 ℃ 1 min,56 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃,4 min。扩增产物送至上海伯臻生物科技有限公司进行双向测序。将测序拼接产物在http://pubmlst.org/vcholerae/分别进行7种管家基因比对,并比较获得相应ST型别。
1.2.5 药物敏感试验采用世界卫生组织(WHO)推荐的改良K-B纸片法。抗菌药物包括头孢曲松、强力霉素、诺氟沙星、环丙沙星、复方新诺明、丁胺卡那霉素、四环素、氯霉素、萘啶酸、氨苄西林、庆大霉素。质控菌株大肠埃希菌ATCC 25922为上海市CDC中心实验室提供,结果判断按照美国临床和实验室标准化协会(CLSI)标准。
2 结果 2.1 毒力及相关基因特征对86株霍乱弧菌进行毒力基因分析,结果显示共有62株产毒株,24株非产毒株。其中患者来源O139群霍乱弧菌菌株93.2%(41/44)为产毒株,水产来源菌株58.3%(21/36)为产毒株,6株水体来源菌株均为非产毒株。产毒株的6种毒力基因及相关基因均为阳性,非产毒株仅hlyA毒力基因和toxR调控基因阳性。
2.2 对86株O139群霍乱弧菌进行PFGE分型(NotⅠ 酶切)共分为35个型别,见图1。其中44株患者来源菌株共分为21个型别,36株水产来源菌株共分为16个型别,水体来源菌株为6个不同的型别。有6个带型的菌株分别来自水产和患者,KZGN11.SH0019带型菌株分别来自水产和水体,KZGN11.SH0033带型菌株分别来自患者和水体。不同的年份有部分菌株有相同的PFGE带型。
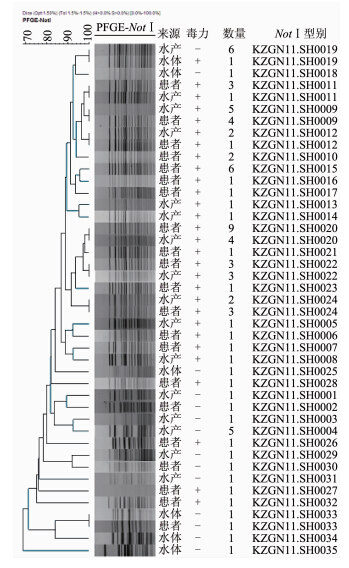
|
| 图 1 O139群霍乱弧菌PFGE分型 Fig.1 PFGE types of V. cholerae O139 strains |
共分为9个ST型。 其中患者来源的41株O139群霍乱弧菌产毒株和水产来源的21株产毒株的ST型一致,均为ST 69型。此ST型别和1992年印度流行的O139群菌株MO45及第7次大流行的孟加拉国大流行株N16961 ST型别一致[7, 8]。1株患者来源非产毒株、7株水产来源非产毒株和2株水体来源非产毒株ST型一致,均为ST 162型,见表2。其余非产毒株均为不同的其他ST型别,型别较为分散。
| 菌株 | 患者 | 水产 | 水体 | ||
| 产毒 | 非产毒 | 产毒 | 非产毒 | 非产毒 | |
| 数量 | 41 | 1 | 21 | 7 | 2 |
| adk | 7 | 26 | 7 | 26 | 26 |
| gyrb | 11 | 5 | 11 | 5 | 5 |
| mdH | 4 | 45 | 4 | 45 | 45 |
| metE | 37 | 50 | 37 | 50 | 50 |
| pntA | 12 | 31 | 12 | 31 | 31 |
| purM | 1 | 1 | 1 | 1 | 1 |
| pyrC | 20 | 45 | 20 | 45 | 45 |
| ST | 69 | 162 | 69 | 162 | 162 |
86株O139群霍乱弧菌经11种抗菌药物敏感性试验检测,结果显示产毒株的耐药情况比非产毒株严重。O139群霍乱弧菌产毒株对强力霉素、复方新诺明、四环素、萘啶酸、氨苄西林、庆大霉素的耐药率为51.6%~90.3%不等。非产毒株对萘啶酸的耐药严重,为95.8%,其余10种药物的敏感率为83.3%~100%不等,见表3。患者来源3株O139群霍乱弧菌非产毒株对复方新诺明和萘啶酸为100%耐药。
| 药物 | 产毒株(n=62) | 非产毒株(n=24) |
| 头孢曲松 | 0.0 | 0.0 |
| 强力霉素 | 85.5 | 8.3 |
| 诺氟沙星 | 4.8 | 16.7 |
| 环丙沙星 | 1.6 | 16.7 |
| 复方新诺明 | 90.3 | 54.2 |
| 丁胺卡那霉素 | 0.0 | 0.0 |
| 四环素 | 80.6 | 8.3 |
| 氯霉素 | 24.2 | 12.5 |
| 萘啶酸 | 82.3 | 95.8 |
| 氨卞西林 | 59.7 | 16.7 |
| 庆大霉素 | 51.6 | 8.3 |
本研究将2005-2014年上海市霍乱疫情及外环境(水体)和食品(水产)监测中分离的O139群霍乱弧菌菌株进行整理和分析。对86株O139群霍乱弧菌进行毒力及相关基因特征分析、PFGE分型、MLST分型和药物敏感试验。研究发现引起霍乱病例的O139群霍乱弧菌主要为产毒株,但患者来源菌株中仍有6.8%的菌株为非产毒株,提示O139群霍乱弧菌非产毒株仍可致病,表明霍乱弧菌可能存在霍乱毒素以外的致病机制。本研究的患者来源非产毒株中的1株菌株同时产生褐色色素,王瑞白等[9]研究发现产色素的非产毒O139群霍乱弧菌在环境中有更强的生存能力。此类O139群霍乱弧菌可能通过溶原性噬菌体CTXφ 介导的霍乱毒素基因水平转移,在这类菌株获得毒素基因后,有可能基于其更强的环境适应能力而成为新的流行克隆群,在霍乱弧菌的环境监测中需提高对这类菌株的关注。
PFGE是基于细菌全基因组的分子分型方法,在霍乱分型的应用中显示了更强的分辨力和流行病学调查能力[10, 11, 12]。本研究利用PFGE分型方法对上海市的O139群霍乱弧菌进行分型,显示患者来源菌株和水产来源菌株带型一致,遗传相关性较近,来自同一克隆系,同时上海市的多起霍乱疫情流行病学调查显示均为食源性感染[13, 14],提示该市多起霍乱疫情的传染源是被O139群霍乱弧菌污染的水产,提示在霍乱防治工作中应持续加强对水产品的监测,并及时进行O139群霍乱弧菌的PFGE分型监测。研究中发现不同年份霍乱疫情中的菌株有相同的PFGE带型,提示有相同基因特征的菌株持续存在引起新的病例[15],对此类分子型别的菌株应引起注意,防止引起霍乱暴发流行的发生。
MLST分型显示近10年来O139群霍乱弧菌和早期在印度流行的O139群霍乱弧菌基因组成相似[8],证实了O139群霍乱弧菌管家基因随着时间的迁移存在一定的稳定性。研究也发现O139群霍乱弧菌产毒株和O1群霍乱弧菌产毒株的MLST型别高度一致,提示O139群霍乱弧菌产毒株可能起源于EVC产毒株。由于霍乱弧菌产毒株存在高度克隆化,产毒株之间的基因差异不大,因此MLST分型方法不适用于对霍乱弧菌产毒株的分子分型研究。
随着抗生素的滥用,细菌耐药现象日益严重。同样水产养殖业利用抗生素防止水产养殖病害的发生,导致水产品细菌的耐药严重[16]。连续10年的药物敏感试验显示O139群霍乱弧菌对强力霉素、复方新诺明、四环素、萘啶酸保持着较高的耐药率,并对诺氟沙星和环丙沙星开始出现耐药,头孢曲松和丁胺卡那霉素对O139 群霍乱弧菌保持较高的敏感性。本研究的耐药监测结果与Yu等[17]对全国的O139群霍乱弧菌的耐药结果一致,研究中发现患者来源O139群霍乱弧菌非产毒株和患者来源O139群霍乱弧菌产毒株相比仅对复方新诺明和萘啶酸高度耐药,显示上海市O139群霍乱弧菌产毒株耐药严重,并存在多重耐药问题,提示在霍乱防治工作中,应进一步加强对O139群霍乱弧菌的耐药监测,掌握O139群霍乱弧菌的耐药谱变化。
| [1] | Xiao DL. Cholera prevention and control of manual[M]. sixth edition. Beijing: People's Medical Publishing House,2013.(in Chinese) 肖东楼. 霍乱防治手册[M]. 6版. 北京: 人民卫生出版社,2013. |
| [2] | Waldor MK, Mekalanos JJ. Lysogenic conversion by a filamentous phage encoding cholera toxin[J]. Science,1996, 272(5270):1910-1914. |
| [3] | Fields PI, Popovic T, Wachsmuth K, et al. Use of polymerase chain reaction for detection of toxigenic Vibrio cholerae O1 strains from the Latin American cholera epidemic[J]. J Clin Microbiol,1992, 30(8):2118-2121. |
| [4] | Singh DV, Isac SR, Colwell RR. Development of a hexaplex PCR assay for rapid detection of virulence and regulatory genes in Vibrio cholerae and Vibrio mimicus [J]. J Clin Microbiol,2002,40(11):4321-4324. |
| [5] | Rivera IN, Chun J, Huq A, et al. Genotypes associated with virulence in environmental isolates of Vibrio cholerae[J]. Appl Environ Microbiol,2001,67(6):2421-2429. |
| [6] | Centers for Disease Control and Prevention. Rapid Standardized Laboratory Protocol for Molecular Subtyping of Vibrio cholerae by Pulsed Field Gel Electrophoresis(PFGE)[EB/OL].(2006-03-09).[2014-10-21]. http://www.cdc.gov/pulsenet/protocols/vibrio_May2006.pdf. |
| [7] | Octavia S, Salim A, Kurniawan J, et al. Population structure and evolution of non-O1/non-O139 Vibrio cholerae by multilocus sequence typing[J]. PLoS One,2013,8(6):e65342. |
| [8] | Zhang P, Zhou HJ, Diao BW, et al. A molecular surveillance reveals the prevalence of Vibrio cholerae O139 isolates in China from 1993 to 2012[J]. J Clin Microbiol,2014,52(4):1146-1152. |
| [9] | Wang RB, Kan B. Clonality of pigment producing O139 Vibrio cholerae strains isolated in outer environment[J]. Disease Surveillancel,2012,27(3):177-180.(in Chinese) 王瑞白, 阚飙. 产色素O139群霍乱弧菌环境分离株的亲缘关系分析[J]. 疾病监测,2012,27(3):177-180. |
| [10] | Yang M, Yuan H, Zhang JY, et al. Molecular typing analysis of Vibrio cholerae isolates from outbreaks and routine surveillance in Jiangxi province[J]. Chinese Journal of Epidemiology,2006,27(11):1008-1009.(in Chinese) 杨梦,袁辉,张京云,等. 应用脉冲场凝胶电泳技术对江西省霍乱暴发和常规监测菌株的分析[J]. 中华流行病学杂志,2006,27(11):1008-1009. |
| [11] | Yang XR, Xu YF, Feng ZH, et al. Analysis on toxin gene and pulsed-field gel electrophoresis of cholera of Sichuan province in 2006[J]. Journal of Preventive Medicine Information,2007,23(6):691-694.(in Chinese) 杨小蓉,徐耀方,冯泽惠,等. 2006年四川省部分地区霍乱弧菌毒力基因检测和脉冲场凝胶电泳分型分析[J]. 预防医学情报杂志,2007,23(6):691-694. |
| [12] | Chen AP, Yang JS, Li QW, et al. Association of PFGE with strains' epidemic capacity in Vibrio cholerae O1 serogroup isolates[J]. Chinese Journal of Zoonoses,2014,30(3):259-262.(in Chinese) 陈爱平,杨劲松,李曲文,等. O1群霍乱弧菌PFGE分子分型和菌株流行能力关系研究[J]. 中国人兽共患病学报,2014,30(3):259-262. |
| [13] | Tu LH, Chen HY, Chen M. Study on 14 Vibrio cholerae O139 strains by PFGE and ribotyping in Chongming, Shanghai[J]. Disease Surveillance,2011,26(2):159-160,168.(in Chinese) 屠丽红,陈洪友,陈敏. 利用脉冲场凝胶电泳及核糖体分型技术对14株上海崇明地区O139群霍乱弧菌分型分析[J]. 疾病监测,2011,26(2):159-160,168. |
| [14] | Tu LH, Lu CX, Chen M. The report of food infection caused by Vibrio cholerae O139[J]. Chinese Journal of Health Laborabory Technology,2008,18(11):2381-2382.(in Chinese) 屠丽红,陆春香,陈敏. 一起O139群霍乱弧菌引起的食品感染调查报告[J]. 中国卫生检验杂志,2008,18(11):2381-2382. |
| [15] | Yuan YQ, Lyu H, Zhou HJ, et al. Molecular characteristics and antibiotic resistance of Vibrio cholerae O139 in Shandong province[J]. Chinese Journal of Preventive Medicine,2014,48(6):456-460.(in Chinese) 袁玉起,吕慧,周海健,等. 山东省O139群霍乱弧菌的分子特征及耐药性研究[J]. 中华预防医学杂志,2014,48(6):456-460. |
| [16] | Wang RX, Geng YJ, Wang JY, et al. Antibiotic resistant genes in aquacultural bacteria[J]. Marine Environmental Science,2012,31(3):323-328.(in Chinese) 王瑞旋,耿玉静,王江勇,等. 水产致病菌耐药基因的研究[J]. 海洋环境科学,2012,31(3):323-328. |
| [17] | Yu L, Zhou YY, Wang RB, et al. Multiple antibiotic resistance of Vibrio cholerae serogroup O139 in China from 1993 to 2009[J]. PLoS One,2012,7(6):e38633. |
 2015, Vol. 30
2015, Vol. 30


