扩展功能
文章信息
- 杜进发, 钟革, 杨仁聪, 邓秋云, 董爱虎
- DU Jin-fa, ZHONG Ge, YANG Ren-cong, DENG Qiu-yun, DONG Ai-hu
- 2013年广西壮族自治区疑似预防接种异常反应监测结果分析
- Surveillance for adverse events following immunization in Guangxi,2013
- 疾病监测, , 30(4): 291-295
- Disease Surveillance, , 30(4): 291-295
- 10.3784/j.issn.1003-9961.2015.04.012
-
文章历史
- 收稿日期:2014-09-17
2008年广西壮族自治区(广西)按照全国的统一部署实施儿童扩大免疫规划,疫苗种类大幅度增加,而免疫规划针对传染病得到有效控制,人们对疑似预防接种异常反应(adverse events following immunization,AEFI)的关注也在增加。开展 AEFI 监测有助于及时发现 AEFI 的发生原因,改善预防接种服务质量,增强公众对预防接种的信心,减少 AEFI 对免疫规划工作的负面影响。现将广西 2013 年 AEFI 监测结果分析如下。
1 材料与方法 1.1 资料收集方法 1.1.1 AEFI 监测范围[1]AEFI 监测覆盖接种国家免疫规划(national immunization program,NIP)疫苗和非NIP疫苗的所有人群。
本研究中 AEFI 是指预防接种过程中或接种后发生的、可能造成受种者机体组织器官或功能损害,且怀疑与预防接种有关的反应。需报告的 AEFI 包括无菌性脓肿、热性惊厥、过敏性休克、过敏性皮疹、过敏性紫癜、血小板减少性紫癜、局部过敏坏死反应(arthus 反应)、血管性水肿、其他过敏性反应、多发性神经炎、臂丛神经炎、癫痫、脑病、脑炎和脑膜炎、疫苗相关麻痹型脊髓灰质炎(脊灰)(vaccine-associated paralytic poliomyelitis,VAPP)、卡介苗(bacillus calmette guerin,BCG)淋巴结炎、BCG 骨髓炎、全身播散性BCG 感染、局部化脓性感染(局部脓肿、淋巴管炎和淋巴结炎、蜂窝织炎)、全身化脓性感染(毒血症、败血症、脓毒血症)、晕厥、癔症、发热(腋温≥ 38.6 ℃)、局部红肿(直径>2.5 cm)、局部硬结等。
1.1.2 AEFI 报告方式[1]医疗机构、预防接种单位等发现AEFI 后,及时向县(区、市,下同)级疾病预防控制中心(CDC)报告,县级 CDC 将 AEFI 个案报告和个案调查数据通过全国 AEFI 监测网络报告系统报告。
1.1.3 AEFI 发生原因分类[1] 1.1.3.1 不良反应①一般反应:在预防接种后发生的、由疫苗本身所固有的特性引起的、对机体只会造成一过性生理功能障碍的反应,主要有发热,局部红肿、硬结,同时可能伴有全身不适、倦怠、食欲不振、乏力等症状。②异常反应:合格的疫苗在实施规范接种过程中或接种后,造成受种者机体组织器官、功能损害,相关各方均无过错的药品不良反应。
1.1.3.2 疫苗质量事故由于疫苗在生产过程中质量不合格,接种后造成受种者机体组织器官、功能损害。
1.1.3.3 接种事故由于在预防接种实施过程中违反预防接种工作规范、免疫程序、疫苗使用指导原则、接种方案,造成受种者机体组织器官、功能损害。
1.1.3.4 偶合症受种者在接种时处于某种疾病的潜伏期或前驱期,接种后偶合发病。
1.1.3.5 心因性反应在预防接种实施过程中或接种后,因受种者心理因素发生的个体或者群体性反应。
1.1.4 严重AEFI为导致死亡、危及生命、或导致永久或显著的伤残或器官功能损伤的AEFI,包括过敏性休克、过敏性喉头水肿、过敏性紫癜、血小板减少性紫癜、Arthus反应、热性惊厥、癫痫、臂丛神经炎、多发性神经炎、格林-巴利综合征、脑病、脑炎和脑膜炎、急性播散性脑脊髓炎、VAPP、BCG骨髓炎、播散性BCG感染、晕厥、中毒性休克综合征、全身化脓性感染等。
1.1.5 接种疫苗剂次通过广西免疫规划信息管理系统收集2013年各种疫苗接种剂次数据。
1.2 资料分析方法 1.2.1 资料整理与统计将全国 AEFI 监测网络报告系统中2013年广西AEFI监测个案数据导出为 Excel 文件后,进行统计分析,以及从广西免疫规划信息平台导出2013年广西接种的疫苗剂次数。
1.2.2 分析方法采用描述性分析方法,对 AEFI 分布特征和相关指标进行流行病学分析包括AEFI报告发生率及不同特征的AEFI构成比。某疫苗某种AEFI的报告发生率(/10万剂次)=该疫苗报告AEFI数/该疫苗接种剂次数×10万剂。
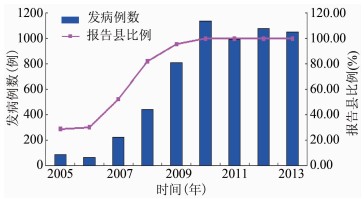
2 结果 2.1 基本情况2013年全区共接到AEFI病例报告1050例,无群体性事件发生,比2011年增加了5.84%,比2012年减少了2.69%,见图1。县级覆盖率为100%,48 h报告率为95.62%,48 h调查率为98.98%,见表1。报告卡完整率100%,调查个案完整率100%。
|
| 图 1 2005-2013年广西AEFI报告例数和报告县比例 Fig.1 AEFI cases and reporting county proportion in Guangxi,2005-2013 |
| 地区 | 报告 例数 | 报告 县数 | 报告县 比例(%) | 48 h内报告 率(%) | 48 h内调 查率(%) |
| 南宁 | 190 | 13 | 100.00 | 98.42 | 98.86 |
| 柳州 | 62 | 11 | 100.00 | 93.55 | 100.00 |
| 桂林 | 167 | 17 | 100.00 | 97.01 | 98.44 |
| 梧州 | 42 | 7 | 100.00 | 90.48 | 97.06 |
| 北海 | 57 | 4 | 100.00 | 98.25 | 100.00 |
| 防城港 | 13 | 4 | 100.00 | 92.31 | 100.00 |
| 钦州 | 56 | 4 | 100.00 | 100.00 | 100.00 |
| 贵港 | 175 | 5 | 100.00 | 94.29 | 100.00 |
| 玉林 | 61 | 7 | 100.00 | 100.00 | 100.00 |
| 百色 | 71 | 12 | 100.00 | 92.96 | 100.00 |
| 贺州 | 23 | 5 | 100.00 | 91.30 | 100.00 |
| 河池 | 72 | 11 | 100.00 | 90.28 | 95.45 |
| 来宾 | 32 | 6 | 100.00 | 90.62 | 100.00 |
| 崇左 | 29 | 7 | 100.00 | 96.55 | 100.00 |
| 合计 | 1050 | 113 | 100.00 | 95.62 | 98.98 |
所有AEFI中,非严重1023 例,占97.43%,严重 27例,占 2.57%。男女性别比为1.71 ∶ 1;≤1岁组760例,占72.38%,2~6岁组255例,占24.29%,≥7岁组35例,占3.33%,见表2。2013年每季度均有病例报告,2-4月报告254例,占24.19%;5-7月339例,占32.28%;8-10月274例,占26.10%;11-12月和1月183例,占17.43%(表2)。
| 发生特征 | 非严重AEFI | 严重AEFI | 总计 | |||
| 例数 | 构成比 (%) | 例数 | 构成比 (%) | 例数 | 构成比 (%) | |
| 性别 | ||||||
| 男 | 646 | 63.15 | 16 | 59.26 | 662 | 63.05 |
| 女 | 377 | 36.85 | 11 | 40.74 | 388 | 36.95 |
| 年龄组(岁) | ||||||
| ≤1 | 737 | 72.04 | 23 | 85.19 | 760 | 72.38 |
| 2~ | 252 | 24.63 | 3 | 11.11 | 255 | 24.29 |
| ≥7 | 34 | 3.33 | 1 | 3.70 | 35 | 3.33 |
| 季节分布(月) | ||||||
| 24 | 251 | 24.54 | 3 | 11.11 | 254 | 24.19 |
| 57 | 331 | 32.36 | 8 | 29.63 | 339 | 32.28 |
| 810 | 270 | 26.39 | 4 | 14.82 | 274 | 26.10 |
| 1112,1 | 171 | 16.71 | 12 | 44.44 | 183 | 17.43 |
| 合计 | 1023 | 100.00 | 27 | 100.00 | 1050 | 100.00 |
2013年全区共收到报 告AEFI病例个案1050例,其中,一般反应580例,占55.24%,报告发生率为2.31/10万剂次;异常反应378例,占36.00%,报告发生率为1.50/10万剂次,与2012年相比下降了36.71%;接种事故5例,占0.48%,报告发生率为0.02/10万剂次;偶合症 64例,占6.10%,报告发生率为0.25/10万剂次;心 因性反应6例,占0.57%,报告发生率为0.02/10万剂次;待定17例,占1.62%。2013年报告的AEFI中,总的报告发生率为4.18/10万剂次,非严重AEFI 1023例,占97.43%,报告发生率为4.07/10万剂次,严重AEFI 27例,占2.57%,报告发生率为0.11/10万剂次,见表3。
| 疫 苗 | AEFI | 非严重AEFI | 严重AEFI | 异常反应 | |||||
| 例数 | 报告发生率 (/10万剂) | 例数 | 报告发生率 (/10万剂) | 例数 | 报告发生率 (/10万剂) | 例数 | 报告发生率 (/10万剂) | 与2012年报告 发生率比较 | |
| 卡介苗BCG | 154 | 17.96 | 147 | 17.14 | 7 | 0.82 | 128 | 14.93 | -47.32 |
| 乙型肝炎疫苗HepB | 56 | 2.03 | 47 | 1.70 | 9 | 0.33 | 17 | 0.62 | -18.42 |
| 口服脊髓灰质炎减毒活疫苗OPV | 27 | 0.76 | 25 | 0.70 | 2 | 0.06 | 10 | 0.28 | -12.50 |
| 无细胞百白破DTaP | 317 | 8.97 | 315 | 8.91 | 2 | 0.06 | 35 | 0.99 | -48.44 |
| 白喉-破伤风联合疫苗DT | 47 | 7.96 | 47 | 7.96 | 0 | 0.00 | 5 | 0.85 | 1.19 |
| 麻疹减毒活疫苗MV | 12 | 0.61 | 11 | 0.56 | 1 | 0.05 | 6 | 0.30 | 3.45 |
| 麻疹风疹联合减毒活疫苗MR | 76 | 6.48 | 75 | 6.39 | 1 | 0.09 | 55 | 4.69 | 7.08 |
| 麻腮风联合减毒活疫苗MMR | 37 | 2.90 | 37 | 2.90 | 0 | 0.00 | 18 | 1.41 | -47.78 |
| 甲型肝炎减毒活疫苗HepA-L | 21 | 2.40 | 20 | 2.28 | 1 | 0.11 | 11 | 1.26 | 162.50 |
| 甲型肝炎灭活疫苗HepA-I | 1 | 1.88 | 1 | 1.88 | 0 | 0.00 | 1 | 1.88 | 5.03 |
| A群脑膜炎球菌多糖疫苗 MPV-A | 39 | 2.24 | 39 | 2.24 | 0 | 0.00 | 14 | 0.80 | -33.88 |
| A群C群脑膜炎球菌多糖疫苗 MPV-A+C | 22 | 1.74 | 22 | 1.74 | 0 | 0.00 | 7 | 0.56 | 107.41 |
| A群C群脑膜炎球菌多糖结合疫苗MPCV-A+C | 7 | 14.50 | 6 | 12.43 | 1 | 2.07 | 2 | 4.14 | 8.95 |
| A群C群Y群W135群脑膜炎球菌结合疫苗MPVACYW135 | 2 | 2.75 | 2 | 2.75 | 0 | 0.00 | 2 | 2.75 | 275.00 |
| 乙型脑炎减毒活疫苗JEV-L | 43 | 2.36 | 43 | 2.36 | 0 | 0.00 | 12 | 0.66 | -46.77 |
| 乙型脑炎灭活疫苗JEV-I | 2 | 6.56 | 2 | 6.56 | 0 | 0.00 | 1 | 3.28 | -42.86 |
| 甲肝乙肝联合 疫苗HepAB | 5 | 14.56 | 5 | 14.56 | 0 | 0.00 | 1 | 2.91 | -64.64 |
| 23价肺炎球菌多糖疫苗Pneu23 | 54 | 21.29 | 53 | 20.90 | 1 | 0.39 | 9 | 3.55 | 112.57 |
| 7价肺炎球菌多糖疫苗Pneu7 | 1 | 20.28 | 1 | 20.28 | 0 | 0.00 | 0 | 0.00 | 0.00 |
| B型流感嗜血杆菌结合疫苗Hib | 36 | 3.90 | 35 | 3.79 | 1 | 0.11 | 14 | 1.52 | 92.41 |
| 无细胞百白破b型流感嗜血杆菌联合 疫苗DTaP-Hib | 1 | 6.28 | 1 | 6.28 | 0 | 0.00 | 0 | 0.00 | 0.00 |
| 吸附无细胞百白破灭活脊髓灰质炎和 b型流感嗜血杆菌(结合)联合疫苗DTaP-IPV-Hib | 6 | 14.56 | 6 | 14.56 | 0 | 0.00 | 1 | 2.43 | 243.00 |
| 霍乱疫苗Chol | 2 | 2.13 | 2 | 2.13 | 0 | 0.00 | 1 | 1.06 | 106.00 |
| 脊髓灰质炎灭活疫苗IPV | 14 | 4.45 | 14 | 4.45 | 0 | 0.00 | 6 | 1.91 | -39.17 |
| 人用狂犬病疫苗(Vero细胞)Rab(Vero) | 8 | 247.83 | 7 | 216.85 | 1 | 30.98 | 2 | 61.96 | 85.73 |
| 兰菌净细菌溶解物Lan | 1 | 5.69 | 1 | 5.69 | 0 | 0.00 | 0 | 0.00 | 0.00 |
| 流感病毒裂解疫苗Flu-sp | 23 | 3.41 | 23 | 3.41 | 0 | 0.00 | 8 | 1.19 | 32.22 |
| 口服轮状病毒活疫苗Rot | 5 | 1.95 | 5 | 1.95 | 0 | 0.00 | 1 | 0.39 | -75.63 |
| 腮腺炎减毒活疫苗Mum | 2 | 1.45 | 2 | 1.45 | 0 | 0.00 | 0 | 0.00 | -100.00 |
| 伤寒Vi多糖疫苗Typh-Vi | 1 | 0.81 | 1 | 0.81 | 0 | 0.00 | 0 | 0.00 | 0.00 |
| 水痘减毒活疫苗Var | 26 | 4.89 | 26 | 4.89 | 0 | 0.00 | 10 | 1.88 | -25.69 |
| 乙型肝炎人免疫球蛋白HepBIG | 1 | 1.49 | 1 | 1.49 | 0 | 0.00 | 1 | 1.49 | 0.00 |
| 狂犬病人免疫球蛋白RIG | 1 | 763.36 | 1 | 763.36 | 0 | 0.00 | 0 | 0.00 | 0.00 |
| 合 计 | 1050 | 4.18 | 1023 | 4.07 | 27 | 0.11 | 378 | 1.50 | -36.71 |
1050例AEFI中,以发热/红肿/硬结为多见,为574例,占病例总数的54.67%,其次是过敏性皮疹为192例,占18.29%,卡介苗淋巴结炎为119例,占11.33%。
2013年报告的一般反应总的发生率为2.34/10万 剂次,其中,317例有发热症状,报告发生率为1.28/10万剂次,367例有局部红肿症状,报告发生率为1.48/10万剂次,159例有局部硬结症状,报告发生率为0.64/10万剂次。
378例异常反应的临床诊断报告发生率中,斑丘疹、臂丛神经炎、过敏性皮疹、过敏性休克、过敏性紫癜、局部脓肿、卡介苗淋巴结炎、麻疹猩红热样皮疹、全身性卡介苗感染、热性惊厥、无菌性脓肿、血管性水肿和荨麻疹的报告发生率分别为 0.03/10万剂次、0.004/10万剂次、0.72/10万剂次、0.02/10万剂次、0.02/10万剂次、0.02/10万剂次、13.76/10万剂次、0.17/10万剂次、0.02/10万剂次、0.03/10万剂次、0.07/10万剂次和0.08/10万剂次。
2.4 患者转归1050例AEFI中,治愈1018例,占96.95%;好转18例,占1.72%;死亡14例,占1.33%。14例死亡病例中,其中异常反应2例(癫痫,全身播散性卡介苗感染);12例偶合死亡病例中,新生儿窒息3例、重症肺炎2例、肺出血2例、急性脊髓炎、肠梗阻坏死、全身血管畸形出血死亡、新生儿宫内感染并休克和重型小儿腹泻各1例。
3 讨论广西从2005年开始建立AEFI信息管理系统报告个案,通过组织一系列的培训班,AEFI监测范围明显得到提升。2005-2013年广西AEFI监测数据逐年上升,2013年比2008年实施网络直报初数据增加了138.64%。从地区分布结果看,2013年全区发生AEFI 1050例,113个县均有数据报告,报告单位的覆盖率达100%,与2007年和2008年监测结果相比有很大提高[2],表明基层医生监测意识的增强和群众对疫苗可能产生AEFI重视程度的增加,都积极推动了 AEFI 的上报工作,但各市AEFI报告数差异较大,表明全区AEFI监测系统总体敏感性仍需提高,敏感性水平差距较大。96.17%的AEFI病例在48 h 内报告,99.84%的AEFI病例能在48 h内开展个案调查,说明AEFI监测系统整体运转情况良好。
报告的1050例AEFI中,以1岁以内发生AEFI最多,占72.38%,与国内很多省份报告一致[2, 3, 4]。AEFI发生数较多的疫苗主要是DTaP,BCG,含麻疹成分疫苗,而异常反应类型中以卡介苗
淋巴结炎报告发生率较高,与其他省份报道较不一致[3, 4];异常反应报告发生率与2012年相比下降了36.71%,主要与卡介苗淋巴结炎报告数下降有关。报告AEFI个案中49.35%为异常反应,主要为卡介苗淋巴结炎和过敏性皮疹,与其他省份报道及国家监测结果均不一致[2],与广西卡介苗接种事故多,同时为皮内注射比较难掌握,注射的深浅等有关。从临床损害来看,因疫苗固有性质引起的发热、局部红肿和硬结等一般反应,占AEFI报告总数的37.85%。从疫苗安全性分析,2013年广西的卡介苗淋巴结炎异常反应的报告发生率为13.76/10万剂次,大于国家的监测结果[1],但没超过世界卫生组织的预期发生率[5]。
综上所述,在疫苗本身的特性难以改变的前提下,应加强免疫规划人员的培训,强化责任意识,提高他们的综合素质,严格执行《预防接种工作规范》,提高预防接种服务质量,减少预防接种事故的发生。进一步规范AEFI报告处置,落实《广西壮族自治区预防接种异常反应补偿办法》,可充分提高广大群众对免疫规划工作的信心和配合度,从而提高儿童免疫接种率,保证免疫规划工作科学健康规范地发展。
| [1] | Office of Ministry of Health of The People's Republic of China,Office of State Food and Drug Administration. Monitoring Program for Adverse Events Following Immunization[S].Beijing,2010.(in Chinese) 中华人民共和国卫生部办公厅,国家食品药品监督管理局办公室. 全国疑似预防接种异常反应监测方案[S]. 北京,2010. |
| [2] | Wu WD,Liu DW,Wu BB, et al.Analysis on the surveillance of adverse events following immunization in China,2007-2008 [J].Chinese Journal of Vaccines and Immunization,2009,15(6):481-490.(in Chinese) 武文娣,刘大卫,吴冰冰,等.全国2007-2008年疑似预防接种异常反应监测分析[J].中国疫苗和免疫,2009,15(6):481-490. |
| [3] | Zhang FB, Zhang ZG, Sun YQ, et al.Study on the surveillance of adverse events following immunization in Hebei province in 2005-2007[J].Chinese Journal of Vaccines and Immunization,2008,14(6):538-542.(in Chinese) 张富斌,张振国,孙印旗,等.河北省2005-2007年疑似预防接种异常反应监测分析[J].中国疫苗和免疫,2008,14(6):538-542. |
| [4] | Du W,Zhang DY,Xu F,et al.Analysis on the surveillance of adverse events following immunization in Guizhou,2008-2009[J].Guizhou Medical Journal,2010,34(12):1126-1127.(in Chinese) 杜雯,张大勇,徐飞,等.贵州省2008-2009年度疑似预防接种异常反应监测分析[J].贵州医药,2010,34(12):1126-1127. |
| [5] | WHO & WPRO.Immunization safety surveillance:Guidelines for immunization programme managers on surveillance of adverse events following immunization[M]. 2nd ed. Manila,Philippines: WHO Regional Office for the Western Pacific,2013. |
 , Vol. 30
, Vol. 30


