扩展功能
文章信息
- 吴海霞, 刘起勇, 刘小波, 鲁亮, 郭玉红, 岳玉娟
- WU Hai-xia, LIU Qi-yong, LIU Xiao-bo, LU Liang, GUO Yu-hong, YUE Yu-juan
- 2006-2013年中国19省白纹伊蚊监测数据分析
- Surveillance for Aedes albopictus in China,2006-2013
- 疾病监测, 2015, 30(4): 310-315
- Disease Surveillance, 2015, 30(4): 310-315
- 10.3784/j.issn.1003-9961.2015.04.016
-
文章历史
- 收稿日期:2014-12-29
白纹伊蚊(Aedes albopictus)是登革热的重要传播媒介之一(我国近年出现的登革热大多由白纹伊蚊传播),其雌蚊偏吸人血,攻击性较强,多在户外侵袭人体,全天均有吸血现象[1]。除了传播登革热外,实验证明白纹伊蚊还能够传播7种甲病毒,8种布尼亚病毒和3种黄病毒[2]。Brady等[3]基于温度对登革病毒发育和白纹伊蚊存活的影响,预测相对于埃及伊蚊,白纹伊蚊将成为登革病毒潜在的更有效的传播媒介。白纹伊蚊在我国分布广泛,南起海南岛,北至沈阳、大连市,西至陇县和宝鸡市,西南至西藏自治区,向东大部分地区均有分布,其中北纬30°以南最为常见[4]。在全球范围内,近年来白纹伊蚊已从原产地东南亚扩散至全球(除南极洲外)的所有大陆[2]。
由于登革热缺乏有效的预防疫苗和特效治疗药物,媒介蚊虫的监测和防控是预防和控制其流行的关键措施。在登革热预测预警、预防控制中,对媒介伊蚊的监测和动态分析具有重要意义。气象、环境、人口等因素可以通过影响白纹伊蚊的分布、密度,从而影响登革热的发生[5]。在各种气象因素中,气温和降水是影响虫媒传染病发生的最主要因素[6]。2005年,我国启动全国重要病媒生物监测项目,白纹伊蚊是目标监测蚊种之一。本研究对2006-2013年19省的白纹伊蚊监测数据从不同的温度带、降水带、生境角度进行分析,以期发现白纹伊蚊的种群动态变化规律,为登革热及白纹伊蚊相关疾病的预防控制提供依据。
1 数据和方法 1.1 数据来源本研究分析数据来自全国病媒生物监测系统中2006 2013年的蚊虫监测数据。
1.2 监测点的选择综合考虑地理位置、病媒生物性疾病分布及各省市工作开展情况,在全国范围内选取了19个省的43个国家级监测点,开展蚊、蝇、鼠、蟑螂密度监测,其中19省41个监测点开展蚊虫监测(图1)。
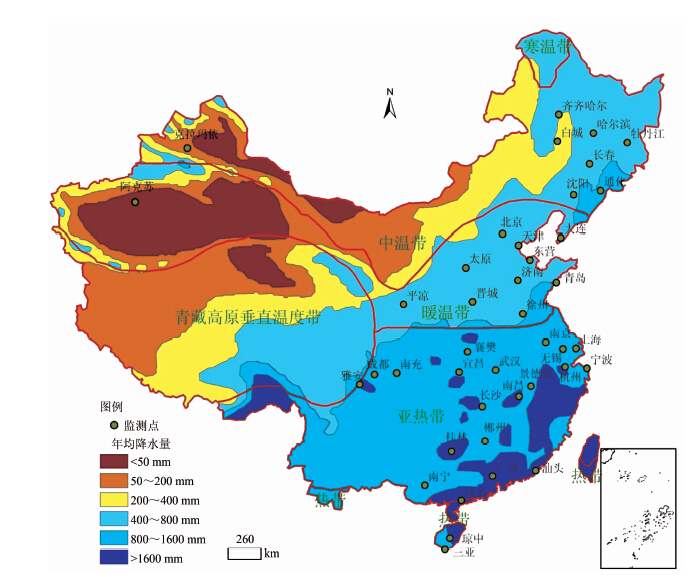
|
| 图 1 我国重要病媒生物监测系统蚊虫监测点分布示意图 Fig.1 Distribution of mosquito surveillance sites in China |
按照《全国病媒生物监测方案》(试行)中的诱蚊灯法进行监测。诱蚊灯采用光催化捕杀蚊蝇器,由武汉市吉星环保科技有限责任公司提供(波长360~380 nm,灯泡功率8 W),每个监测点(地级市)城区选择居民区、公园(含街心公园)、医院各4 处,农村选择民房和牲畜棚(牛棚和猪圈等)各4 处,没有牲口棚的以民房补齐。除牛棚、猪圈外,其他均在外环境中进行。每处使用诱蚊灯1只。监测从日落20 min后开始,连续诱集6 h。第2天将集蚊盒取出,鉴定种类、性别并计数。
1.4 监测时间每月2次,相邻两次的测定间隔应为15 d,风雨天气(风力五级以上)顺延。越冬蚊活动前1个月即开始监测,连续2次监测皆未捕到蚊虫后结束。
1.5 分析方法数据整理和分析采用Excel 2007、EpiInfo 7、SPSS 17.0统计软件,Arcgis 9.3等对全国病媒生物监测点2006-2013年的白纹伊蚊资料进行相关统计分析,采用一般线性模型(General linear model,GLM)对不同温度带、降水带、生境、年份和月份的白纹伊蚊密度进行比较,灯诱法蚊密度计算公式如下:

2006-2013年国家级监测点共布放诱蚊灯190 614只,共捕获白纹伊蚊41 689只,白纹伊蚊总平均密度为0.036只/(灯·h)。
2.2 不同生境白纹伊蚊密度比较 2.2.1 不同生境白纹伊蚊平均密度比较牲畜棚白纹伊蚊密度只/(灯·h)最高,为0.067,其次是农户生境(0.046),随后依次为公园(0.037)、医院(0.028)和居民区(0.023),不同生境白纹伊蚊平均密度之间的差异有统计学意义(F=4.931,P<0.01)。见表1。
| [只/(灯·h)] | |||||||||||
| 生境类型 | n | 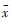 ± s ± s | 年份 | 总计 | |||||||
| 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | ||||
| 居民区 | 3 615 | 0.029±0.18 | 0.062 | 0.015 | 0.014 | 0.018 | 0.030 | 0.023 | 0.018 | 0.029 | 0.023 |
| 医院 | 3 589 | 0.030±0.22 | 0.060 | 0.020 | 0.015 | 0.013 | 0.025 | 0.035 | 0.026 | 0.039 | 0.028 |
| 公园 | 3 614 | 0.051±0.35 | 0.085 | 0.037 | 0.025 | 0.025 | 0.045 | 0.033 | 0.027 | 0.045 | 0.037 |
| 农户 | 3 583 | 0.047±0.30 | 0.120 | 0.027 | 0.019 | 0.026 | 0.052 | 0.056 | 0.043 | 0.049 | 0.046 |
| 牲畜棚 | 3 516 | 0.072±0.50 | 0.190 | 0.027 | 0.023 | 0.064 | 0.082 | 0.063 | 0.065 | 0.068 | 0.067 |
| 合计 | 17 917 | 0.046±0.33 | 0.098 | 0.025 | 0.019 | 0.025 | 0.041 | 0.036 | 0.030 | 0.042 | 0.036 |
不同生境中,牲畜棚和农户环境都是7月密度最高,峰值较高;公园、医院和居民区7 8月密度较高,峰值较低,持续时间较长。不同生境白纹伊蚊密度之间的差异有统计学意义(F=5.257,P<0.001),不同月份白纹伊蚊密度之间的差异有统计学意义(F=18.190,P<0.0001),不同生境不同月份对白纹伊蚊密度的交互影响无统计学意义(F4,11=0.664,P>0.05)。见表2。
| [只/(灯·h)] | ||||||
| 月份 | 居民区 | 医院 | 公园 | 农户 | 牲畜棚 | 总计 |
| 1 | 0.000 63 | 0.000 47 | 0.0012 | 0.0025 | 0.0046 | 0.0015 |
| 2 | 0.000 39 | 0.001 10 | 0.0018 | 0.0030 | 0.0054 | 0.0018 |
| 3 | 0.001 10 | 0.002 20 | 0.0028 | 0.0055 | 0.0074 | 0.0031 |
| 4 | 0.003 90 | 0.006 90 | 0.0083 | 0.0093 | 0.0150 | 0.0077 |
| 5 | 0.014 00 | 0.019 00 | 0.0260 | 0.0280 | 0.0400 | 0.0230 |
| 6 | 0.038 00 | 0.044 00 | 0.0600 | 0.0980 | 0.1500 | 0.0660 |
| 7 | 0.068 00 | 0.078 00 | 0.1000 | 0.1400 | 0.2300 | 0.1100 |
| 8 | 0.073 00 | 0.082 00 | 0.1000 | 0.1200 | 0.1500 | 0.0980 |
| 9 | 0.054 00 | 0.062 00 | 0.0850 | 0.0730 | 0.0920 | 0.0710 |
| 10 | 0.019 00 | 0.024 00 | 0.0330 | 0.0390 | 0.0550 | 0.0310 |
| 11 | 0.006 00 | 0.010 00 | 0.0110 | 0.0150 | 0.0210 | 0.0110 |
| 12 | 0.001 60 | 0.003 20 | 0.0025 | 0.0058 | 0.0100 | 0.0037 |
| 合计 | 0.023 00 | 0.028 00 | 0.0370 | 0.0460 | 0.0670 | 0.0360 |
白纹伊蚊密度最高年份为2006年,达0.098 只/(灯·h),其后密度明显下降,2010年和2013年略有回升;自2007年白纹伊蚊密度下降后,农户和医 院生境中密度高峰出现在2011年和2013年,而其他几种生境中均与总密度年趋势类似,均出现在2010年和2013年(表1)。不同生境白纹伊蚊密度差异有统计学意义(F=14.338,P=0.000),不同年份白纹伊蚊密度差异有统计学意义(F=7.068,P=0.000),不同生境不同年份对白纹伊蚊密度的交互影响无统计学意义(F4,7=1.219,P>0.05)。
2.3 不同温度带白纹伊蚊密度比较 2.3.1 不同温度带白纹伊蚊平均密度比较不同温度带中,热带的白纹伊蚊密度最高,达0.091只/(灯·h),其后依次为亚热带、暖温带,中温带没有发现白纹伊蚊,见表3。不同温度带白纹伊蚊密度差异有统计学意义(F=29.847,P=0.000),亚热带、暖温带白纹伊蚊密度差异无统计学意义(P=0.312),热带与其他温度带白纹伊蚊密度差异均有统计学意义(均P=0.000)。
| [只/(灯·h)] | |||||||||||
| 温度带 | n | 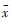 ± s ± s | 年份 | 总计 | |||||||
| 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | ||||
| 中温带 | 3 682 | 0.000 | 0.000 | 0.0000 | 0.0000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| 暖温带 | 4 551 | 0.066±0.55 | 0.054 | 0.0085 | 0.0041 | 0.018 | 0.040 | 0.021 | 0.021 | 0.052 | 0.029 |
| 亚热带 | 8 774 | 0.050±0.24 | 0.151 | 0.0460 | 0.0340 | 0.040 | 0.046 | 0.055 | 0.039 | 0.037 | 0.051 |
| 热带 | 910 | 0.091±0.22 | 0.046 | 0.0022 | 0.0010 | 0.024 | 0.150 | 0.190 | 0.210 | 0.090 | 0.091 |
| 合计 | 17 917 | 0.046±0.33 | 0.098 | 0.0250 | 0.0190 | 0.025 | 0.041 | 0.036 | 0.030 | 0.042 | 0.036 |
不同温度带中,暖温带、亚热带全年出现1个密度高峰,但前者的高峰出现在8月,晚于后者的7月;热带的白纹伊蚊密度全年有2个高峰,7月出现第1个高峰,8、9月密度下降后,全年的最高峰值出现在10月,见表4。不同温度带白纹伊蚊密度差异有统计学意义(F=17.465,P=0.000),不同月份白纹伊蚊密度差异有统计学意义(F=6.502,P=0.000),不同温度带不同月份对白纹伊蚊密度的交互影响有统计学意义(F4,11=2.657,P=0.000)。
| [只/(灯·h)] | |||||
| 月份 | 中温带 | 暖温带 | 亚热带 | 热带 | 总计 |
| 1 | 0.000 00 | 0.000 00 | 0.0015 | 0.031 | 0.0015 |
| 2 | 0.000 00 | 0.000 00 | 0.0018 | 0.040 | 0.0018 |
| 3 | 0.000 00 | 0.000 14 | 0.0039 | 0.053 | 0.0031 |
| 4 | 0.000 00 | 0.001 30 | 0.0130 | 0.073 | 0.0077 |
| 5 | 0.000 00 | 0.004 70 | 0.0460 | 0.070 | 0.0230 |
| 6 | 0.000 00 | 0.040 00 | 0.1100 | 0.110 | 0.0660 |
| 7 | 0.000 00 | 0.078 00 | 0.1700 | 0.140 | 0.1100 |
| 8 | 0.000 00 | 0.120 00 | 0.1100 | 0.110 | 0.0980 |
| 9 | 0.000 00 | 0.082 00 | 0.0770 | 0.094 | 0.0710 |
| 10 | 0.000 00 | 0.017 00 | 0.0430 | 0.190 | 0.0310 |
| 11 | 0.000 00 | 0.000 44 | 0.0190 | 0.100 | 0.0110 |
| 12 | 0.000 00 | 0.000 00 | 0.0051 | 0.056 | 0.0037 |
| 合计 | 0.000 00 | 0.029 00 | 0.0510 | 0.091 | 0.0360 |
不同温度带中,暖温带、亚热带白纹伊蚊密度均在2006年后明显下降,其后亚热带白纹伊蚊密度一直较为平稳,而暖温带密度出现波动,分别在2010年和2013年出现小幅上升;热带地区白纹伊蚊密度自2006年下降后,2010年出现明显的上升,并持续上升至2012年,2013年才开始下降(表3)。不同温度带白纹伊蚊密度差异有统计学意义(F=30.424,P=0.000),不同月份白纹伊蚊密度差异有统计学意义(F=8.231,P=0.000),不同温度、不同年份对白纹伊蚊密度的交互影响有统计学意义 (F3,7=5.682,P=0.000)。
2.4 不同降水带白纹伊蚊密度比较 2.4.1 不同降水带白纹伊蚊平均密度比较不同降水带中,年降水量800~1600 mm区域的白纹伊蚊平均密度最高,达0.059只/(灯·h),其后依次为>1600 mm、400~800 mm区域,<400 mm区域未发现白纹伊蚊,见表5。对发现白纹伊蚊分布的3个降水带白纹伊蚊密度进行比较,3个不同降水带白纹伊蚊密度差异有统计学意义(F=34.685,P=0.000),各降水带间白纹伊蚊密度差异均有统计学意义(400~800 mm与800~1600 mm间P=0.000,与>1600 mm间P=0.022,800~1600 mm与>1600 mm间P=0.000)。
| [只/(灯·h)] | |||||||||||
| 降水带(mm) | n | 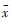 ± s ± s | 年份 | 总计 | |||||||
| 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | ||||
| <50 | 320 | 0.00 | 0.000 | 0.0000 | 0.0000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| 50~ | 387 | 0.00 | 0.000 | 0.0000 | 0.0000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| 200~ | 480 | 0.00 | 0.000 | 0.0000 | 0.0000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| 400~ | 6 601 | 0.045±0.460 | 0.033 | 0.0061 | 0.0030 | 0.017 | 0.036 | 0.019 | 0.018 | 0.047 | 0.025 |
| 800~ | 7 132 | 0.063±0.280 | 0.160 | 0.0480 | 0.0360 | 0.044 | 0.056 | 0.054 | 0.049 | 0.031 | 0.059 |
| >1600 | 2 997 | 0.024±0.078 | 0.021 | 0.0140 | 0.0084 | 0.017 | 0.035 | 0.082 | 0.044 | 0.062 | 0.041 |
| 合计 | 179 17 | 0.046±0.330 | 0.098 | 0.0250 | 0.0190 | 0.025 | 0.041 | 0.036 | 0.030 | 0.042 | 0.036 |
不同降水带中,除<400 mm区域未发现白纹伊蚊外,其余3个区域白纹伊蚊密度全年均呈单峰曲线,但各区域曲线不尽相同:年均降水量400~800 mm区域白纹伊蚊密度全年最高峰出现在9月,800~1600 mm区域密度最高峰出现在8月,且明显高于其他2个区域峰值;>1600 mm区域密度曲线较为平缓,6-11月密度均较高,见表6。不同降水带白纹伊蚊密度差异有统计学意义(F=4.250,P=0.027),不同月份白纹伊蚊密度差异有统计学意义(F=6.890,P=0.000),不同降水带、不同月份对白纹伊蚊密度的交互影响有统计学意义(F3,11=3.772,P=0.000)。
| [只/(灯·h)] | |||||
| 月份 | 降水带 | 总计 | |||
| <400 mm | 400~800 mm | 800~1600 mm | >1600 mm | ||
| 1 | 0 | 0.000 00 | 0.0024 | 0.0065 | 0.0014 |
| 2 | 0 | 0.000 00 | 0.0032 | 0.0080 | 0.0018 |
| 3 | 0 | 0.000 12 | 0.0050 | 0.0130 | 0.0031 |
| 4 | 0 | 0.001 10 | 0.0120 | 0.0290 | 0.0077 |
| 5 | 0 | 0.004 10 | 0.0410 | 0.0650 | 0.0230 |
| 6 | 0 | 0.035 00 | 0.1200 | 0.0630 | 0.0660 |
| 7 | 0 | 0.068 00 | 0.1900 | 0.0760 | 0.1100 |
| 8 | 0 | 0.100 00 | 0.1100 | 0.0660 | 0.0980 |
| 9 | 0 | 0.071 00 | 0.0830 | 0.0520 | 0.0710 |
| 10 | 0 | 0.015 00 | 0.0510 | 0.0500 | 0.0310 |
| 11 | 0 | 0.000 38 | 0.0200 | 0.0370 | 0.0110 |
| 12 | 0 | 0.000 00 | 0.0062 | 0.0150 | 0.0037 |
| 合计 | 0 | 0.025 00 | 0.0590 | 0.0410 | 0.0360 |
不同降水带中,年均降水量400~800 mm区域在监测年份中密度虽然不高,但波动较大,2006、2010、2013年均有高峰出现,800~1600 mm区域白纹伊蚊密度均在2006年后明显下降,此后一直较为平稳,而>1600 mm区域则在2008年后一直缓慢上升,2011、2013年出现2次较为明显的升高(表5)。不同降水带白纹伊蚊密度差异有统计学意义,但差异不明显(F=3.732,P=0.050),不同年份白纹伊蚊密度差异无统计学意义(F=0.859,P=0.559)。不同降水带不同年份对白纹伊蚊密度的交互影响有统计学意义(F3,7=5.575,P=0.000)。
3 讨论分析发现,2006 2013年全国病媒生物监测点白纹伊蚊总密度达0.036只/(灯·h),不同生境白纹伊蚊密度之间存在差异,牲畜棚和农户生境的密度最高。农村环境(牲畜棚、农户)的高峰仅出现在7月,持续时间较短,且高于城区生境(居民区、公园、医院),而城区生境的高峰为7 8月,持续时间较长。白纹伊蚊是典型的容器型蚊种,孳生场所和生境种类繁多,包括家庭容器(水壶、缸、罐、泡菜坛等)、植物容器(树洞、叶腋、竹筒等)、特殊容器(废旧轮胎、汽油桶等)和天然石穴、岩洞、水泥池、水泥槽等[7]。随着城市卫生环境的改善,特别是近年登革热疫情暴发后,城区环境内的白纹伊蚊孳生地清理受到重视,而牲畜棚、农户环境本身孳生场所较多、管理较少,可能是导致其他3种城区生境白纹伊蚊密度较低的原因。已有调查发现,农村中白纹伊蚊幼虫孳生地以室外环境为主[8],提示在今后的白纹伊蚊预防控制中,要重视农村环境孳生地的治理,特别是室外孳生地的治理。
气候因素被认为是影响白纹伊蚊分布的决定因素[9],白纹伊蚊密度变动与气温、降水量等气象因素有关[10]。本研究显示,热带的白纹伊蚊密度最高,其后依次为亚热带、暖温带,可能与热带地区白纹伊蚊全年孳生有关,而在亚热带和暖温带白纹伊蚊有1~8个月的越冬卵期[10],拉低了白纹伊蚊成蚊的平均密度。不同温度带中,暖温带、亚热带全年出现一个密度高峰,前者的高峰出现在8月,晚于后者的7月;热带(三亚、琼中)的白纹伊蚊密度全年有2个高峰,7月出现第一个高峰,8、9月密度下降后,全年的最高峰值出现在10月,5 10月为海南的雨季,白纹伊蚊密度升高,符合其孳生特点,但8 9月密度下降,是否与台风的活动有关,还需进一步的研究。在热带地区,白纹伊蚊密度自2006年下降后,2010年出现明显的上升,并持续上升至2012年,2013年才开始下降,是自然因素(如气候)还是人为的原因导致了这种现象,需要进一步的调查分析。2006 2013年全国病媒生物监测在中温带监测点(沈阳、通化、长春、白城、齐齐哈尔、哈尔滨、牡丹江、克拉玛依)没有发现白纹伊蚊,其中沈阳境内曾发现有白纹伊蚊[11],但王树诚等[12]2006 2009年所做调查已显示随着防控措施的实施,辽宁省仅朝阳和大连两地分布有白纹伊蚊,本监测点自2006 2013年在沈阳监测点也一直未发现白纹伊蚊,而沈阳地区年均温7.9 ℃[13],与Wu等[14]认为我国白纹伊蚊分布于年均温在11 ℃以上地区的研究结果一致,是防控措施的实施还是气候的原因导致沈阳没有白纹伊蚊分布,还需要长期的监测和调查。
本研究还将监测点按其所处的降水带分类进行分析发现,年降水量<400 mm区域未发现白纹伊蚊,年降水量400~800 mm区域的白纹伊蚊密度最高,其后依次为800~1600 mm、>1600 mm区域,白纹伊蚊的密度并没有随着降水量的增加而升高,太多的降水不利于白纹伊蚊的孳生,符合白纹伊蚊孳生于小型积水的习性。在有白纹伊蚊分布的3个降水带中,年均降水量400~800 mm区域白纹伊蚊密度全年最高峰出现在9月,800~1600 mm区域密度最高峰出现在8月,且明显高于其他2个区域峰值;>1600 mm区域密度曲线较为平缓,峰值最低,6 11月密度均较高,密度峰值随降水量的减少而出现的越来越晚,可能是降水量和温度共同作用的结果。
不同监测环境、温度带、降水带、月份和年份的白纹伊蚊密度有差异,且这些因素对白纹伊蚊密度还存在交互影响,提示在白纹伊蚊及相关传染病的预防控制上不同的生境、不同的温度带(地区)、不同月份应采取更有针对性的措施。此外,不同地区不同因素的影响可能是不一样的,例如同样是在亚热带内,一些区域的降水量增加,反而降低了白纹伊蚊的密度,本研究只引入了少数的影响因素,其他因素的影响及包括本研究这些因素在内的各因素在不同地区对白纹伊蚊的具体作用还需要更进一步的研究。同时需指出的是,本研究仅依据现有监测点数据进行分析,监测点在各分类区域内的分布并不均衡,可能会对分析结果产生一定的影响。
| [1] | Shuai SF. Studies on Aedes albopictus blood-sucking habit and efficacy of BG-Sentinel trap for collecting mosquito[D].Guangzhou: Southern Medical University,2013: 2.(in Chinese) 帅淑芬.白纹伊蚊的吸血习性及新型捕蚊器BG-Sentinel trap的捕蚊效果研究[D]. 广州: 南方医科大学,2013: 2. |
| [2] |
Benedict MQ, Levine RS, Hawley WA, et al. Spread of the tiger: global risk of invasion by the mosquito Aedes albopictus[J]. |
| [3] | Brady OJ, Golding N, Pigott DM, et al. Global temperature constraints on Aedes aegypti and Ae. albopictus persistence and competence for dengue virus transmission[J]. Parasit Vectors,2014,7: 338. |
| [4] | Lu BL. Fauna Sinica, Insecta Vol. 8, Diptera: Culicidae I[M]. Beijing: Science Press, 1997.(in Chinese) 陆宝麟. 中国动物志.昆虫纲.第八卷. 双翅目. 蚊科(上)[M]. 北京:科学出版社,1997. |
| [5] | Jetten TH, Focks DA. Potential changes in the distribution of dengue transmission under climate warming[J]. Am J Trop Med Hyp,1997,57(3):285-297. |
| [6] | Fan JC, Liu QY. Research progress on the effect of climate change on dengue vector[J]. Chinese Journal of Epidemiology,2013,34(7):745-749.(in Chinese) 樊景春,刘起勇. 气候变化对登革热传播媒介影响研究进展[J]. 中华流行病学杂志,2013,34(7):745-749. |
| [7] | Tan Y, Feng XY. Dengue vector surveillance in Guangxi[J]. Acta Parasitologica Et Medica Entomologica Sinica,2003,10(2):93-96.(in Chinese) 谭毅,冯向阳. 广西登革热蚊媒监测[J]. 寄生虫与医学昆虫学报,2003,10(2):93-96. |
| [8] | Jiang YM, Yan ZQ, Hu ZG, et al. Analysis of Aedes albopictus density dynamics in previous dengue fever epidemic focus in Guangzhou rural area[J]. Journal of Tropical Medicine,2012,12(2):222-223.(in Chinese) 江毅民,严子锵,胡志刚,等. 广州地区农村登革热旧疫点白纹伊蚊密度消长特点分析[J]. 热带医学杂志,2012,12(2):222-223. |
| [9] | Hawley W. The biology of Aedes albopictus[J]. J Am Mosq Control Assoc,1988, Suppl:S1-39. |
| [10] | An JY, Yan G, Zhang XW, et al. Aedes albopictus-the important vector of dengue[J]. Chinese Journal Pest Control,2003,17(8):449-452.(in Chinese) 安继尧,严格,张学文,等. 白纹伊蚊-登革热的重要媒介[J]. 医学动物防制,2003,17(8):449-452. |
| [11] | Yang SR, Liu QY. Trend in global distribution and spread of Aedes albopictus[J]. Chinese Journal of Vector Biology and Control,2013,24(1):1-4.(in Chinese) 杨舒然,刘起勇. 白纹伊蚊的全球分布及扩散趋势[J]. 中国媒介生物学及控制杂志,2013,24(1):1-4. |
| [12] | Wang SC, Ding J, Zhang JB, et al. The distribution of Aedes albopictus in the northern of Liaoning province [J]. Chinese Journal of Vector Biology and Control,2009,20(3):191-192.(in Chinese) 王树诚,丁俊,张稷博,等.辽宁省北部城市白纹伊蚊分布调查[J]. 中国媒介生物学及控制杂志,2009,20(3):191-192. |
| [13] | Tan L, He XY, Chen W, et al. Gradient analysis of urban green space landscape pattern in Shenyang city based on QuickBird image[J]. Chinese Journal of Ecology,2008,27(7):1141-1148.(in Chinese) 谭丽,何兴元,陈玮,等. 基于QuickBird卫星影像的沈阳城市绿地景观格局梯度分析[J]. 生态学杂志,2008,27(7):1141-1148. |
| [14] |
Wu F, Liu QY, Lu L, et al. Distribution of Aedes albopictus(Diptera: Culicidae) in Northwestern China[J]. |
 2015, Vol. 30
2015, Vol. 30


