扩展功能
文章信息
- 张倩, 黄艺滢, 谷利, 杨荟敏, 张红
- ZHANG Qian, HUANG Yi-Ying, GU Li, YANG Hui-Min, ZHANG Hong
- CHPG通过调控mGluR5表达及JNK信号通路抑制LPS诱导的小胶质细胞激活
- CHPG protects against LPS-induced inflammation by modulating mGluR5 and JNK signaling pathway
- 疾病监测, 2015, 30(5): 361-367
- Disease Surveillance, 2015, 30(5): 361-367
- 10.3784/j.issn.1003-9961.2015.05.006
-
文章历史
- 收稿日期:2015-02-15
2. 首都医科大学医学遗传学系, 北京 100069;
3. 首都医科大学基础医学院基础医学班, 北京 100069
2. Department of Medical Genetics, Capital Medical University, Beijing 100069, China;
3. Class of Basic Medical Sciences, Capital Medical University, Beijing 100069, China
小胶质细胞大量分布于脑和视网膜,约占成年人脑细胞的12%,它构成了中枢神经系统中的独特的免疫细胞,在先天性免疫应答反应中发挥了重要 的作用[1]。在正常的脑组织中,小胶质细胞处于“静息”状态,表达低水平的与免疫反应发生发展相关的蛋白分子,如模式识别受体、趋化因子受体与主要组织相容性复合体分子[2]。但是在中枢神经系统发生损伤和疾病时,小胶质细胞会被激活。激活的小胶质细胞分泌大量具有神经毒性的炎症因子,如肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)、白介素Ⅰ(interleukin-1beta,IL-1β)和一氧化氮(nitric oxide,NO)[3, 4]。另外,激活的小胶质细胞吞噬功能明显增强,这些细胞除了可以吞噬凋亡的脑细胞外,甚至可以吞噬正常的脑细胞以及神经元[5]。实验证明,由激活的小胶质细胞所导致的难以控制的炎症反应,使外伤性脑损伤和许多神经退行性疾病的病情变得更加严重[6]。同时炎症反应过程中,MAPK信号通路ERK、JNK和p38参与调控炎症因子的产生[7, 8]。因此,小胶质细胞的活化及其介导的神经炎症在疾病进展中发挥重要作用,干预小胶质细胞的活化成为目前脑损伤和神经退行性疾病治疗的有效靶位点之一。
近年来,谷氨酸受体在缓解脑损伤和神经退行性疾病作用中受到广泛关注。代谢型谷氨酸受体(metabotropic glutamate receptors,mGluRs) 属于G蛋白偶联受体(gproteincoupledreceptor,GPCR) ,是神经系统中的重要受体之一,包括mGluR1~8。根据序列同源性和细胞内信号转导机制,mGluRs 分为3个亚型: Ⅰ组(mGluR1 和mGluR5) ; Ⅱ组(mGluR2 和mGluR3) ; Ⅲ组(mGluR4、mGluR6、mGluR7 和mGluR8)。mGluR5与小胶质细胞激活密切相关。激活mGluR5通过激活磷脂酶C(phospholipase C,PLC),进而激活MAPK及其下游信号通路[9],从而影响细胞的生理功能。研究显示,炎症刺激可引起mGluR5表达量的降低,激活mGluR5抑制小胶质细胞激活诱导的细胞炎症。例如:TNF-α和IL-1β等炎症因子处理小胶质细胞后,mGluR5基因表达下调 [10]。Farso MC等[11]报道,脂多糖(lipopolysaccharide,LPS)处理后,小胶质细胞激活,释放NO,TNF-α,谷氨酸等炎症因子;应用150 μmol/L Ⅰ组代谢型谷氨酸受体的激 动剂DHPG预处理小胶质细胞能够显著降低上述物质的释放,mGluR5的特异性激动剂2-氯-5-对羟基苯甘氨酸 同样抑制NO的释放和活性氧的产生[12]。然而,激活mGluR5 如何抑制小胶质细胞激活诱导的炎症反应,目前尚未清晰。
综上所述,小胶质细胞的活化及其介导的神经炎症在疾病进展中发挥重要作用,激活mGluR5可抑制小胶质细胞激活诱导的细胞炎症,那么,激活mGluR5是否通过调节mGluR5的表达量及其介导的信号通路,从而达到抑制小胶质细胞引起的炎症?本研究通过在野生型和mGluR5基因敲减的小胶质细胞中,检测mGluR5及其下游信号通路进而探究CHPG抑制小胶质细胞激活的机制,从而为治疗小胶质细胞过度激活引起的神经系统疾病提供理论基础。
1 材料与方法 1.1 材料小鼠小胶质细胞系BV2来自首都医科大学。 DMEM/F12 (dulbecco modified eagle medium/F12K)培养基购于康宁公司,胎牛血清(FBS)购自伊科赛公司,青链霉素混合液购自Solarbio公司。 除抗体anti-mGluR5购于abcam公司,其余均购于Cell Signaling 公司。Immobilon Western 化学发光试剂盒购于Millipore公司。 Mouse interleukin 1β 酶联免疫吸附试验(ELISA)试剂盒购于CUSABIO公司,Griess Reagent System 试剂盒购于Promega公司。 LPS购于Sigma公司,CHPG购于TOCRIS公司,转染试剂购于丰锐生物公司,MuseTM Count & Viability试剂购于北京九宇金泰生物技术有限公司。干扰质粒RLGM-GU31681购于北京北方仪涛商贸有限公司。
1.2 细胞培养与处理BV2细胞在含10%胎牛血清及1%氨苄西林和1%硫酸链霉素的DMEM/F12培养基中,37 ℃,5% CO2培养箱中培养。BV2细胞接种到培养皿中,培养24 h后,待细胞生长到80%时,更换新鲜的含有血清的DMEM/F12的培养基,加入CHPG和LPS处理细胞。为了实现mGluR5的敲减,按照丰锐生物公司Chemifect真核细胞转染试剂说明书将RLGM-GU31681质粒转染至BV2细胞。
1.3 流式细胞术检测细胞活力取对数生长期的BV2细胞计数并调整细胞浓度为 3.5×105 个/皿,接种于35 mm的小皿中。在含有10%胎牛血清的DMED/F12培养液、5% CO2的条件下培养。细胞稳定24 h后用CHPG和LPS单独或者共同刺激细胞,24 h后用胰酶消化离心收集细胞,PBS洗涤并将细胞数调整为1×105~1×106个/ml。 根据MuseTM Count & Viability试剂说明书,Muse流式细胞仪检测并记录实验结果。
1.4 Griess法测定NO含量根据NO溶解于水后可以形成亚硝酸盐的原理,测定培养基中亚硝酸盐(NO2-)的含量,可以间接反应细胞上清中NO的含量。 将BV2细胞以3.5×104/皿密度接种在35 mm培养皿中,稳定24 h后,用CHPG和LPS分别或者共同刺激细胞,24 h后收取上清,根据Griess检测试剂盒说明书检测亚硝酸盐(NO2-)的含量。用酶标仪在540 nm波长处测定吸光度,根据标准曲线计算上清液中NO2-含量。
1.5 ELISA定量检测白介素1β的含量细胞按上述处理后,将培养上清收集至1.5 ml的EP管中,置-80 ℃保存备用。 ELISA试剂盒从冰箱中取出后置室温下复温,将标准品成比稀释为所需的浓度,双蒸水稀释浓缩的洗涤液(1 ∶ 25)。在使用前的30 min,按1 ∶ 100比例稀释试剂盒中提供的浓缩生物素化抗体和亲和素抗体,将细胞上清液样本提前从-80 ℃冰箱中取出放置于4 ℃冰箱中,临用平衡于室温。实验具体步骤参见Mouse interleukin 1β ELISA试剂盒说明书,每个样品设定3个平行孔。用酶标仪在450 nm波长处测定吸光度,根据标准曲线计算上清液中IL-1β含量。
1.6 免疫印迹法检测mGluR5及MAPK信号分子的表达取适量样品进行SDS-PAGE。样品在浓缩胶恒压电泳100 V 30 min,进入分离胶后提高电压至150 V,继续电泳约50 min。电泳后将凝胶中的蛋白转移至PVDF膜,通过Bio Radmini-Protein 电转系统(美国BioRAD公司) 进行湿转,转后PVDF膜经5%脱脂奶粉室温封闭1 h,加入相应稀释过的一抗,4 ℃孵育过夜,TBST缓冲液洗膜,5 min × 4次,二抗经稀释(1 ∶ 5000~1 ∶ 10 000) 后,室温孵育1 h,TBST缓冲液洗膜,5 min × 4次,于Amersham Imager 600仪器曝光条带,Image J软件分析Western Blot条带的灰度。
1.7 统计学分析采用GraphPad Prism 5软件进行单因素方差分析,数据以均数±标准差(x±s)表示,P<0.05为差异有统计学意义。
2 结果 2.1 激活mGluR5抑制LPS引起的小胶质细胞炎症反应为了探究激活mGluR5抑制小胶质细胞激活的机制。实验采用LPS诱导小胶质细胞激活,并通过加入mGluR5 特异性激动剂CHPG预处理细胞,观察激活mGluR5对LPS诱导小胶质细胞激活的影响。实验采用CHPG预处理小胶质细胞30 min后,加入LPS诱导小胶质细胞活化,24 h后收集上清,Griess方法检测NO的含量,ELISA方法检测IL-1β的含量。结果显示:200ng/ml LPS可以使小胶质细胞释放 IL-1β(图 1A)增加0.77倍(P=0.009),同时使NO(图 1B)的释放量增加0.68倍(P=0.0093),然而在200 μmol/L CHPG预处理的情况下,IL-1β(P=0.001)以及NO(P=0.047)的释放均被抑制。结果说明激活mGluR5可抑制小胶质细胞引起的炎症反应,与文献报道一致[11, 12],从而建立了本研究体系。
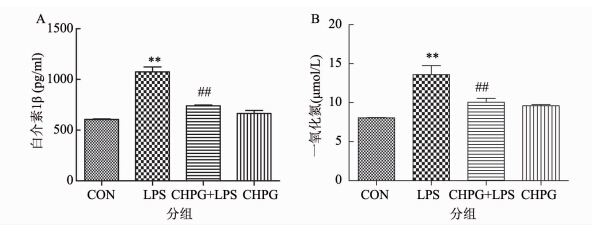
|
| 图 1 激活mGluR5抑制LPS引起的小胶质细胞炎症反应 Fig. 1 CHPG inhibited LPS-induced activation in microglia 注:A.CHPG对LPS诱导小胶质细胞释放IL-1β的影响n6,**P=0.009 vs. 对照组; ##P=0.001 vs. LPS 处理组; B. CHPG对LPS诱导小胶质细胞释放NO的影响n6,**P=0.0093 vs. 对照组; #P=0.047 vs. LPS 处理组;CHPG单独处理组对IL-1β和NO的释放无明显影响。 |
文献报道,TNF-α和IL-1β等炎症因子处理小胶质细胞后,mGluR5基因表达下调[10]。为了探讨LPS诱导的小胶质细胞炎症反应对mGluR5的影响,实验检测了LPS处理下mGluR5的蛋白表达。采用不同浓度的LPS作用于小胶质细胞24 h后,收取蛋白进行western blotting。结果显示,随着LPS作用浓度的增加,BV2小胶质细胞中mGluR5的蛋白表达水平下降,200,250,500(ng/ml)LPS依次下调mGluR5 55.1%,54.9%,49.5%(P=0.000)。提示炎症发生过程中mGluR5表达量的降低,mGluR5活性下降,可能是导致炎症发生的原因之一。
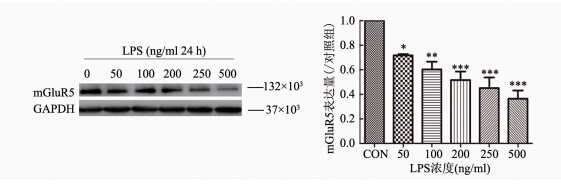
|
| 图 2 LPS诱导mGluR5的蛋白表达下降 Fig. 2 LPS resulted in the dose-depended decrease in mGluR5 expression 注:mGluR5随不同浓度LPS (50~500 ng/ml)的表达及统计图n5, ***P=0.000 vs. 对照组 |
上述实验结果显示,LPS抑制mGluR5表达,诱导炎症反应。那么激活mGluR5能否通过调节mGluR5,进而通过影响其下游信号通路发挥其抑制炎症的作用?实验采用200 μmol/L CHPG预处理小胶质细胞30 min,然后加入200 ng/ml LPS处理24 h,裂解细胞收取蛋白,Western Blot 检测mGluR5蛋白表达的情况。结果显示,LPS能够造成mGluR5蛋白表达的下降(P=0.000),CHPG预处理可以缓解由LPS造成的mGluR5蛋白表达的下降(P=0.0003),CHPG单独作用也起到上调mGluR5的作用(P=0.021)(图 3A)。同时发现,LPS处理细胞24 h时,引起JNK的磷酸化水平下降了56.5%(P=0.041),200 μmol/L CHPG处理可逆转LPS的下调作用(P=0.005)(图 3B)。结果表明,激活mGluR5可上调mGluR5蛋白,进而影响其下游信号JNK通路。
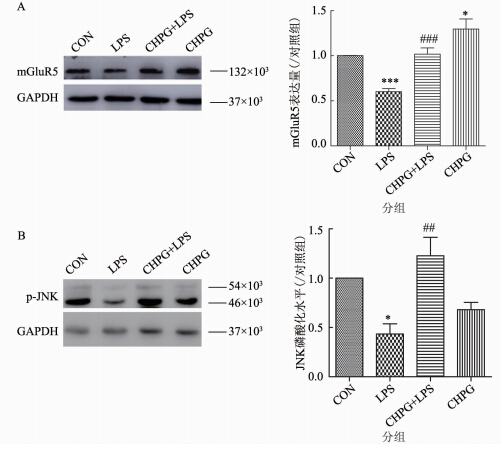
|
| 图 3 CHPG上调了由LPS诱导的mGluR5蛋白表达的下降及其相关信号通路 Fig. 3 CHPG reversed LPS-induced decrease of mGluR5 expression and JNK phosphorylation in microglial cells 注:A. CHPG对LPS诱导的mGluR5表达的影响及统计n3,***P=0.000 vs. 对照组; ###P=0.0003 vs. LPS处理组; *P=0.021 vs. 对照组;B. CHPG对LPS诱导的JNK磷酸化水平的影响及统计n3,*P=0.041 vs. 对照组; ##P=0.005 vs. LPS处理组。 |
以上实验结果提示,激活mGluR5可能通过上调mGluR5的表达,并激活其下游JNK信号通路抑制LPS诱导的小胶质细胞激活。为进一步验证上述结果,实验选用shRNA将小胶质细胞中mGluR5的表达敲低。转染质粒24 h后,Western Blot 的结果显示,与对照组相比,感染质粒组mGluR5表达下降62.6%(P=0.0001)(图 4A)。 在此基础上,CHPG预处理小胶质细胞30 min,然后再加入LPS孵育24 h。mGluR5未被敲减但已经稳定48 h的小胶质细胞,LPS对小胶质细胞激活更加明显,使炎症因子IL-1β以及NO的释放量分别增加至原来的4.02(P=0.0005)和4.15倍(P=0.0001)(图 4 B、C),CHPG预处理30 min减弱了LPS对小胶质细 胞的激活作用(P=0.0071,P=0.0061),但是mGluR5被敲低之后,CHPG不再减少IL-1β及NO的释放,与LPS处理组相比无统计学差异(P=0.4694,P=0.4407)(图 4B、C)。此实验结果进一步证明,激活mGluR5发挥的抑制炎症作用是通过调节mGluR5的表达实现的。
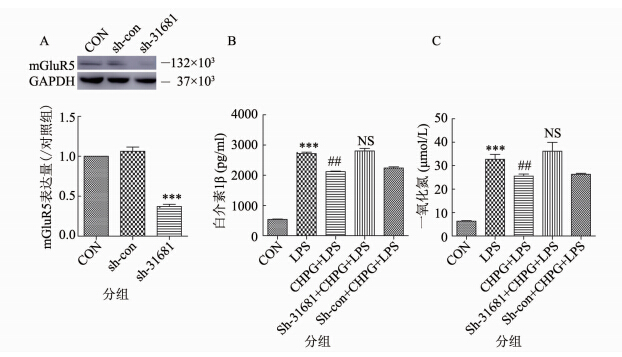
|
| 图 4 敲减mGluR5对 LPS引起的小胶质细胞炎症反应的影响 Fig. 4 The effects of CHPG were mediated by the mGluR5 注:A.免疫印迹法检测转染质粒sh-31681 24 h后的转染效率n3,***P=0.0001 vs. 对照组;B.在mGluR5未被敲除和敲除的细胞中,CHPG对LPS诱导的小胶质细胞释放IL-1β的影响n6,***P=0.0005 vs. 对照组;##P=0.0071 vs. LPS处理组; NS: P=0.4694 vs. LPS 处理组;C.在mGluR5未被敲除和敲除的细胞中,CHPG对LPS诱导的小胶质细胞释放NO的影响n6,***P=0.0001 vs. 对照组; ##P=0.0061 vs. LPS处理组; NS: P=0.4407 vs. LPS 处理组。 |
为了证明LPS在激活小胶质细胞以及CHPG在抗炎过程中并没有对小胶质细胞的活力产生影响,从而排除由细胞凋亡引起的干扰因素。用LPS和CHPG分别及共同与BV2小胶质细胞孵育24 h,流式细胞术检测细胞存活率。结果显示(图 5),采用200 ng/ml LPS和200 μmol/L CHPG均未对小胶质细胞活力产生明显的影响(P=0.6314),提示在本实验体系中激活mGluR5对小胶质细胞的作用是通过影响其炎症作用,并未引起细胞死亡。
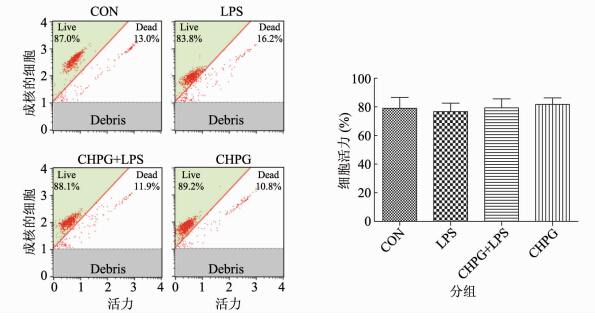
|
| 图 5 流式细胞术检测细胞活力 Fig. 5 The effect of CHPG and LPS on the viability of BV2 cells 注:流式细胞术检测200 ng/ml LPS和200 μmol/L CHPG单独或者共同作用于BV2 小胶质细胞24 h对细胞活力的影响n3,P=0.6314。 |
mGluR5在小胶质细胞中有表达,并与小胶质细胞的激活密切相关[12, 13, 14]。mGluR5特异性激动剂CHPG可以减弱由LPS或者干扰素-γ造成的小胶质细胞的激活及相关炎症因子的释放[12, 15],但是其具体的机制并不是很清楚。 本结果显示LPS激活小胶质细胞增加NO和IL-1β的释放量的同时,使小胶质细胞中mGluR5的表达量下降,而CHPG可以缓解该受体表达的下降并激活其下游的JNK信号通路减少NO和IL-1β释放。提示CHPG通过增加mGluR5受体表达抑制了小胶质细胞诱导的神经炎症。另一方面,shRNA敲减mGluR5受体表达使CHPG抑制炎症反应的功能减弱,进一步说明了激活mGluR5抑制炎症需要高表达量的mGluR5。
炎症因子的大量释放是小胶质细胞激活的标志。本研究中用200 ng/ml LPS刺激BV2小胶质细胞使得炎症因子NO及IL-1β释放增加,与文献报道一致[16]。与MPEP抑制mGluR5活性使得炎症增加,一氧化氮合酶的表达进一步增加[17]相反的是,用200 umol/L CHPG激活mGluR5,会减弱小胶质细胞的激活,使NO、IL-1β的释放减少,与文献报道一致[12]。同时也证明了炎症因子释放减少并不是由于细胞凋亡导致。炎症因子的释放与mGluR5的表达活性相关,小胶质细胞激活释放的IL-1β能够反馈下调胶质细胞上谷氨酸转运体的活性[18]。 用LPS刺激小胶质细胞48 h后所得的培养基继续作用于星形胶质细胞后会使mGluR5在mRNA水平和蛋白水平上的表达都有所下降,而单纯的LPS刺激星形胶质胶质细胞48 h后也有同样的效果[10]。提示LPS与胶质细胞中mGluR5的表达有关系。本研究结果发现,不同浓度的LPS作用于BV2细胞24 h,mGluR5随LPS作用浓度的上升而下降。CHPG抑制小胶质细胞激活的功能是由于其逆转了LPS的作用,使mGluR5的表达上升实现的。同时,这也可能与CHPG减少IL-1β或者 TNF-α的释放量使炎症因子的负反馈作用减弱有关,但是需要加入IL-1β或者TNF-α的特异性拮抗剂进行验证。在此基础上通过敲低mGluR5的方式进一步证明CHPG抑制小胶质细胞激活需要mGluR5的参与。尽管有文献支持,mGluR5的激动剂的神经保护作用并不是由于其直接作用在mGluR5受体本身,而是作用在NMDA受体上[19],但我们的研究发现,mGluR5被敲减之后,CHPG抑制NO,IL-1β的功能消失,与Byrnes等[12]用基因敲除的大鼠的结果一致,进一步说明CHPG需要上调mGluR5并且依赖于mGluR5的存在。有文献报道,激活mGluR5能够减少p22phox和 gp91 phox的表达,减低二者在膜上相互结合力,是NADPH氧化酶的活性减弱,从而抑制ROS的产生,说明GHPG的抗炎作用部分依赖于低活性的NADPH氧化酶[15],以后将从mGluR5受体与NADPH氧化酶的关系进一步探讨CHPG上调mGluR5受体表达的机制。本实验结果说明,炎症的发生过程引起了mGluR5表达量的降低,从而阻止mGluR5活性能力的发挥,这可能是导致炎症发生的原因之一。激活mGluR5通过上调mGluR5的表达量,从而发挥了 mGluR5抑制炎症的作用。
小胶质细胞激活是许多神经疾病的致病原因之一,因此阐明与小胶质细胞激活相关的信号通路变化对探索疾病新的作用靶点具有深远的意义。大量文献证明,MAPK 信号通路中ERK、JNK 和 p38 及下游转录因子都与小胶质细胞激活相关。 例如,ERK的激活在小胶质细胞激活诱导线粒体ROS过程中起到一定的作用[20],在JNK被抑制的小胶质细胞中,环氧酶的表达明显降低[21],IL-1β上调了小胶质细胞中p38的表达而并没有增加ERK的表达[22]。另一方面,mGluR5通过PLC、PKC及Ca2+信号通路参与调控小胶质细胞的激活[12]。 提示此受体参与小胶质细胞激活的信号转导通路的调节。本文借鉴mGluR5调控小胶质细胞激活中的信号通路及其下游的转录因子,与以往的研究短时间LPS激活MAPK信号通路[19]不同的是,我们发现24 h LPS作用下调小胶质细胞mGluR5表达的同时,也抑制其下游的JNK的磷酸化,而CHPG可以逆转JNK的活性下降。初步证明了CHPG可能通过上调mGluR5受体表达量进而上调该受体介导的下游的MAPK信号通路实现抑制小胶质细胞激活的功能。我们推测MAPK信号通路中的ERK,p38信号通路也应该发挥了一定的功能。
mGluR5被认为是许多急、慢性脑损伤及神经退行性疾病神经保护功能的作用靶位点[9, 23]。大鼠局灶性脑缺血模型中,激活mGluR5能够减小缺血体积,改善神经系统功能[24]。激活mGluR5能够有效缓解创伤性脑损伤的疾病进程,提高功能恢复[25]。脊髓损伤模型28天后,小胶质细胞中mGluR5的表达有所下降,激活mGluR5能够提高运动功能恢复,减小病灶体积[26, 27],在mGluR5敲除的大鼠中,CHPG不能很好的抑制炎症发生[12],增加mGluR5受体表达量进而激活受体也许可以成为防治疾病的有效手段。本研究通过基因敲除首次从受体表达方面来探究CHPG抑制小胶质细胞激活的机制。揭示了CHPG上调mGluR5的受体表达量,并且增加下游信号分子 JNK的磷酸化起到抑制炎症的作用,为抑制小胶质细胞激活,保护神经元细胞,进而防止疾病的发生提供了新的作用靶点。
| [1] | Polazzi E, Monti B. Microglia and neuroprotection: from in vitro studies to therapeutic applications[J]. Prog Neurobiol,2010,92(3):293-315. |
| [2] | Walter L, Neumann H. Role of microglia in neuronal degeneration and regeneration[J]. Semin Immunopathol,2009,31(4):513-525. |
| [3] | Ghoshal A, Das S, Ghosh S, et al. Proinflammatory mediators released by activated microglia induces neuronal death in Japanese encephalitis[J]. Glia,2007,55(5):483-496. |
| [4] | Burguillos MA, Deierborg T, Kavanagh E, et al. Caspase signalling controls microglia activation and neurotoxicity[J]. Nature,2011,472(7343):319-324. |
| [5] | Neher JJ, Neniskyte U, Zhao JW, et al. Inhibition of microglial phagocytosis is sufficient to prevent inflammatory neuronal death[J]. J Immunol,2011,186(8):4973-4983. |
| [6] | Saijo K, Crotti A, Glass CK. Regulation of microglia activation and deactivation by nuclear receptors[J]. Glia,2013,61(1):104-111. |
| [7] | Gao F, Chen D, Hu QS, et al. Rotenone directly induces BV2 cell activation via the p38 MAPK pathway[J]. PLoS One,2013,8(8):e72046. |
| [8] | Han QD, Liu SW, Li ZW, et al. DCPIB, a potent volume-regulated anion channel antagonist, attenuates microglia-mediated inflammatory response and neuronal injury following focal cerebral ischemia[J]. Brain Res,2014,1542:176-185. |
| [9] | Byrnes KR, Loane DJ, Faden AI. Metabotropic glutamate receptors as targets for multipotential treatment of neurological disorders[J]. Neurotherapeutics,2009,6(1):94-107. |
| [10] | Tilleux S, Berger J, Hermans E. Induction of astrogliosis by activated microglia is associated with a down-regulation of metabotropic glutamate receptor 5[J]. J Neuroimmunol,2007,189(1/2):23-30. |
| [11] | Farso MC, O'Shea RD, Beart PM. Evidence group I mGluR drugs modulate the activation profile of lipopolysaccharide-exposed microglia in culture[J]. Neurochem Res,2009,34(10):1721-1728. |
| [12] | Byrnes KR, Stoica B, Loane DJ, et al. Metabotropic glutamate receptor 5 activation inhibits microglia associated inflammation and neurotoxicity[J]. Glia,2009,57(5):550-560. |
| [13] | Arsenault D, Zhu AJ, Gong CY, et al. Hypo-anxious phenotype of adolescent offspring prenatally exposed to LPS is associated with reduced mGluR5 expression in hippocampus[J]. Open J Med Psychol,2014,3(3):202-211. |
| [14] | Loane DJ, Stoica BA, Faden AI. Metabotropic glutamate receptor-mediated signaling in neuroglia[J]. Wiley Interdiscip Rev Membr Transp Signal,2012,1(2):136-150. |
| [15] | Loane DJ, Stoica BA, Pajoohesh-Ganji A, et al. Activation of metabotropic glutamate receptor 5 modulates microglial reactivity neurotoxicity by inhibiting NADPH oxidase[J]. J Biol Chem,2009,284:15629-15639. |
| [16] | De-Oliveira ACAX, Poça KS, Totino PRR, et al. Modulation of Cytochrome P450 2A5 Activity by Lipopolysaccharide: Low-Dose Effects and Non-Monotonic Dose-Response Relationship[J]. PLoS One,2015,10(1):e0117842. |
| [17] | Chantong B, Kratschmar DV, Lister A, et al. Inhibition of metabotropic glutamate receptor 5 induces cellular stress through pertussis toxin-sensitive Gi-proteins in murine BV-2 microglia cells[J]. J Neuroinflammation,2014,11(1):190. [Epub ahead of print] |
| [18] | Yan XS, Jiang ES, Weng HR. Activation of toll like receptor 4 attenuates GABA synthesis and postsynaptic GABA receptor activities in the spinal dorsal horn via releasing interleukin-1 beta[J]. J Neuroinflammation,2015,12(1):4. [Epub ahead of print] |
| [19] | Lea PM, Movsesyan VA, Faden AI. Neuroprotective activity of the mGluR5 antagonists MPEP and MTEP against acute excitotoxicity differs and does not reflect actions at mGluR5 receptors[J]. Br J Pharmacol,2005,145(4):527-534. |
| [20] | Park J, Min JS, Kim B, et al. Mitochondrial ROS govern the LPS-induced pro-inflammatory response in microglia cells by regulating MAPK and NF-κB pathways[J]. Neurosci Lett,2015,584:191-196. |
| [21] | Gong YT, Xue B, Jiao J, et al. Triptolide inhibits COX-2 expression and PGE2 release by suppressing the activity of NF-κB and JNK in LPS-treated microglia[J]. J Neurochem,2008,107(3):779-788. |
| [22] | Yang KY, Bae WS, Kim MJ, et al. Participation of the central p38 and ERK1/2 pathways in IL-1β-induced sensitization of nociception in rats[J]. Prog Neuro-Psychopharmacol Biol Psychiatry,2013,46:98-104. |
| [23] | Pajoohesh-Ganji A, Byrnes KR. Novel neuroinflammatory targets in the chronically injured spinal cord[J]. Neurotherapeutics,2011,8(2):195-205. |
| [24] | Bao WL, Williams AJ, Faden AI, et al. Selective mGluR5 receptor antagonist or agonist provides neuroprotection in a rat model of focal cerebral ischemia[J]. Brain Res,2001,922(2):173-179. |
| [25] | Byrnes KR, Loane DJ, Stoica BA, et al. Delayed mGluR5 activation limits neuroinflammation and neurodegeneration after traumatic brain injury[J]. J Neuroinflamm,2012,9:43. |
| [26] | Lea Ⅳ PM, Custer SJ, Vicini S, et al. Neuronal and glial mGluR5 modulation prevents stretch-induced enhancement of NMDA receptor current[J]. Pharmacol Biochem Behav,2002,73(2):287-298. |
| [27] | Byrnes KR, Stoica B, Riccio A, et al. Activation of metabotropic glutamate receptor 5 improves recovery after spinal cord injury in rodents[J]. Ann Neurol,2009,66(1):63-74. |
 2015, Vol. 30
2015, Vol. 30


