扩展功能
文章信息
- 张艾煜, 顾一心, 梁昊, 邓义贞, 何利华, 张建中, 张茂俊
- ZHANG Ai-yu, GU Yi-xin, LIANG Hao, DENG Yi-zhen, HE Li-hua, ZHANG Jian-zhong, ZHANG Mao-jun
- 我国607株不同宿主来源弯曲菌耐药基因簇aadE-sat4-aphA-3分布分析
- Distribution of aminoglycoside resistance gene cluster aadE-sat4-aphA-3 in 607 Campylobacter isolates from different sources in China
- 疾病监测, 2015, 30(6): 479-484
- Disease Surveillance, 2015, 30(6): 479-484
- 10.3784/j.issn.1003-9961.2015.06.012
-
文章历史
- 收稿日期:2015-03-16
2. 四川农业大学动物医学院环境公害与动物疾病四川省高校重点实验室,四川农业大学动物疫病与人类健康四川省高校重点实验室,四川 雅安 625014
2. University Key Laboratory for Environmental Hazard and Animal Epidemic Disease,University Key Laboratory For Animal Epidemic Disease and Human Health,Sichuan Agriculture University,Ya'an 625014,Sichuan,China
弯曲菌是当前世界范围内食源性疾病的主要病原体,仅在美国每年就有超过100万病例[1,2,3]。人类弯曲菌病主要由空肠弯曲菌(Campylobacter jejuni,C.jejuni)和结肠弯曲菌(Campylobacter coli,C.coli)导致,家禽、家畜是人类弯曲菌病的主要宿主来源[4,5]。弯曲菌病通常为自限性,但对于免疫力低下及病程迁延的患者行抗生素治疗是必须且有效的,虽然大环内酯类和氟喹诺酮类为常用药物,但在菌血症、全身感染及重度感染中氨基糖苷类抗生素通常作为备选药物[4]。
目前已经报道的弯曲菌氨基糖苷类耐药的最主要机制是酶修饰降低氨基糖苷类对rRNA A位点的亲和力[6,7,8]。这些酶根据催化类型被分为三类:氨基糖苷乙酰转移酶(AACs)、氨基糖苷核酸转移酶(ANTs/AADs)和氨基糖苷磷酸转移酶(APHs),第一株人源结肠弯曲菌耐药株即是由aphA-3编码的3′-氨基糖苷磷酸转移酶介导,该基因仍是弯曲菌氨基糖苷类耐药的常见机制[9]。氨基糖苷类抗生素耐药基因簇aadE-sat4-aphA-3目前主要报道在革兰阳性菌分布,1996年氨基糖苷类耐药基因簇aadE-sat4-aphA-3首次发现于金黄色葡萄球菌转座子Tn5405中。2004年首次在1株分离自临床病例的空肠弯曲菌质粒上发现该基因簇,目前在空肠弯曲菌、结肠弯曲菌的染色体及质粒上陆续发现该基因簇的存在[10,11,12]。该基因簇中aadE 和aphA-3基因主要编码6-腺苷酰(基)转移酶(AAD(6′))和3-磷酸转移酶(APH(3′)-Ⅲ),分别可导致链霉素、卡那霉素和新霉素耐药。而sat4基因可导致链丝霉素耐药,是目前临床极少用于临床患者甚至动物感染治疗的药物。耐药基因簇aadE-sat4-aphA-3的存在表明含有该基因簇的耐药菌株是在多重、多种氨基糖苷类抗生素压力存在下的选择结果,对于耐药弯曲菌的传播、监测及防控具有重要意义。
为进一步获得我国不同宿主来源分离菌株氨基糖苷类耐药特征尤其耐药基因簇aadE-sat4-aphA-3在耐药菌株中的分布特征,本研究选取607株分离自不同宿主的弯曲菌进行抗生素敏感性分析,针对耐药菌株进行aadE-sat4-aphA-3基因簇的分布分析。进一步针对耐药菌株的遗传特征进行序列分型分析,为我国弯曲菌的耐药特征获得以及耐药机理的研究提供理论依据,同时为我国重要耐药弯曲菌菌株的监测提供依据。
1 材料与方法 1.1 材料 1.1.1 菌株质控菌株C.jejuni(ATCC 33560),C.coli (WHO 10.2)为本研究室保存。607株弯曲菌中350株来源于鸡粪,234株来源于腹泻患者,23株来源于猪粪。
1.1.2 试剂CAMPYLOBACTER AGAR BASE(Karmali)(CM0935)、MUELLER-HINTONAGAR(CM0337)购自OXOID公司,链霉素(Streptomycin,SM)购自美国SIGMA公司,脱纤维羊血购自北京兰博瑞生物制品有限公司,DNA提取试剂盒QIAamp DNA Mini Kit(250)购自QIAGEN(北京)公司,Gelred 10 000×染料(BIOTIUM,Cat:41003,Lot:11G0127),2×EsayTaq PCR SuperMix购自全式金公司(CAT:AS111),Trans2K DNA Marker购自全式金公司(BM101),Regular Agarose G-10(BIOWEST LOT:111860)。
1.2 方法 1.2.1 细菌培养及药敏试验将菌株接种于含有5%脱纤维羊血的Karmali培养基上,置于37℃微需氧(5% O2、10% CO2、85% N2)条件下培养48 h,挑取3代单克隆后增菌[13]。
按照世界卫生组织全球食源性病原菌感染网络(global foodborne infections network,GFN)推荐的弯曲菌的琼脂稀释法(Agar Dilution Method)对菌株进行药敏试验。首先将链霉素按照要求配成5120μg/ml的原液,然后将其倍比稀释成2560~1.25μg/ml 12个浓度梯度;MH培养基高压蒸汽灭菌后置于恒温水浴中冷却至50 ℃,加入5%的脱纤维羊血;90 mm培养皿中分别加入2.5 ml各浓度梯度的抗生素溶液后加入22.5 ml含5%脱纤维羊血的MH培养基,则培养皿抗生素浓度梯度为512~0.125μg/ml,充分混匀后冷却待用[14]。将菌溶于无菌生理盐水中稀释至0.5个麦氏单位(McFarland)并于15 min内使用打点仪将菌液接种于各浓度梯度的培养皿上。37 ℃微需氧培养48 h后读取结果。
1.2.2 aadE-sat4-aphA-3基因簇筛查aadE-sat4-aphA-3耐药基因簇筛查所用引物:前引物clu-F:5′-GGA GAA ACT TTT GTC CAC CTA CC-3′,后引物clu-R:5′-AAT GTC ATA CCA CTT GTC CGC-3′,产物长度为1538 bp。25μl体系:2×EsayTaq PCR SuperMix 12.5μl,前引物(10μmol/L) 1.25μl,后引物(10μmol/L) 1.25μl,PCR H2O 9μl,模板1μl共25μl。按照以下程序:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 90 s,72 ℃ 90 s,共30个循环;72 ℃ 10 min。使用1.5%琼脂糖凝胶电泳检测扩增产物。其中测序菌株SH-CCS11C305为扩增阳性对照,菌株ICDC-CJ07001为扩增阴性对照。
1.2.3 菌株的分子分型及菌型特征分析从链霉素耐药弯曲菌中按不同来源选取100株进行多位点序列分型(multiloucus sequence typing,MLST)分析 ,其中空肠弯曲菌40株,结肠弯曲菌60株。分别来自腹泻患者(40株)、鸡(40株)、猪(20株)。每株菌等位基因的序列号、ST型别及克隆系从弯曲菌MLST数据库(http://pubmlst.org/campylobacter/)比对获得,获得的新型别提交数据库后指定新的序列号及ST型别[17]。根据其序列型别(sequence typing,ST)的结果利用Bionumirics 5.10软件进行菌株的ST型聚类分析,获得最小生成树图。
2 结果 2.1 药敏结果607株弯曲菌中共筛查到221株(36.41%)链霉素耐药株,其中腹泻患者来源菌株耐药率为33.33%(78/234)、鸡来源菌株耐药率为35.14%(123/350)、猪来源菌株耐药率为86.96%(20/23)。不同宿主来源的耐药率的差异有统计学意义(χ2=26.580,P<0.001),两两比较结果表明人源与鸡源弯曲菌耐药率差异无统计学意义 (χ2=0.203,P=0.652),而猪源弯曲菌耐药率显著高于人源弯曲菌(χ2=25.525,P<0.001)。鸡源与猪源弯曲菌耐药率差异有统计学意义(χ2=24.509,P<0.001)。菌株中空肠弯曲菌耐药率为14.37%(51/355),结肠弯曲菌耐药率为67.46%(170/252),结肠弯曲菌耐药率显著高于空肠弯曲菌 (χ2=179.445,P<0.001)。不同宿主来源菌株链霉素的耐药率见图1。
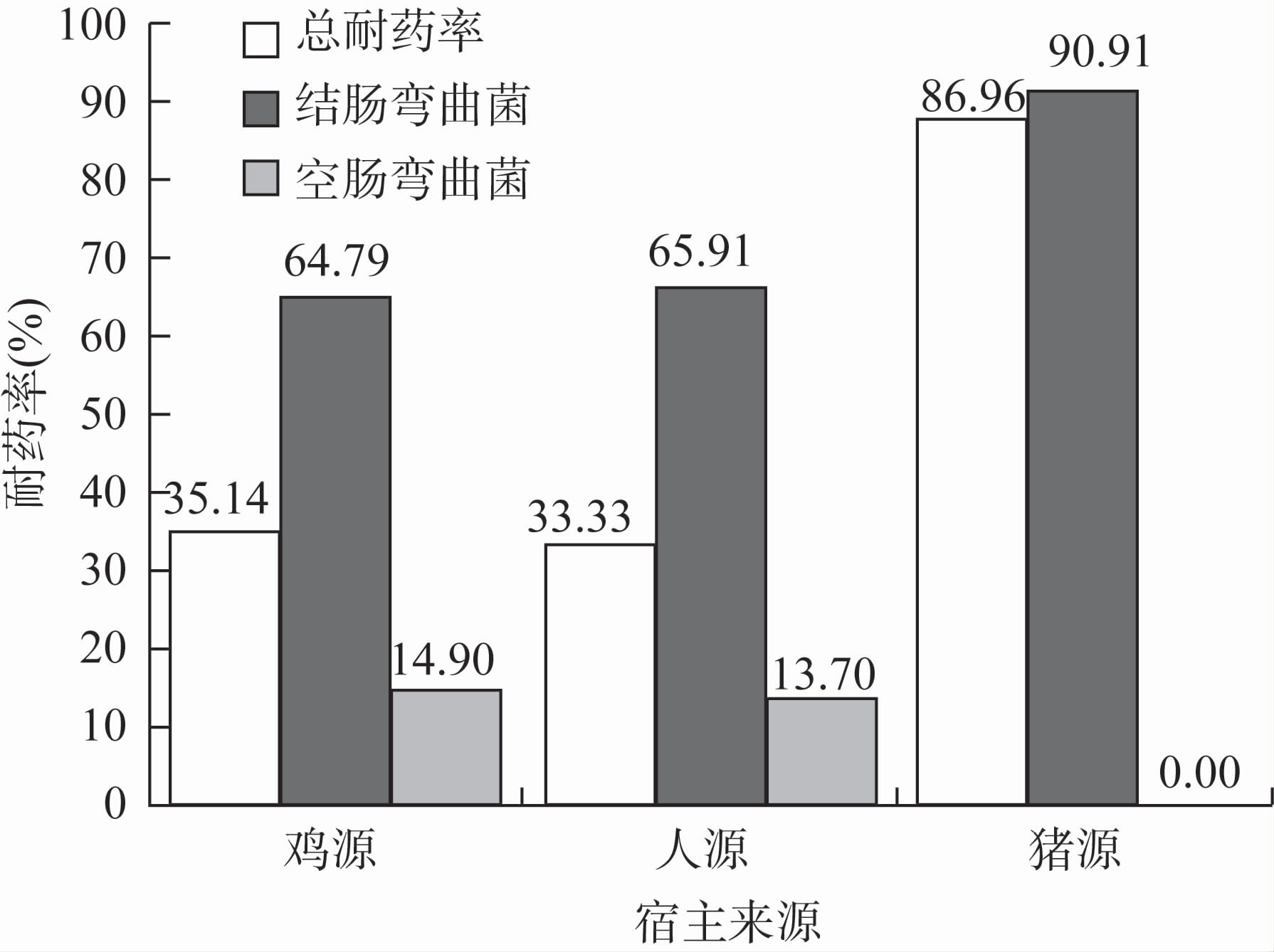
|
| 图1 不同来源菌株链霉素耐药率 Fig.1 Streptomycin resistant rates of Campylobacter isolates from different sources |
图2为样品与阳性对照、阴性对照的琼脂糖电泳图,aadE-sat4-aphA-3耐药基因簇阳性的菌株PCR扩增产物长度为1538 bp。221株链霉素耐药弯曲菌中aadE-sat4-aphA-3阳性菌株24株(10.86%),其中结肠弯曲菌18株、空肠弯曲菌6株;14株来源于腹泻患者,4株来源于鸡,6株来源于猪。
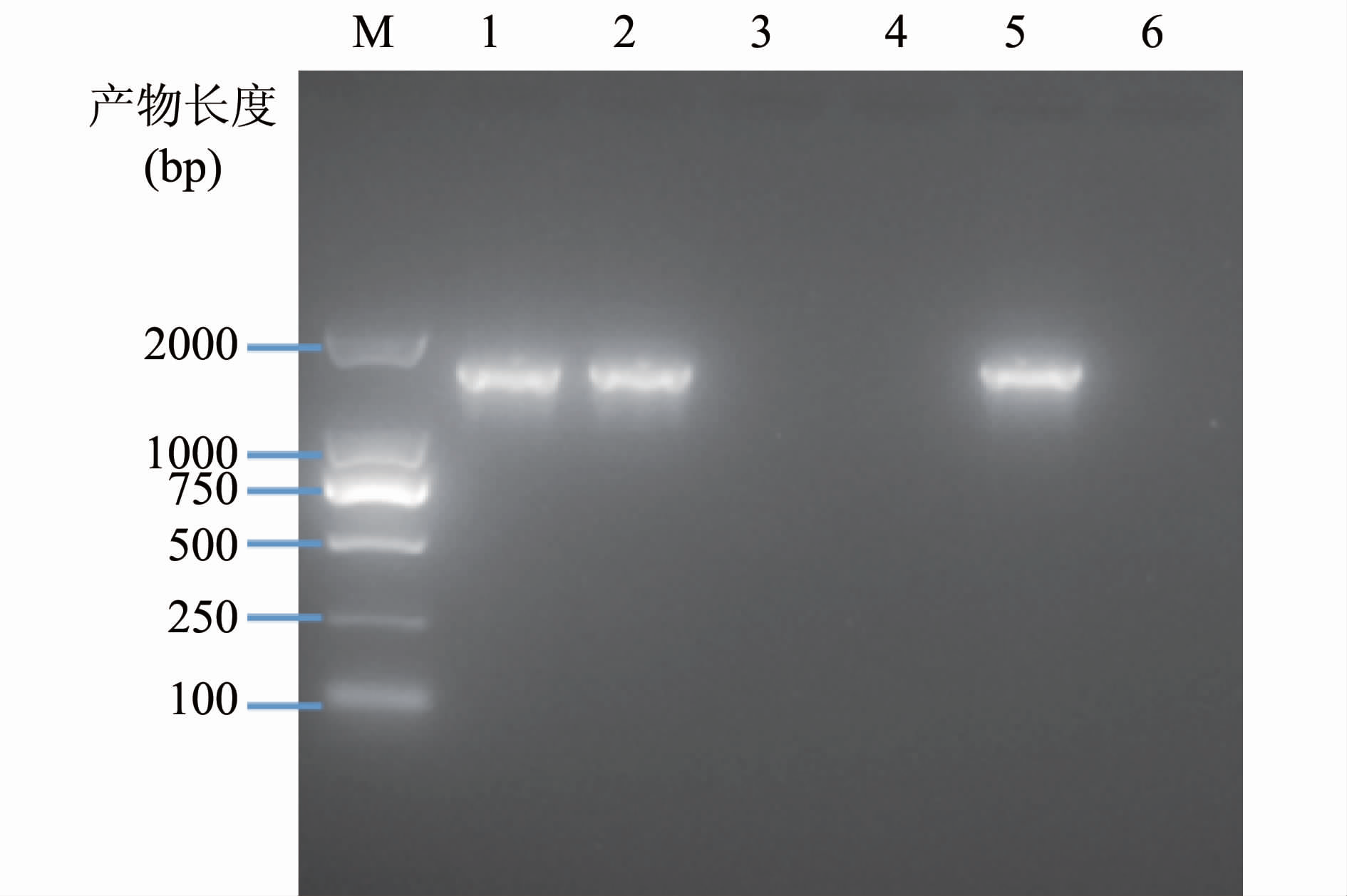
|
| 图2 PCR产物DNA琼脂糖凝胶电泳结果 Fig.2 Agarose gel electrophoresis result for PCR product of aadE-sat4-aphA-3 注: M:Trans 2K DNA Marker; 样品1、2为阳性,样品3、4为阴性; 5:阳性对照; 6:阴性对照。 |
MLST结果将选取的100 株菌分为58个ST型。腹泻患者菌株分为27个序列型,鸡粪来源分为21个序列型,猪粪来源分 为10个序列型,耐药菌株的分型结果见表1。
| ST型别 | 腹泻患者菌株数 | 鸡粪菌株数 | 猪粪菌株数 | ST型别 | 腹泻患者菌株数 | 鸡粪菌株数 | 猪粪菌株数 |
| 829 | 1 | 1 | 1 | 7263 | 3 | ||
| 860 | 1 | 2 | 2274 | 2 | |||
| 2328 | 1 | 1 | 3753 | 2 | |||
| 6917 | 1 | 1 | 3917 | 2 | |||
| 22 | 3 | 19 | 1 | ||||
| 137 | 3 | 51 | 1 | ||||
| 825 | 3 | 131 | 1 | ||||
| 1625 | 3 | 354 | 1 | ||||
| 5510 | 3 | 760 | 1 | ||||
| 3897 | 2 | 872 | 1 | ||||
| 6964 | 2 | 924 | 1 | ||||
| 6966 | 2 | 1586 | 1 | ||||
| 49 | 1 | 2036 | 1 | ||||
| 1145 | 1 | 2133 | 1 | ||||
| 1450 | 1 | 2637 | 1 | ||||
| 2031 | 1 | 3909 | 1 | ||||
| 2140 | 1 | 5506 | 1 | ||||
| 2842 | 1 | 7275 | 1 | ||||
| 5442 | 1 | 1464 | 1 | 6 | |||
| 6184 | 1 | 6316 | 4 | ||||
| 6185 | 1 | 1117 | 2 | ||||
| 6186 | 1 | 1055 | 1 | ||||
| 6318 | 1 | 1107 | 1 | ||||
| 6323 | 1 | 1563 | 1 | ||||
| 6956 | 1 | 4938 | 1 | ||||
| 6963 | 1 | 6315 | 1 | ||||
| 6967 | 1 | 6320 | 1 | ||||
| 7280 | 5 | 6952 | 1 | ||||
| 1121 | 4 | 合计 | 40 | 40 | 20 | ||
| 6322 | 3 |
聚类结果见图3。图中显示不同型别弯曲菌可来自不同宿主,不同来源耐药菌株菌型可分散在不同的组群中,耐药弯曲菌没有形成显著的克隆群。
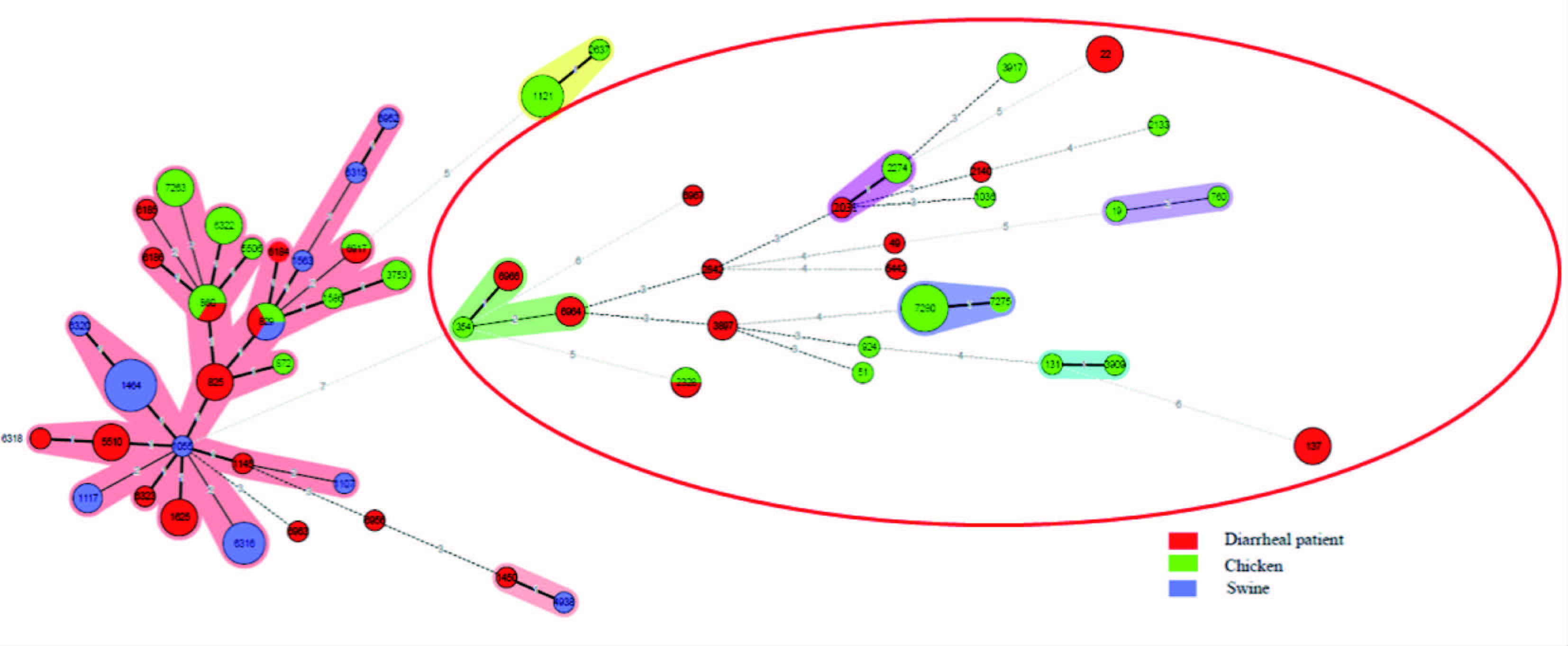
|
| 图3 100株弯曲菌最小生成树 Fig.3 Minimal spanning tree of 100 Campylobacter isolates 注:圆圈代表菌株数量,红色表示菌株来源于腹泻患者,绿色表示菌株来源于鸡粪,蓝色表示菌株来源于猪粪。红圈中为空肠弯曲菌,圈左侧部分聚集菌株为结肠弯曲菌。 |
弯曲菌是目前世界上普遍存在的食源性病原菌,人感染后可引起弯曲菌病,主要症状为腹泻性肠炎,部分空肠弯曲菌的感染与格林-巴利综合征(guillain-barré syndrome,GBS)密切相关[18,19,20]。链霉素属于氨基糖苷类抗生素,虽然链霉素的毒性较强,但在菌血症及全身感染、重度感染患者中通常作为备选药物。目前国内对于弯曲菌尤其是人源弯 曲菌链霉素耐药情况的报道相对缺乏。本研究对近年来分离自我国的不同宿主来源弯曲菌的链霉素耐药情况进行了研究,为我国弯曲菌的耐药特征研究提供了依据。
本研究对不同来源的607株弯曲菌进行了链霉素的药敏试验。结果表明,人源弯曲菌与鸡源弯曲菌的链霉素耐药率差异无统计学意义,而猪源弯曲菌的链霉素耐药率明显高于人源和鸡源弯曲菌,其耐药率差异有统计学意义,尤其是猪源结肠弯曲菌的耐药状况非常严重,与国内外已有研究报道结果一致[21,22,23]。2013-2014年Wieczorek等[24]和Giacomelli等[25]报道的禽源结肠弯曲菌链霉素耐药水平显著高于空肠弯曲菌与本研究结果吻合。2013年韩新锋等[26]的研究中分离自四川省的鸡源空肠弯曲菌链霉素耐药率为20.56%,与本研究相近。2013年Wieczorek和Osek[22]报道的波兰猪源结肠弯曲菌的链霉素耐药率80.49%、许紫建等[23]报道的北京郊区猪源弯曲菌链霉素耐药率90.48%与本实验结果相似,猪源弯曲菌对链霉素存在很高的耐药水平。
目前在空肠弯曲菌、结肠弯曲菌的染色体及质粒上均已发现aadE-sat4-aphA-3耐药基因簇的存在[9,10,11,12],但是关于该基因簇在我国菌株中的分布情况鲜有报道,尤其对于不同宿主来源菌株的耐药差异数据的获得,对于我国耐药菌株的传播和防控具有重要意义。目前我国只在鸡来源菌株中存在该基因簇的报道,其筛选菌株数量较少,阳性率为26/41(63.41%)[12]。本研究对221株不同来源的链霉素耐药弯曲菌进行了aadE-sat4-aphA-3耐药基因簇的筛查,阳性率为10.86%。虽然空肠弯曲菌中链霉素的耐药率相对结肠弯曲菌仍维持在较低的水平,但是已有实验表明在结肠弯曲菌中发现的该基因簇所在的耐药岛可通过自然转化转入空肠弯曲菌中,而人类弯曲菌病主要与空肠弯曲菌相关,一旦这种自然转化在自然界中发生,无疑将会对食品安全及公共卫生造成巨大的隐患[12]。
腹泻患者来源菌株的传播来源分析,对于我国耐药弯曲菌的监测和防控具有重要意义。本研究结果发现鸡来源菌株与人来源菌株的耐药率没有显著差异而与猪来源菌株差异显著,说明鸡可能是我国腹泻患者感染弯曲菌的主要来源。本研究中不同来源耐药菌株的分子分型分析结果表明不同来源及耐药结果之间无明显相关性,表明链霉素耐药菌株在弯曲菌中没有形成显著的克隆群分布,不同来源、不同型别的弯曲菌都可以产生链霉素耐药弯曲菌,不同型别的弯曲菌可以分布在不同的宿主来源中。
本研究初步获得我国不同宿主来源弯曲菌的氨基糖苷类抗生素的耐药特征及菌型特点,发现我国弯曲菌菌株的链霉素耐药率高于欧洲发达国家,猪来源弯曲菌的耐药率明显高于人源及鸡源弯曲菌。氨基糖苷类耐药基因簇aadE-sat4-aphA-3的存在对我国耐药弯曲菌的传播造成了潜在的隐患,对于该耐药基因簇的检测及监测对于我国弯曲菌感染的防控具有重要意义。
| [1] | Scallan E, Griffin PM, Angulo FJ, et al. Foodborne illness acquired in the United States—unspecified agents[J]. Emerg Infect Dis, 2011,17(1):16-22. |
| [2] | Zhang M, Meng F, Cao F, et al. Cloning, expression, and antigenicity of 14 proteins from Campylobacter jejuni [J]. Foodborne Pathog Dis, 2012,9(8):706-712. |
| [3] | Qin S, Wang Y, Zhang Q, et al. Report of ribosomal RNA methylase gene erm (B) in multidrug-resistant Campylobacter coli [J]. J Antimicrob Chemoth, 2014,69(4):964-968. |
| [4] | Zhao S, Mukherjee S, Chen Y, et al. Novel gentamicin resistance genes in Campylobacter isolated from humans and retail meats in the USA[J]. J Antimicrob Chemoth, 2015,first published online February 1,http://jac.oxfordjournals.org/content/early/2015/02/01/jac.dkv001.long. |
| [5] | Bywater R, Deluyker H, Deroover E, et al. A European survey of antimicrobial susceptibility among zoonotic and commensal bacteria isolated from food-producing animals[J]. J Antimicrob Chemoth, 2004,54(4):744-754. |
| [6] | Ramirez MS, Tolmasky ME. Aminoglycoside modifying enzymes[J]. Drug Resist Updat, 2010,13(6):151-171. |
| [7] | Wieczorek K, Osek J. Antimicrobial resistance mechanisms among Campylobacter[J]. Biomed Res Int, 2013,2013(340605):12. |
| [8] | Wilson DN. Ribosome-targeting antibiotics and mechanisms of bacterial resistance[J]. Nat Rev Microbiol, 2014,12(1):35-48. |
| [9] | Iovine NM. Resistance mechanisms in Campylobacter jejuni [J]. Virulence, 2013,4(3):230-240. |
| [10] | Derbise A, Dyke KG, Solh N. Characterization of a Staphylococcus aureus transposon, Tn5405, located within Tn5404 and carrying the aminoglycoside resistance genes, aphA-3 -and- aadE [J]. Plasmid, 1996,35(3):174-188. |
| [11] | Gibreel A, Skold O, Taylor DE. Characterization of plasmid-mediated aphA-3 kanamycin resistance in Campylobacter jejuni [J]. Microb Drug Resist, 2004,10(2):98-105. |
| [12] | Qin S, Wang Y, Zhang Q, et al. Identification of a novel genomic island conferring resistance to multiple aminoglycoside antibiotics in Campylobacter coli [J]. Antimicrob Agents Ch, 2012,56(10):5332-5339. |
| [13] | Liu XY, Yu JF, Gu YX, et al. Laboratory detection and surveillance of Campylobacter jejuni infection[J]. Disease Surveillance, 2014,29(5):354-358.(in Chinese) 刘夏阳,于俊峰,顾一心,等. 感染性腹泻患者弯曲菌感染的实验室检测及监测[J]. 疾病监测,2014,29(5):354-358. |
| [14] | Gu YX, He LH, Liu HY, et al. Drug susceptibility of Campylobacter jejuni isolated in China[J]. Disease Surveillance, 2013,28(4):314-318.(in Chinese) 顾一心,何利华,刘红莹,等. 空肠弯曲菌耐药谱特征分析[J].疾病监测,2013,28(4):314-318. |
| [15] | Zhang M, Gu Y, He L, et al. Molecular typing and antimicrobial susceptibility profiles of Campylobacter jejuni isolates from north China[J]. J Med Microbiol, 2010,59(Pt 10):1171-1177. |
| [16] | Zhang M, Liu X, Xu X, et al. Molecular subtyping and antimicrobial susceptibilities of Campylobacter coli isolates from diarrheal patients and food-producing animals in China[J]. Foodborne Pathog Dis, 2014,11(8):610-619. |
| [17] | Wei B, Cha SY, Kang M, et al. Antimicrobial Susceptibility Profiles and Molecular Typing of Campylobacter jejuni and Campylobacter coli Isolated from Ducks in South Korea[J]. Appl Environ Microbiol, 2014,80(24):7604-7610. |
| [18] | Zhang MJ, Zhang JZ. Campylobacteriosis and Guillain-Barre syndrome[J]. Chinese Journal of Epidemiology, 2008,29(6):618-621.(in Chinese) 张茂俊,张建中. 空肠弯曲菌病与格林-巴利综合征[J]. 中华流行病学杂志,2008,29(6):618-621. |
| [19] | Zhang M, Li Q, He L, et al. Association study between an outbreak of Guillain-Barre syndrome in Jilin, China, and preceding Campylobacter jejuni infection[J]. Foodborne Pathog Dis, 2010,7(8):913-919. |
| [20] | Louwen R, Horst-Kreft D, de Boer AG, et al. A novel link between Campylobacter jejuni bacteriophage defence, virulence and Guillain-Barre syndrome[J]. Eur J Clin Microbiol Infect Dis, 2013,32(2):207-226. |
| [21] | Chen X, Naren GW, Wu C, et al. Prevalence and antimicrobial resistance of Campylobacter isolates in broilers from China[J]. Vet Microbiol, 2010,144(1/2):133-139. |
| [22] | Wieczorek K, Osek J. Characteristics and antimicrobial resistance of Campylobacter isolated from pig and cattle carcasses in Poland[J]. Pol J Vet Sci, 2013,16(3):501-508. |
| [23] | Xu ZJ, Yang B,Qin XJ, et al. Isolation and antimicrobial susceptibility of Campylobacter in pig[J]. Chinese Journal of Zoonoses, 2013,29(3):237-241.(in Chinese) 许紫建,杨兵,覃湘婕,等. 猪源弯曲菌的分离鉴定及耐药性分析[J].中国人兽共患病学报,2013,29(3):237-241. |
| [24] | Wieczorek K, Kania I, Osek J. Prevalence and antimicrobial resistance of Campylobacter spp. isolated from poultry carcasses in Poland[J]. J Food Prot, 2013,76(8):1451-1455. |
| [25] | Giacomelli M, Salata C, Martini M, et al. Antimicrobial resistance of Campylobacter jejuni and Campylobacter coli from poultry in Italy[J]. Microb Drug Resist, 2014,20(2):181-188. |
| [26] | Han XF, Liu SL, Chen X, et al. Antimicrobial resistance analysis of Campylobacter jejuni isolates from chicken production chain[J]. Chinese Journal of Zoonoses, 2013,29(2):199-204.(in Chinese) 韩新锋,刘书亮,陈荀,等. 鸡肉生产链空肠弯曲杆菌的耐药性研究[J]. 中国人兽共患病学报,2013,29(2):199-204. |
 2015, Vol. 30
2015, Vol. 30


