扩展功能
文章信息
- 孙卫敏, 郝新春, 舒天翅
- SUN Wei-min, HAO Xin-chun, SHU Tian-chi
- 2005-2013年湖北省黄冈市疑似预防接种异常反应监测数据分析
- Surveillance for adverse events following immunization in Huanggang,2005-2013
- 疾病监测, 2015, 30(10): 869-874
- Disease Surveillance, 2015, 30(10): 869-874
- 10.3784/j.issn.1003-9961.2015.10.018
-
文章历史
- 收稿日期: 2015-02-05
疑似预防接种异常反应(adverse events following immunization,AEFI)是指在预防接种后发生的怀疑与预防接种有关的反应或事件[1]。2005年,湖北省作为全国10个试点省之一,按照卫生部及中国疾病预防控制中心(CDC)的统一要求,率先开展了AEFI监测工作[2]。黄冈市自2005年7月开始在全市开展AEFI监测,通过“中国免疫规划监测信息管理系统”平台实施网络报告,2008年启用全国AEFI信息管理系统,在2010 年卫生部和国家食品药品监督管理局制定的《全国AEFI监测方案》[1]的指导下,AEFI监测数据不断增长,AEFI监测得到进一步加强。现将黄冈市2005——2013年AEFI监测数据分析如下。
1 资料与方法 1.1 资料来源2005——2007年AEFI个案资料来源于“中国免疫规划监测信息管理系统”AEFI监测数据,2008——2013年AEF1个案资料来源于 “全国AEFI信息管理系统”,接种资料来源于“中国免疫规划监测信息管理系统”收集2005——2013年各种疫苗接种剂次数据。
1.2 AEFI监测范围本研究分析数据为截至2014年8月20日黄冈市报告的2005——2013年间接种国家免疫规划(national immunization program,NIP)疫苗和非NIP疫苗的所有人群中发生的AEFI个案数据。
1.3 AEFI调查诊断和分类根据《全国AEFI监测方案》,对AEFI进行调查和因果关联评价。AEFI按发生原因分类为不良反应(包括一般反应和异常反应)、疫苗质量事故、接种事故、偶合症和心因性反应。
1.4 资料整理与分析利用Excel和SPSS软件对数据进行整理,采用描述性分析方法,对AEFI分布特征和相关指标进行流行病学分析。
1.5 分析指标包括AEFI报告发生率及不同特征的AEFI构成比。某疫苗某种AEFI的报告发生率(/10万剂)=该疫苗报告AEFI数/该疫苗接种剂次数×10万剂。
2 结果 2.1 AEFI报告及分类情况黄冈市2005——2013年共收集到审核AEFI个案644例,全市10个县、市、区均有数据报告。所有AEFI中,一般反应467例,占72.52%;异常反应142例,占22.05%;偶合症25例,占3.88%;心因性反应4例,占0.62%;不明原因6例,占0.93%。
2005——2013年各年AEFI病例报告数分别为4、2、11、6、46、85、102、136和252例,病例报告数从2009年起增加明显,且呈逐年上升趋势。报告县覆盖率2005——2008年均在80%以下,2009年达到80%,从2010年起均达到100%,见图1。
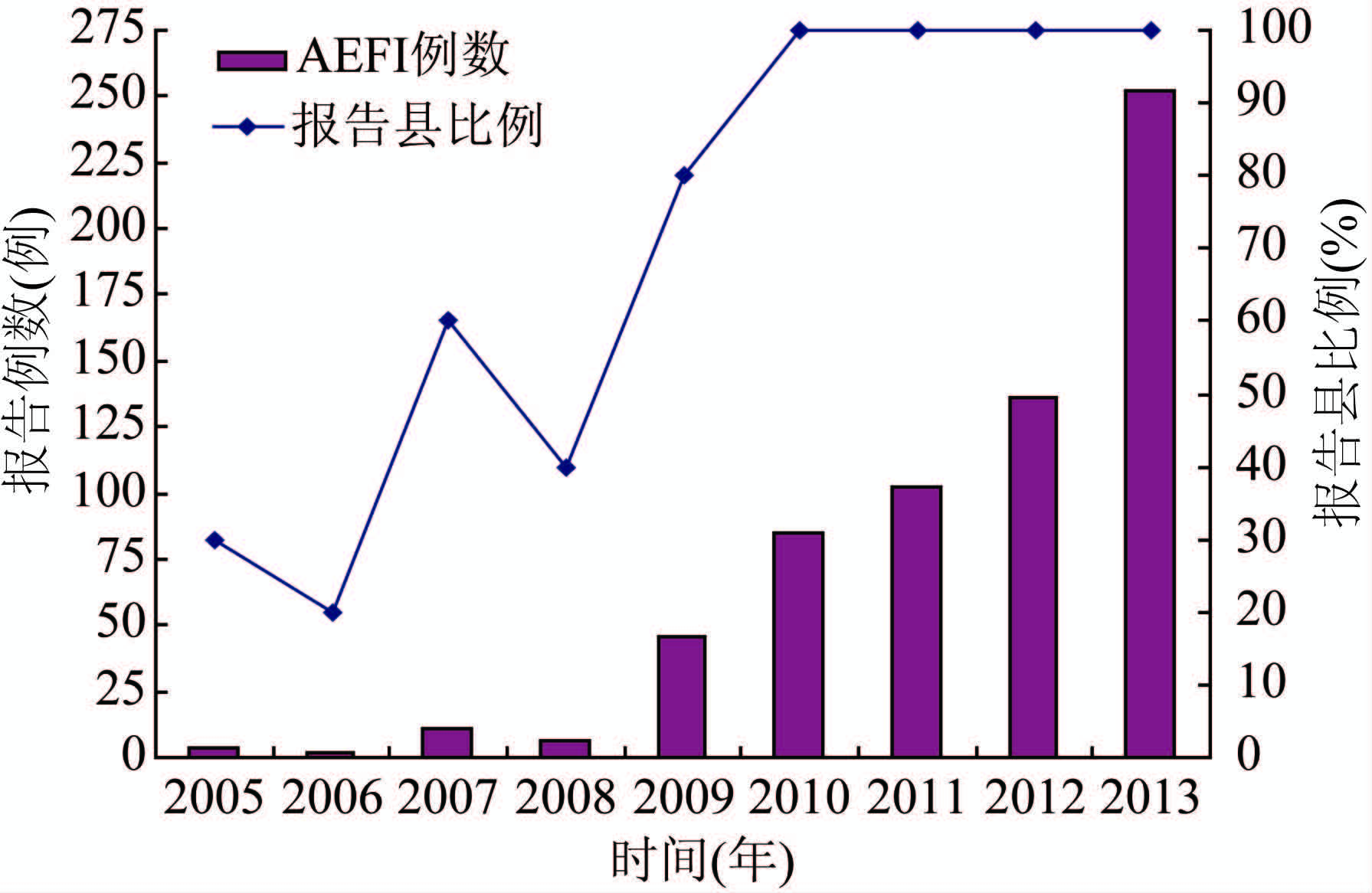
|
| 图 1 2005——2013年黄冈市AEFI报告例数和报告县比例 Figure 1 Number of reported AEFI cases and proportion of counties reporting AEFI in Huanggang,2005-2013 |
根据2005——2013年中国免疫规划信息管理系统中接种监测数据估算,共实施预防接种12 239 942剂次,所有疫苗AEFI总报告发生率为5.26/10万剂。预防接种一般反应估算发生率为3.82/10万剂,预防接种异常反应为1.16/10万剂。报告AEFI发生率呈逐年增加趋势。
2.2 AEFI的流行病学特征分析 2.2.1 地区分布全市10个县、市、区均有数据报告,其中武穴市104例,占16.15%;浠水县101例,占15.68%;麻城市95例,占14.75%;黄州区74例,占11.49%;罗田县65例,占10.09%;红安县54例,占8.39%;蕲春县52例,占8.07%;黄梅县48例,占7.45%,英山县34例,占5.28%,团风县17例,占2.64%。
2.2.2 人群分布在644例AEFI中,≤1岁430例,占66.77%;2~7岁174例,占27.02%;≥8岁40例,占6.21%;男女性别比为1.62∶1。
| 年份 | 一般反应 | 异常反应 | 疫苗质量事故 | 接种事故 | 偶合症 | 心因性反应 | 不明原因 | AEFI总例数 | AEFI发生率(/10万) |
| 2005 | 0 | 1 | 0 | 0 | 2 | 1 | 0 | 4 | 0.70 |
| 2006 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 2 | 0.32 |
| 2007 | 2 | 6 | 0 | 0 | 0 | 0 | 3 | 11 | 1.36 |
| 2008 | 5 | 1 | 0 | 0 | 0 | 0 | 0 | 6 | 0.63 |
| 2009 | 25 | 17 | 0 | 0 | 1 | 0 | 3 | 46 | 3.17 |
| 2010 | 59 | 20 | 0 | 0 | 6 | 0 | 0 | 85 | 4.31 |
| 2011 | 78 | 15 | 0 | 0 | 9 | 0 | 0 | 102 | 5.30 |
| 2012 | 97 | 32 | 0 | 0 | 5 | 2 | 0 | 136 | 6.29 |
| 2013 | 201 | 49 | 0 | 0 | 2 | 0 | 0 | 252 | 14.33 |
| 合计 | 467 | 142 | 0 | 0 | 25 | 4 | 6 | 644 | 5.26 |
112月均有报告,分别为10例(占1.55%)、12例(占1.86%)、32例(占4.97%)、50例(占7.76%)、73例(占11.34%)、95例(占14.75%)、78例(占12.11%)、60例(占9.32%)、94例(占14.60%)、56例(占8.70%)、49例(占7.61%)、35例(占5.43%)。2.3 AEFI报告和调查及时性、完整性分析 黄冈市2005——2013年报告644例AEFI中,48 h内报告率为88.04%; 48 h内调查率为95.13%;AEFI个案调查表完整率为91.32%(221/242)。2008年启用AEFI信息管理系统进行专报管理后,及时报告率、及时调查率、个案调查表完整率等指标均较之前几年有显著提高,特别是在2010年卫生部和国家食品药品监督管理局制定的《全国AEFI监测方案》实施之后,各项指标均维持在较高的水平,近两年的指标都达到了国家监测方案的标准,见表2。
| 年份 | 报告AEFI例数 | 48 h内报告数 | 48 h内报告率(%) | 需调查数 | 调查数 | 48 h内调查数 | 48 h内调查率(%) | 报告调查表例数 | 个案调查表完整数 | 个案调查表完整率(%) |
| 2005 | 4 | 0 | 0.00 | 4 | 4 | 4 | 100.00 | 4 | 0 | 0.00 |
| 2006 | 2 | 0 | 0.00 | 2 | 2 | 1 | 50.00 | 2 | 0 | 0.00 |
| 2007 | 11 | 7 | 63.64 | 11 | 10 | 7 | 70.00 | 11 | 0 | 0.00 |
| 2008 | 6 | 4 | 66.67 | 5 | 5 | 5 | 100.00 | 5 | 2 | 40.00 |
| 2009 | 46 | 36 | 78.26 | 44 | 44 | 39 | 88.64 | 44 | 44 | 100.00 |
| 2010 | 85 | 71 | 83.53 | 43 | 43 | 42 | 97.67 | 55 | 55 | 100.00 |
| 2011 | 102 | 76 | 74.51 | 28 | 28 | 28 | 100.00 | 29 | 28 | 96.55 |
| 2012 | 136 | 126 | 92.65 | 39 | 39 | 38 | 97.44 | 41 | 41 | 100.00 |
| 2013 | 252 | 247 | 98.02 | 51 | 51 | 51 | 100.00 | 51 | 51 | 100.00 |
| 合计 | 644 | 567 | 88.04 | 227 | 226 | 215 | 95.13 | 242 | 221 | 91.32 |
报告有明确疫苗接种的641例AEFI中,报告数居前三位的可疑疫苗分别为无细胞百日咳-白喉-破伤风(百白破)疫苗(129例,占20.12%)、麻疹减毒活疫苗(麻疹疫苗)(81例,占12.64%)、麻疹-风疹减毒活疫苗(麻风疫苗)(59例,占9.20%)。共报告一般反应465例,其中报告数居前3位的可疑疫苗分别为无细胞百白破疫苗(109例,占23.44%)、麻疹疫苗(51例,占10.97%)、流行性乙型脑炎(乙脑)减毒活疫苗(报告47例,占一般反应总例数的10.11%);报告异常反应142例,其中报告数居前3位的可疑疫苗分别为麻疹疫苗(24例,占16.90%)、麻风疫苗(23例,占16.20%)、无细胞百白破疫苗(18例,占12.68%),见表3。
| 疫苗名称 | AEFI | 一般反应 | 异常反应 | |||
| 例数 | 构成比(%) | 例数 | 构成比(%) | 例数 | 构成比(%) | |
| 卡介苗 | 21 | 3.28 | 5 | 1.08 | 9 | 6.34 |
| 重组乙型肝炎疫苗(CHO细胞) | 24 | 3.74 | 18 | 3.87 | 4 | 2.82 |
| 脊髓灰质炎减毒活疫苗 | 17 | 2.65 | 14 | 3.01 | 1 | 0.70 |
| 吸附百白破联合疫苗 | 12 | 1.87 | 8 | 1.72 | 2 | 1.41 |
| 吸附无细胞百白破联合疫苗 | 129 | 20.12 | 109 | 23.44 | 18 | 12.68 |
| 吸附白喉破伤风联合疫苗 | 9 | 1.40 | 7 | 1.51 | 2 | 1.41 |
| 麻疹减毒活疫苗 | 181 | 12.64 | 51 | 10.97 | 24 | 16.90 |
| 麻疹腮腺炎风疹联合减毒活疫苗 | 17 | 2.65 | 13 | 2.80 | 3 | 2.11 |
| 麻疹腮腺炎联合减毒活疫苗 | 3 | 0.47 | 1 | 0.22 | 1 | 0.70 |
| 麻疹风疹联合减毒活疫苗 | 59 | 9.20 | 36 | 7.74 | 23 | 16.20 |
| A群脑膜炎球菌多糖疫苗 | 35 | 5.46 | 28 | 6.02 | 7 | 4.93 |
| A+C群脑膜炎球菌多糖疫苗 | 5 | 0.78 | 4 | 0.86 | 1 | 0.70 |
| A+C群脑膜炎球菌多糖结合疫苗 | 5 | 0.78 | 5 | 1.08 | - | 0.00 |
| ACYW135群脑膜炎球菌多糖疫苗 | 6 | 0.94 | 2 | 0.43 | 3 | 2.11 |
| 乙型脑炎减毒活疫苗 | 58 | 9.05 | 47 | 10.11 | 10 | 7.04 |
| 乙型脑炎灭活疫苗 | 8 | 1.25 | 8 | 1.72 | - | 0.00 |
| 甲型肝炎减毒活疫苗 | 10 | 1.56 | 7 | 1.51 | 3 | 2.11 |
| 甲型肝炎灭活疫苗 | 2 | 0.31 | 2 | 0.43 | - | 0.00 |
| 甲肝乙肝联合疫苗 | 5 | 0.78 | 2 | 0.43 | 3 | 2.11 |
| 流行性感冒裂解疫苗 | 15 | 2.34 | 10 | 2.15 | 4 | 2.82 |
| 裂解无佐剂甲型H1N1流感疫苗 | 9 | 1.40 | 6 | 1.29 | 2 | 1.41 |
| 冻干水痘减毒活疫苗 | 35 | 5.46 | 19 | 4.09 | 14 | 9.86 |
| b型流感嗜血杆菌多糖结合疫苗 | 27 | 4.21 | 24 | 5.16 | 3 | 2.11 |
| 口服轮状病毒活疫苗 | 6 | 0.94 | 3 | 0.65 | 1 | 0.70 |
| 23价肺炎球菌多糖疫苗 | 17 | 2.65 | 13 | 2.80 | 2 | 1.41 |
| 人用狂犬病疫苗 | 26 | 4.06 | 23 | 4.95 | 2 | 1.41 |
| 合计 | 641 | 100.00 | 465 | 100.00 | 142 | 100.00 |
| 注:AEFI如存在≥2种疫苗同时接种的情况,以其中最可疑的一种疫苗统计。 | ||||||
在644例AEFI中,主要临床诊断分布为发热/红肿/硬结367例,占56.99%,发生率为3.00/10万;过敏性皮疹108例,占16.77%,发生率为0.88/10万;血管性水肿9例,占1.40%,发生率为0.07/10万;荨麻疹8例,占1.24%,发生率为0.07/10万;卡介苗淋巴结炎6例,占0.93%,发生率1.02/10万,见表4。2.6 AEFI发生时间间隔分布 在644例预防接种不良反应中,发生在接种后1天内536例,占83.23%;接种后2~3天53例,占8.23%;接种后4~7天19例,占2.95%;接种后8~14天9例,占1.40%;接种后>15天27例,占4.19%。
| 临床诊断 | 反应数 | 发生率(/10万) | 构成比(%) |
| 发热/红肿/硬结 | 367 | 3.00 | 56.99 |
| 过敏性皮疹 | 108 | 0.88 | 16.77 |
| 血管性水肿 | 9 | 0.07 | 1.40 |
| 荨麻疹 | 8 | 0.07 | 1.24 |
| 卡介苗淋巴结炎(1) | 6 | 1.02 | 0.93 |
| 无菌性脓肿 | 5 | 0.05 | 0.78 |
| 麻疹猩红热样皮疹 | 4 | 0.03 | 0.62 |
| 热性惊厥 | 3 | 0.02 | 0.47 |
| 过敏性紫癜 | 3 | 0.02 | 0.47 |
| 斑丘疹 | 3 | 0.02 | 0.47 |
| 过敏性休克 | 2 | 0.02 | 0.31 |
| 癔症 | 2 | 0.02 | 0.31 |
| 急性播散性脑脊髓炎 | 2 | 0.02 | 0.31 |
| 局部过敏坏死反应(Arthus反应) | 1 | 0.01 | 0.16 |
| 癫痫 | 1 | 0.01 | 0.16 |
| 脑病 | 1 | 0.01 | 0.16 |
| 局部脓肿 | 1 | 0.01 | 0.16 |
| 其他 | 118 | 0.96 | 18.32 |
| 合计 | 644 | 5.26 | 100.00 |
| 注:(1)估算发生率时,卡介苗淋巴结炎的分母为卡介苗接种剂次。 | |||
所有644例AEFI中,625例治愈或好转,占97.05%;2例留有后遗症,占0.31%;4例死亡,占0.62%;13例转归不详,占2.02%。4例死亡病例中,偶合症3例,占75.00%,不明原因1例,占25.00%。
3 讨 论2005——2013年AEFI监测数量不断增多,自2008年在全国范围内启用AEFI信息管理系统开展AEFI监测以来,病例报告数从2009年起增加明显,且呈逐年上升趋势。尤其是2010年卫生部和国家食品药品监督管理局制定的《全国AEFI监测方案》实施之后,AEFI监测数量和质量均不断提高,各项指标均维持在较高的水平,近两年的指标都达到了国家监测方案的标准。48 h内及时报告率、48 h内及时调查率、个案调查表完整率等指标均较之前几年有显著提高;报告县覆盖率2005——2008年均在80%以下,2009年达到80%,从2010年起均达到100%,所有报告AEFI病例均进行了反应分类。
全市10个县、市、区均有数据报告,病例报告数最多的为武穴市104例,占总病例数的16.15%,最少的为团风县17例,占2.64%,病例数报告多少除与人口基数和接种剂次有关之外,还与各地对AEFI的报告意识和对监测工作的重视程度有关。
黄冈市AEFI主要集中在≤7岁儿童,其中≤1岁430例,占66.77%,与1岁内接种剂次较多有关系;男性多于女性。112月均有报告,主要集中分布在59月,按季节分布,除第一季度外,后三个季度分布较均匀。全市AEFI的性别、年龄和季节分布与全国2005——2012年的AEFI监测数据分析一致[3, 4, 5, 6, 7, 8]。
在所有AEFI中,不良反应占94.57%,一般反应占AEFI总数的72.52%,预防接种异常反应占AEFI总数的22.05%。发生时间间隔83.23%发生在1天内,但仍有4.19%病例发生在接种后>15天,提示在关注接种短时间内出现的临床损害的同时,也有必要观察可能引起的长期损害。
共实施预防接种12 239 942剂次,所有疫苗AEFI总报告发生率为5.26/10万剂,高于湖北省2005年和2010年报告的0.34/10万和3.31/10万水平[2, 9],但低于周边地市咸宁市2008-2012年AEFI平均报告发生率11.19/10 万[10]。预防接种一般反应估算发生率为3.82/10万剂,预防接种异常反应为1.16/10万剂。报告AEFI发生率呈逐年增加趋势。2008年9月全市全面实施扩大国家免疫规划,2009年接种剂次显著增加,而AEFI的报告病例数和估算发生率也逐年上升,2013年较2012年报告AEFI例数增加了85.29%,2013年的AEFI估算发生率达到了14.33/10万剂次,反映全市AEFI监测敏感性不断增加。
2005——2013年所有有明确疫苗接种的AEFI中,涉及可疑疫苗的报告数居前3位的分别为无细胞百白破疫苗(占总例数的20.12%)、麻疹疫苗(占总例数的12.64%)、麻风疫苗(占总例数的9.20%)。与湖北省2010年AEFI监测数据分析结果排位顺序略有不同,2010年报告病例数位于前3位的疫苗为麻疹疫苗(31.69%)、无细胞百白破疫苗(13.28%)、百白破疫苗(7.85%)[9]; 但与沈阳市2010——2013年AEFI监测分析结果类似,沈阳市所占比例前3位的分别是无细胞百白破疫苗(26.80%)、麻风疫苗(15.30%)、麻疹疫苗(14.80%)[11];河北省2010——2012年AEFI监测分析亦显示发生AEFI前几位的疫苗分别为百白破疫苗(54.38%)、麻疹疫苗(8.74%),流脑A群(4.87%)、麻风疫苗(4.82%)[12];山西省朔州市2008——2013年AEFI监测分析数据显示,该地AEFI报告发生数位于前5位的疫苗分别为无细胞百白破疫苗、乙脑减毒疫苗、麻风疫苗、麻疹疫苗、A群流脑疫苗,其中无细胞百白破疫苗AEFI发生数占总例数的59.87%[13]。说明黄冈市AEFI报告涉及的可疑疫苗前3位的安全性仍在预期范围内。无细胞百白破疫苗是报告例数最多的疫苗,与国家AEFI监测数据分析一致,这与百白破疫苗的自身特性有关,百白破疫苗是混合制剂,是由百日咳疫苗、白喉和破伤风类毒素按适当比例混合再加人氢氧化铝吸附剂配制而成。百日咳疫苗由于其生物学性状复杂,含有不耐热毒素(HLT),它与疫苗接种后的局部发红、坏死有关,红肿硬结和无菌性化脓的形成可能主要与百日咳疫苗的HLT有关。百日咳疫苗是吸附制剂,吸附菌体后形成的较大的颗粒延缓了吸收速度,大颗粒吸附物质经白细胞吞噬后在局部堆积,致使局部坏死、液化也有可能造成红肿硬结或无菌性化脓[14];同时与接种技术有关,如使用前未将疫苗充分摇匀或注射部位过浅等因素有关[15];另外与该疫苗接种剂次和接种人群也相关[8]。卡介苗最常见的预防接种异常反应为卡介苗淋巴结炎,其发生与疫苗毒株毒力、菌液均匀度和浓度、接种方法、接种技术及儿童年龄等相关[16]。因此仍需加强对预防接种人员的技术培训,尽量避免卡介苗淋巴结炎的发生。麻疹疫苗和麻风疫苗的报告数较多,可能与近几年频繁开展麻疹类疫苗强化免疫有关。
AEFI临床诊断分布中发生最多的是发热/红肿/硬结,占总病例数的56.99%,其次是过敏性皮疹(16.77%);估算发生率居前3位的分别为发热/红肿/硬结(发生率为3.00/10万)、卡介苗淋巴结炎(发生率1.02/10万)、过敏性皮疹(发生率为0.88/10万)。
所有AEFI中,一般反应占AEFI总数的72.52%,2005——2013年以来无疫苗质量事故和接种事故报告,说明预防接种服务质量较好。所有病例中97.05%的病例治愈或好转(其中583例治愈,42例好转),说明监测到的AEFI病例多数病情较轻,绝大多数都能恢复。
黄冈市AEFI监测数据分析显示,全市AEFI发生集中在小年龄组,男性略多于女性,夏季多发;多数不良反应发生在接种后≤1 d;常见的一般反应为发热、局部红肿和硬结等;常见的预防接种异常反应为过敏性皮疹、卡介苗淋巴结炎等,这与近几年国家的AEFI监测数据分析结果一致[8]。
近年来全市AEFI监测敏感性和各级报告完整性有较大提高,目前县级报告覆盖率达100%,但乡级报告覆盖率仍有待进一步提高。需进一步提高AEFI监测敏感性和数据报告质量,加强AEFI监测人员和因果关联评估专家的能力建设,以便提高全国AEFI监测质量和调查诊断水平,为评估疫苗安全性提供依据。
| [1] | Ministry of Health, State Food and Drug Administration of the People's Republic of China. National guideline for the surveillance of adverse events following immunization[S]. 2010-06-03.(in Chinese) 卫生部, 国家食品药品监督管理局. 全国疑似预防接种异常反应监测方案[S]. 2010-06-03. |
| [2] | Li SH, Zheng JS, Zhang FX, et al. Report on the surveillance of adverse events following immunizationin Hubei province(2005)[J]. Journal of Public Health and Preventive Medicine,2006,17(5):67-69.(in Chinese) 李书华,郑景山,张发香,等.湖北省2005年预防接种副反应监测报告[J]. 公共卫生与预防医学,2006,17(5):67-69. |
| [3] | Liu DW, Guo B, Cao LS, et al. Study on the surveillance of adverse events following immunization in China,2005-2006[J]. Chinese Journal of Vaccines and Immunization,2007,13(6):505-513.(in Chinese) 刘大卫,郭飚,曹玲生,等. 全国2005-2006年疑似预防接种异常反应监测分析[J]. 中国计划免疫,2007,13(6):505-513. |
| [4] | Wu WD, Liu DW, Wu BB, et al. Analysis on the surveillance of adverse events following immunization in China,2007-2008[J]. Chinese Journal of Vaccines and Immunization,2009,15(6):481-490.(in Chinese) 武文娣,刘大卫,吴冰冰,等.全国2007-2008年疑似预防接种异常反应监测分析[J]. 中国疫苗和免疫,2009,15(6):481-490. |
| [5] | Wu WD,Liu DW, Li KL, et al. Analysis on adverse events following immunization surveillance in China,2009[J]. Chinese Journal of Vaccines and Immunization,2011,17(2):99-108.(in Chinese) 武文娣,刘大卫,李克莉,等.全国2009年疑似预防接种异常反应监测分析[J]. 中国疫苗和免疫,2011,17(2):99-108. |
| [6] | Wu WD, Liu DW, Li KL, et al. Analysis on adverse events following immunization surveillance in China,2010[J]. Chinese Journal of Vaccines and Immunization,2012,18(5):385-397.(in Chinese) 武文娣,刘大卫,李克莉,等.中国2010年疑似预防接种异常反应监测数据分析[J]. 中国疫苗和免疫,2012,18(5):385-397. |
| [7] | Wu WD, Li KL, Zheng JS, et al. Analysis on surveillance data of adverse events following immunization in China,2011[J]. Chinese Journal of Vaccines and Immunization,2013,19(2):97-109.(in Chinese) 武文娣,李克莉,郑景山,等.中国2011年疑似预防接种异常反应监测数据分析[J]. 中国疫苗和免疫,2013,19(2):97-109. |
| [8] | Wu WD, Liu DW, Li KL, et al. Analysis on surveillance data of adverse events following immunization in China,2012[J]. Chinese Journal of Vaccines and Immunization,2014,20(1):1-12, 66.(in Chinese) 武文娣,刘大卫,李克莉,等. 中国2012年疑似预防接种异常反应监测数据分析[J]. 中国疫苗和免疫,2014,20(1):1-12, 66. |
| [9] | Li SH, Zhao MJ, Wang Z, et al. Study on the surveillance of adverse events following immunizationin Hubei province(2010)[J]. Journal of Public Health and Preventive Medicine,2011,22(6):9-14,18.(in Chinese) 李书华,赵明江,王兆,等. 湖北省2010年疑似预防接种异常反应监测分析[J]. 公共卫生与预防医学,2011,22(6):9-14,18. |
| [10] | Zhang L, Zhou HJ. Analysis on the surveillance of adverse events following immunization in Xianning,2008-2012[J]. Journal of Public Health and Preventive Medicine,2014,25(1):112-114.(in Chinese) 张丽,周红俊.咸宁市2008-2012年疑似预防接种异常反应监测[J]. 公共卫生与预防医学,2014,25(1):112-114. |
| [11] | Gao DM, Jia NN, Liu BY. Analysis on the surveillance of suspect adverse events following immunization in Shenyang from 2010 to 2013[J]. Chinese Primary Health Care,2014,28(12):74-75.(in Chinese) 高冬梅,贾妮娜,刘宝义.沈阳市2010-2013年疑似预防接种异常反应监测分析[J]. 中国初级卫生保健,2014,28(12):74-75. |
| [12] | Sun L, Zhang FB, Zhang ZG, et al. Analysis on the surveillance of adverse events following immunization Hebei province,2010-2012[J]. Hebei Medical Journal,2014,36(23):3646-3648.(in Chinese) 孙丽,张富斌,张振国,等.2010至2012年河北省疑似预防接种异常反应监测分析[J]. 河北医药,2014,36(23):3646-3648. |
| [13] | Yin XF, Liu JH, Zhang JL. Analysis of monitoring adverse events following immunization(AEFI) from 2008 to 2013 in Shuozhou city[J]. Journal of Shanxi Medical College for Continuing Education,2014,24(6):62-64.(in Chinese) 殷秀芳,刘锦花,张建林.朔州市2008-2013年疑似预防接种异常反应监测分析[J]. 山西职工医学院学报,2014,24(6):62-64. |
| [14] | Xu F. Study on the safety of DTaP vaccine immunization[J]. Zhejiang Preventive Medicine,2010,22(8):42,47.(in Chinese) 徐峰.无细胞百白破疫苗免疫接种安全性观察[J]. 浙江预防医学,2010,22(8):42,47. |
| [15] | Ze WY. Immunology program[M]. 2nd ed. Shanghai:Shanghai Science and Technology Literature Press,2001.(in Chinese) 迮文远.计划免疫学[M]. 2版. 上海:上海科学技术文献出版社,2001. |
| [16] | Xie GZ, Diao LD, Wang SQ, et al. Response to the reactions after vaccination[M]. 3rd ed. Shanghai:Shanghai Science and Technology Press,2009.(in Chinese) 谢广中,刁连东,王树巧,等. 预防接种的反应和处理[M]. 3版. 上海:上海科学技术出版社,2009. |
 2015, Vol. 30
2015, Vol. 30


