扩展功能
文章信息
- 王怡倩, 叶长芸
- WANG Yi-qian, YE Chang-yun
- 建立检测产气肠杆菌的TaqMan荧光定量PCR和普通PCR方法
- Establishing conventional PCR and TaqMan real time PCR assays for detection of Enterobacter aerogenes
- 疾病监测, 2016, 31(2): 153-158
- Disease Surveillance, 2016, 31(2): 153-158
- 10.3784/j.issn.1003-9961.2016.02.016
-
文章历史
- 收稿日期: 2015-11-27
产气肠杆菌(Enterobacter aerogenes)属于肠杆菌科肠杆菌属,菌体长1.2~3.0 μm、宽0.6~1.0 μm,为革兰阴性兼性厌氧杆菌。作为肠道正常定植菌,也是条件致病菌,在人体免疫力低下或者侵入肠道外部位等特殊情况时,可以引发疾病。产气肠杆菌的临床检出率仅次于阴沟肠杆菌,可引起呼吸道、泌尿道和伤口感染等,也是老年人感染或院内获得性肺炎的常见致病菌[1, 2, 3]。产气肠杆菌可以产生β-内酰胺酶,多年来由于抗生素的滥用,该类细菌引起医院感染的概率不断上升,已成为院内感染常见的条件致病菌[4, 5]。
1961年,Havelka[6]首次使用Mller 脱羧反应肉汤来检测组氨酸脱羧酶 (histidine decarboxylase,HDC)。后来Enjalbert等[7]根据组氨酸脱羧酶的存在与否可以将产气肠杆菌与肺炎链球菌及其他肠杆菌属的细菌区分开,并证实在现有肠杆菌属细菌中,只有产气肠杆菌携带hdc基因。所以,产气肠杆菌组氨酸脱羧酶的发现为该菌的快速检测和鉴定提供了有力依据。
本研究根据NCBI数据库中公布的产气肠杆菌和相关细菌种属的hdc基因序列设计特异引物和探针,建立普通聚合酶链反应(PCR)方法和TaqMan 荧光定量PCR方法用于产气肠杆菌的快速检测,并对其进行评价。
1 材料与方法 1.1 材料 1.1.1 菌株来源本实验所用参考菌株均购自中国药品生物制品鉴定所,分离株来自临床标本,并经生化鉴定和16S rDNA测序鉴定。用于特异性评价的菌株包括产气肠杆菌参考株ATCC13048、35株临床分离株,另外选取了可引起相似感染症状(腹泻、败血症、肺炎、炎症反应)的30个其他种属致病菌菌株。
1.1.2 主要试剂与仪器Premix Ex-TaqTM、EASY-dilution、pMD18-T载体、DH5α感受态细胞购自大连宝生物工程有限公司,API-20E细菌生化鉴定试剂条购自法国生物梅里埃公司。粪便标本核酸提取试剂盒(QIAamp DNA MiniKit,51306),质粒提取试剂盒(QIAGEN Plasmid Midi K,12143)和胶回收试剂盒(Qiaquick Gel Extraction Kit,28704)购自德国QIAGEN公司。ABI 7900 HT PCR仪(美国应用生物系统公司),Roter-gene 3000荧光定量PCR仪(澳大利亚Corbett Research公司),NanoDrop ND-1000分光光度计(美国Thermo公司)。
1.1.3 引物和探针的合成根据NCBI公布的核酸序列,应用Primer Express 3.0软件对产气肠杆菌hdc基因的全长和特异片段设计引物和探针(表 1),并由上海基康生物公司进行合成,全长为 633 bp,特异片段大小为105 bp。
| 引物名称 | 5′~3′ | GC% | 退火温度(℃) |
| EAhdc-LF | CGA CTT TGA AAA AGA AGT CAT GGA | 37.50 | 61.8 |
| EAhdc-LR | GAA AGG CAA GAT CAT GCC GCT | 52.40 | 65.9 |
| EAhdc-F | GAT CAA TAA AAT CAG GAC CTC AGG C | 44.00 | 63.3 |
| EAhdc-R | CGT TTC TGT ATC TCA GCG ATA TTA TCA A | 35.70 | 62.8 |
| EAhdc-P | FAM-ACG CCA TCC CAT CAT TTT CGC CA-BHQ | 52.20 | 73.3 |
以产气肠杆菌参考株ATCC13048基因组DNA为模板,EAhdc-LF和EAhdc-LR为引物,扩增组氨酸脱羧酶基因片段。反应体系为:TaKaRa Ex Taq 0.1 μl、10×Ex Taq buffer 2.0 μl、2.5 μmol/L dNTP 2 μl、10 μmol/L的引物(EAhdc-LF和EAhdc-LR)各1 μl、DNA模板1 μl,补充RNase-free Water至总体积为20 μl。扩增条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s 72 ℃延伸1.5 min,共40个循环。PCR产物大小为441 bp,经切胶回收后,将PCR产物连接到pMD18-T载体上并转化DH5α感受态细胞,通过抗性平板筛选阳性克隆,测序鉴定插入片段正确后,提取重组质粒备用。
1.2.2 标准曲线的建立测定含有组氨酸脱羧酶基因片段的重组质粒DNA浓度,根据分子质量将质粒DNA浓度换算为拷贝数浓度,算法如下:基因的拷贝数=浓度(ng/μl)×阿佛加德罗常数×10-9/(660×重组质粒碱基数)。用Easy Dilution将重组质粒进行10倍连续稀释至10,1.0×102 ~1.0×108 copies/μl。为了检出该体系的检测下限,笔者增加了66,33 copies/μl浓度进行检测。
1.2.3 粪便模拟标本的制备及基因组DNA的提取将产气肠杆菌标准株ATCC13048在脑心液体培养基中培养至A值为0.5,用磷酸盐缓冲液连续10×倍比稀释,配制2.0×103~2.0×108 cfu/ml的产气肠杆菌稀释液并涂板计数。取健康人新鲜粪便(传统方法方法检测产气肠杆菌为阴性)0.2 g/管,分别加入100 μl不同浓度的产气肠杆菌稀释液,制成含菌量为1.0×103~1.0×108cfu/g的粪便模拟标本。应用QIAamp DNA粪便小量纯化试剂盒抽提粪便标本基因组DNA并重悬于100 μl TE中。每个粪便模拟标本浓度梯度重复3次。
1.3 普通PCR方法反应体系为:TaKaRa ExTaq 0.1 μl、10×ExTaq buffer 2.0 μl、2.5 μmol/L dNTP 2.0 μl、10 μmol/L的引物(EAhdc-F和EAhdc-R)各1 μl、DNA模板1 μl,补充RNase-free Water至总体积为20 μl。扩增条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1.5 min,共40个循环。
1.4 TaqMan荧光PCR方法反应总体系为20 μl:2×Premix TaKaRa ExTaqTM 10 μl、10 μmol/L的引物EAhdc-F、EAhdc-R和探针EAhdc-P各 0.4 μl、DNA模板1 μl,补充RNase-free Water至总体积为20 μl。在Roter-gene 3000上反应并分析结果,反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火并延伸20 s,共40个循环。反应结束后,扣除本底荧光信号后取阈值(0.05)进行数据分析,确定各样本的Ct(cycle threshold)值。
1.5 普通PCR和实时TaqMan荧光PCR特异性、灵敏度和重复性分析 1.5.1 特异性将产气肠杆菌参考菌株ATCC13048、35株临床分离菌株和30株常见非产气肠杆菌致病菌株的基因组DNA作为模板,用本方法构建的普通PCR方法和实时TaqMan PCR方法进行检测,评价引物和探针的特异性。
1.5.2 灵敏性将构建好的浓度为10,33,66,1.0×102 ~1.0×108copies/μl的质粒标准品和含产气肠杆菌菌量为1.0×103~1.0×108cfu/g的粪便模拟标本提取的基因组DNA作为模板,用本试验构建的普通PCR方法和TaqMan荧光PCR方法进行检测,通过检测出的最少质粒拷贝数和粪便模拟标本含菌量,评价这两种方法的灵敏性。
1.5.3 重复性分别取1 μl上述稀释后的质粒标准品(1.0×102~1.0×108copies/μl)作为模板进行普通PCR方法和TaqMan荧光定量PCR方法反应。同一试验中,每个稀释度进行3个重复,分析组内差异;在不同时间进行3次独立重复试验,分析组间差异。普通PCR方法通过电泳结果分析,TaqMan荧光定量PCR方法通过计算Ct值变异系数CV分析稳定性。
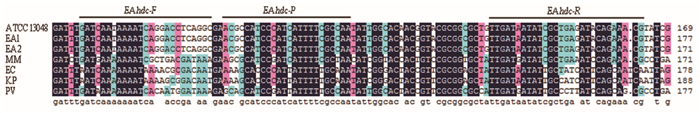
2 结果 2.1 临床分离株组氨酸脱羧酶核苷酸序列分析用EAhdc-LF和EAhdc-LR引物对产气肠杆菌参考菌株ATCC13048和35株临床分离株的组氨酸脱羧酶基因进行扩增并测序。序列比对显示产气肠杆菌的组氨酸脱羧酶基因序列具有很高的保守性。根据NCBI公布的数据,笔者将产气肠杆菌的组氨酸脱羧酶基因序列进行了搜索和比对,结果显示相似性均低于75%。和相关种属菌种序列比对结果显示,产气肠杆菌具有一段特异片段,可以设计特异探针(EAhdc-P)和引物(EAhdc-F,EAhdc-R),见图 1。
|
| 注:产气肠杆菌(ATCC13048-GenBank no. FJ469567, EA1-GenBank no. ENTHDCA, EA2-GenBank no. CP002824),大肠埃希菌(EC, GenBank No. AB083207), 肺炎克雷伯菌 (KP, GenBank No. KPNHDCA), 摩氏摩根菌(MM, GenBank No. AB259290), 普通变形杆菌(PV, GenBank No. AB083204) 图 1 产气肠杆菌和相关种属的组氨酸脱羧酶基因特异片段序列比对 Figure 1 Multi-alignments of hdc gene sequence of E. aerogenes and related species |
通过普通PCR和TaqMan荧光定量PCR方法对产气肠杆菌标准菌株ATCC13048、35株临床分离产气肠杆菌和30株非产气肠杆菌致病菌株进行检测。结果显示参考菌株ATCC13048和35株产气肠杆菌临床分离菌株的核酸检测均为阳性;30株非产气肠杆菌致病菌株核酸检测均为阴性,见表 2。提示本研究建立的普通PCR方法和TaqMan荧光定量PCR方法具有很好的特异性,能够对产气肠杆菌进行特异检测。
| 菌株名称 | 拉丁名 | 来源 | 菌株数 | PCR | TaqMan PCR |
| 产气肠杆菌 | Enterobacter aerogenens | ATCC13048 | 1 | + | + |
| 产气肠杆菌 | Enterobacter aerogenens | 分离株 | 35 | + | + |
| 粘质沙雷 | Serratia marcescens | 分离株 | 1 | - | - |
| 液化沙雷 | Serratia liquefaciens | 分离株 | 1 | - | - |
| 阴沟肠杆菌 | Enterobacter cloacae | ATCC13047 | 1 | - | - |
| 肠出血性大肠埃希菌 | Escherichia coli | EDL 933 | 1 | - | - |
| 伊氏李斯特菌 | Listeria ivanovii | ATCC19119 | 1 | - | - |
| 单增李斯特菌 | Listeria monocytogenes | ATCC54003 | 1 | - | - |
| 福氏志贺菌 | Shigella flexneri | CMCC 51572 | 1 | - | - |
| 宋内志贺菌 | Shigella sonnei | 分离株 | 1 | - | - |
| 痢疾志贺菌 | Shigella dysenteriae | CMCC 51329 | 1 | - | - |
| 鲍氏志贺菌 | Shigella boydii | CMCC 51105 | 1 | - | - |
| 猪链球菌 | Streptococcus suis | 分离株 | 1 | - | - |
| 弗劳氏枸橼酸杆菌 | Citrobacter Freundii | 分离株 | 1 | - | - |
| 屎肠球菌 | Enterococcus Faecium | ATCCBAA472 | 1 | - | - |
| 嗜水气单胞菌 | Aeromonas hydrophila | 分离株 | 1 | - | - |
| 豚鼠气单胞菌 | Aeromonas caviae | 分离株 | 1 | - | - |
| 类志贺邻单胞菌 | Plesimonas shigelloides | 分离株 | 1 | - | - |
| 小肠结肠炎耶尔森菌 | Yersinia enterocolitica | ATCC23715 | 1 | - | - |
| 艰难梭菌 | Clostridium difficile | 分离株 | 1 | - | - |
| 阪崎肠杆菌 | cronobacter sakazakii | 分离株 | 1 | - | - |
| 嗜肺军团菌 | legionella pneumophila | 分离株 | 1 | - | - |
| 副百日咳博德特菌 | Bordetalla parapertusis | 分离株 | 1 | - | - |
| 鲍曼不动杆菌 | Acinetobacter baumanii | 分离株 | 1 | - | - |
| 表皮葡萄球菌 | staphylococcus epidermidis | 分离株 | 1 | - | - |
| 金黄色葡萄球菌 | Staphylococcus aureus | ATCC6538 | 1 | - | - |
| 霍乱弧菌 | Vibrio cholerae | 分离株 | 1 | - | - |
| 拟态弧菌 | Vibrio mimicus | 分离株 | 1 | - | - |
| 奇异变形杆菌 | Bacillus mirabilis | 分离株 | 1 | - | - |
| 副溶血弧菌 | vibrio parahaemolyticus | ATCC17802 | 1 | - | - |
| 河弧菌 | Vibrio fluvialis | 分离株 | 1 | - | - |
| 创伤弧菌 | Vibrio vulnificus | 分离株 | 1 | - | - |
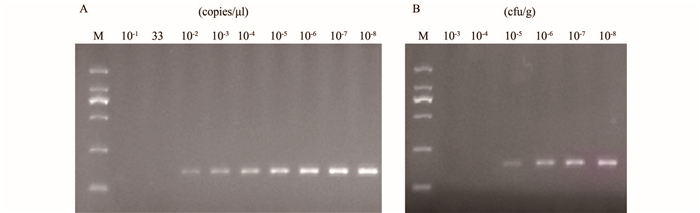
当质粒标准品浓度为1.0×102~1.0×108 copies/μl和粪便模拟标本含菌量为1.0×105~1.0×108 cfu/g时,普通PCR方法均能检测到明亮条带。而质粒标准品浓度为33 copies/μl和粪便模拟标本含菌量为1.0×104 cfu/g及以下浓度时,无肉眼可见的反应条带。依据每个反应体系加1 μl DNA模板计算可知,普通PCR方法检测的质粒标准品的最低浓度为100 copies/μl,见图 2A,检测的最低粪便模拟标本含菌量1.0×105 cfu/g,见图 2B。
|
| 图 2 PCR方法对质粒标准品和粪便模拟标本的扩增结果 Figure 2 Amplification of standard plasmid and simulated feces specimens for E. aerogenes with conventional PCR |
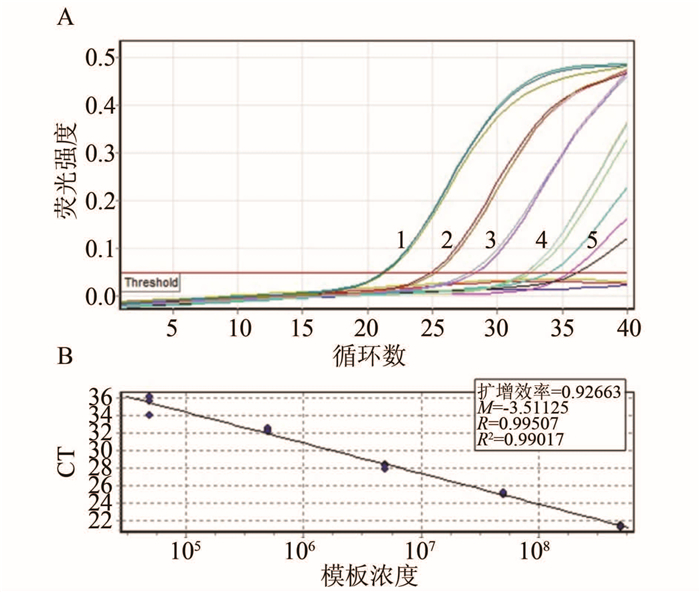
当质粒标准品浓度为33,1.0×102~1.0×108 copies/μl时,所有标本的扩增荧光信号强度均高于检测阈值0.05; 当质粒标准品浓度为10 copies/μl时,3个平行样本均未出现特异性扩增。依据每个反应体系加1 μl DNA模板计算可知,本研究建立的产气肠杆菌TaqMan荧光定量PCR方法对质粒标准品的检测下限为33 copies/μl(图 3A)。当质粒浓度为1.0×102~1.0×108 copies /μl时,质粒浓度对数值与相应Ct值之间呈良好的线性关系(图 3B)。

|
| 注:1~8:Plasmid DNA templates of 1.0×108~ 1.0×102 copies/μl; 9:33 copies/μl 图 3 TaqMan荧光定量PCR方法对质粒标准品的扩增曲线及标准曲线 Figure 3 Amplification plots and standard curve for standard plasmid with TaqMan PCR |
当粪便模拟标本的含菌浓度为1.0×104~1.0×108 cfu/g时,检测到的扩增荧光信号强度均高于检测阈值0.05;当粪便模拟标本含菌浓度为1.0×103 cfu/g时,3个标本的荧光信号均低于检测阈值。所以本研究建立的产气肠杆菌TaqMan荧光定量PCR方法体系对粪便模拟标本含菌量的检测下限为1.0×104 cfu/g(图 4A)。当粪便模拟标本含菌量为1.0×104~1.0×108 cfu/g时,含菌量对数值与相应Ct值之间呈良好的线性关系(图 4B)。
|
| 注:1~5:Genomic DNA templates of 1.0×108~1.0×104 cfu/g 图 4 TaqMan荧光定量PCR方法对粪便模拟标本的扩增曲线及标准曲线 Figure 4 Amplification plots and standard curve for simulated feces specimens with TaqMan PCR |
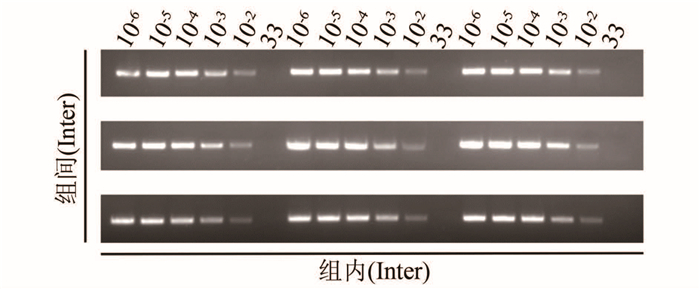
分别用普通PCR方法和TaqMan荧光定量PCR方法对浓度为33,1.0×102~1.0×108 copies/μl的质粒标准品标本进行重复评价。普通PCR组内、组间实验显示:当加入模板质粒标准品浓度为1.0×102copies/μl时,扩增结果均显示阳性;当加入模板质粒标准品浓度为33 copies/μl时,扩增结果均显示阴性(部分结果见图 5)。TaqMan荧光定量PCR方法重复性分析见表 3:组内变异系数为0.15%~0.98%,组间变异系数为0.55%~1.63%。试验结果证实本研究建立的普通PCR方法和TaqMan荧光定量PCR方法的稳定性良好。
|
| 图 5 普通PCR方法对检测产气肠杆菌重复性实验结果(copies/μl) Figure 5 Repeatability of conventional PCR for E. aerogenes |
| 重复性 | 质粒拷贝数 | Ct值 | |||||
| 1 | 2 | 3 | Mean | SD | CV (%) | ||
| 组内 | 33 | 34.39 | 34.52 | 34.78 | 34.56 | 0.20 | 0.57 |
| 102 | 33.61 | 33.80 | 33.97 | 33.79 | 0.18 | 0.53 | |
| 103 | 30.53 | 30.79 | 30.64 | 30.65 | 0.13 | 0.43 | |
| 104 | 27.67 | 27.71 | 27.78 | 27.72 | 0.06 | 0.20 | |
| 105 | 24.38 | 24.43 | 24.45 | 24.42 | 0.04 | 0.15 | |
| 106 | 20.95 | 21.10 | 20.91 | 20.99 | 0.10 | 0.48 | |
| 107 | 17.80 | 17.89 | 18.14 | 17.94 | 0.18 | 0.98 | |
| 108 | 14.37 | 14.40 | 14.52 | 14.43 | 0.08 | 0.55 | |
| 重复性 | 质粒拷贝数 | Ct值 | |||||
| 1 | 2 | 3 | Mean | SD | CV (%) | ||
| 组间 | |||||||
| 33 | 34.25 | 35.29 | 34.64 | 34.94 | 0.53 | 1.50 | |
| 102 | 33.40 | 33.84 | 34.02 | 33.69 | 0.32 | 0.95 | |
| 103 | 30.53 | 30.86 | 31.12 | 30.75 | 0.30 | 0.96 | |
| 104 | 27.54 | 27.76 | 27.84 | 27.69 | 0.16 | 0.56 | |
| 105 | 24.25 | 24.51 | 24.32 | 24.42 | 0.13 | 0.55 | |
| 106 | 20.85 | 21.15 | 21.06 | 21.05 | 0.15 | 0.73 | |
| 107 | 17.70 | 18.29 | 17.97 | 18.09 | 0.30 | 1.63 | |
| 108 | 14.35 | 14.56 | 14.46 | 14.49 | 0.11 | 0.72 | |
疾病诊断时对感染过程中致病菌的快速鉴定和识别非常重要。产气肠杆菌作为重要的院内感染病原菌,随着越来越明显的多重耐药趋势,使其在治疗上面临重大挑战。目前没有针对产气肠杆菌特异的筛选培养基,检出率非常低。临床上一般用生化鉴定仪或生化鉴定试剂条对该菌进行鉴定。分子水平的鉴定需要对分离获得的纯培养菌落,提取基因组DNA后进行16S rDNA测序分析。两种方法均费时费力,无法对样品中是否含有产气肠杆菌进行快速检测。近几年来,基于细菌基因的TaqMan荧光定量PCR方法灵敏度高、特异性强、耗时短、自动化程度高,广泛应用于多种病原菌的检测工作[8, 9, 10, 11]。目前国内外只能够检测到肠杆菌属水平,不能鉴定到产气肠杆菌种[12, 13]。TaqMan荧光定量PCR方法需要特殊的荧光定量仪器,且对操作人员有一定的技术要求,因此笔者同时建立了普通PCR方法,以便在基层实验室推广使用。
hdc基因编码组氨酸脱羧酶,在肠杆菌属内特异性高,在种属间高度保守性且变异率极低,可以用作检测产气肠杆菌的保守基因。除了和普通PCR方法采用两条相同的前后端特异引物外,TaqMan荧光定量PCR法还增加了一条FAM标记的特异探针,大大提高了检测产气肠杆菌的特异性和灵敏度。通过在NCBI数据库搜索比对,没有发现与引物和探针序列匹配的非产气肠杆菌已知序列,同时两种方法对30株非产气肠杆菌种属菌株检测均为阴性,说明这对引物和探针特异性很高。普通PCR和TaqMan荧光定量PCR方法对质粒标准品的检测下限分别为100 copies/μl和33copies/μl,均能满足实际标本检测的需要。普通PCR和TaqMan荧光定量PCR方法对粪便模拟标本的检测下限较高,分别为1.0×105cfu/g和1.0×104cfu/g含菌量。两种方法对质粒标准品和粪便模拟标本检测下限差距较大的原因,推测是粪便模拟标本中的杂质和抑制因子影响了基因组DNA的提取和扩增反应,在实际操作过程中可以通过对原始标本增菌来提高检测的灵敏度。TaqMan荧光定量PCR方法不仅比普通PCR速度快,而且将灵敏度提高了一个数量级,并能够进行定量检测。不同实验室可以根据具体条件选择这两种方法进行产气肠杆菌的检测。传统鉴定方法如生化鉴定和16S rDNA测序都需要得到细菌的纯培养。因为产气肠杆菌没有特异的筛选培养基,本研究建立的两种方法可以减少菌落挑取时漏检的可能。总之,本研究首次建立了应用普通PCR方法和TaqMan荧光定量PCR技术对产气肠杆菌进行特异检测的方法,为进一步的临床应用提供了技术依据。
| [1] | Chang EP, Chiang DH, Lin ML, et al. Clinical characteristics and predictors of mortality in patients with Enterobacter aerogenes bacteremia[J]. J Microbiol Immunol Infect,2009,42(4):329-335. |
| [2] | Narayan SA, Kool JL, Vakololoma M, et al. Investigation and control of an outbreak of Enterobacter aerogenes bloodstream infection in a neonatal intensive care unit in Fiji[J]. Infect Control Hosp Epidemiol,2009,30(8):797-800. |
| [3] | Wong MR, Del ROSSO P, Heine L, et al. An outbreak of Klebsiella pneumoniae and Enterobacter aerogenes bacteremia after interventional pain management procedures, New York city,2008[J]. Reg Anesth Pain Med,2010,35(6):496-499. |
| [4] | Galani I, Souli M, Koratzanis E, et al. Emerging bacterial pathogens:Escherichia coli, Enterobacter aerogenes and Proteus mirabilis clinical isolates harbouring the same transferable plasmid coding for metallo-β-lactamase VIM-1 in Greece[J]. J Antimicrob Chemother,2007,59(3):578-579. |
| [5] | Thiolas A, Bollet C, La Scola B, et al. Successive emergence of Enterobacter aerogenes strains resistant to imipenem and colistin in a patient[J]. Antimicrob Agents Chemother,2005,49(4):1354-1358. |
| [6] | Havelka B. Contribution on the use of Moller's medium for the demonstration of histidine decarboxylase[J]. J Hyg Epidemiol Microbiol Immunol,1969,13(4):463-467. |
| [7] | Enjalbert F, Richard C, Attisso M, et al.Detection and significance of histidine decarboxylase (HDC) in "Klebsiella", "Enterobacter" and "Serratia" (author's transl)[J]. Ann Microbiol,1979,130A(3):385-388. |
| [8] | Hirvonen JJ, Mentula S, Kaukoranta SS. Evaluation of a new automated homogeneous PCR assay, GenomEra C. difficile, for rapid detection of Toxigenic Clostridium difficile in fecal specimens[J]. J Clin Microbiol,2013,51(9):2908-2912. |
| [9] | Kuhar U, Barlic-Maganja D, Grom J. Development and validation of TaqMan probe based real time PCR assays for the specific detection of genotype A and B small ruminant lentivirus strains[J]. BMC Vet Res,2013,9:172. |
| [10] | Allerdice MEJ, Pritt BS, Sloan LM, et al. A real-time PCR assay for detection of the Ehrlichia muris-like agent, a newly recognized pathogen of humans in the upper Midwestern United States[J]. Ticks Tick Borne Dis,2016,7(1):146-149. |
| [11] | Silapong S, Neesanant P, Sethabutr O, et al. A field-expedient method for direct detection of enterotoxigenic E. coli and shigella from stool[J]. US Army Med Dep J,2015:51-58. |
| [12] | Lehmann LE, Hunfeld KP, Emrich T, et al. A multiplex real-time PCR assay for rapid detection and differentiation of 25 bacterial and fungal pathogens from whole blood samples[J]. Med Microbiol Immunol,2008,197(3):313-324. |
| [13] | Westh H, Lisby G, Breysse F, et al. Multiplex real-time PCR and blood culture for identification of bloodstream pathogens in patients with suspected sepsis[J]. Clin Microbiol Infect,2009,15(6):544-551. |
 2016, Vol. 31
2016, Vol. 31


