扩展功能
文章信息
- 王艺婷, 郝帅, 肖迪, 叶长芸, 熊衍文, 刘丽云
- WANG Yi-ting, HAO Shuai, XIAO Di, YE Chang-yun, XIONG Yan-wen, LIU Li-yun
- 弗氏枸橼酸杆菌CF74的T6SS影响FliC的表达和分泌
- T6SS modulates expression and secretion of FliC in Citrobacter freundii
- 疾病监测, 2016, 31(3): 185-191
- Disease Surveillance, 2016, 31(3): 185-191
- 10.3784/j.issn.1003-9961.2016.03.004
-
文章历史
- 收稿日期: 2015-11-20
2. 北京工商大学食品学院, 北京 100048
2. School of Food and Chemical Engineering, Beijing Technology and Business University, Beijing 100048, China
弗氏枸橼酸杆菌是人类和动物肠道的共生菌。一些弗氏枸橼酸杆菌通过获得毒力基因而变成致病菌,已有报道由弗氏枸橼酸杆菌引起的人类腹泻和其他感染病例[1]。在笔者过去的研究中分离到一株具有强的细胞黏附性和细胞毒性的弗氏枸橼酸杆菌CF74[2],通过全基因组测序发现其包含一个完整的Ⅵ型分泌系统(T6SS)基因组岛,通过对该岛及其重要的3个基因(clpV、hcp-2和vgr)缺失,发现该岛及其3个基因在转录水平影响鞭毛系统一些基因的表达,从而影响细菌的动力,并且对弗氏枸橼酸杆菌对细胞的黏附和毒性有一定的贡献[3]。
T6SS广泛存在于革兰阴性细菌中,包括一些病原菌:霍乱弧菌、集聚性黏附大肠埃希菌和沙门菌等[4, 5, 6]。T6SS主要由内膜蛋白IcmF、DotU/IcmH,脂蛋白SciN,ATP酶ClpV以及效应蛋白缬氨酸-甘氨酸重复蛋白G (valine glycine repeat,VgrG) 和溶血素共调节蛋白(hemolysin-coregulated protein,Hcp)组成[7, 8, 9]。T6SS的效应蛋白通过与宿主细胞接触,从而对宿主细胞进行影响。已有文献报道IcmF参与鞭毛蛋白的调控,影响细菌的动力和生物膜形成[10]。笔者以前的研究中也发现T6SS及其相关蛋白ClpV、Hcp和Vgr参与鞭毛蛋白FliC的表达和分泌,以及影响弗氏枸橼酸杆菌对宿主细胞的黏附和毒性[3]。
本研究旨在通过对CF74野生株和T6SS基因组岛缺失突变株的差异蛋白组分析,了解T6SS对CF74的蛋白表达和分泌的影响,从而寻找其在CF74致病中的作用通路。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒和引物如表 1所示,本研究使用的菌株是本实验保存的1株测序株CF74,用其构建了缺失株CF74ΔT6SS。T6-1F、T6-2R、T6-3F和T6-4R是缺失T6SS基因组岛需要的引物;hcp-2-F、hcp-2-R、vgr-F、vgr-R、clpV-F和clpV-R是半定量PCR扩增hcp-2、vgr和clpV基因所需引物;qhcp-2-F、qhcp-2-R、qvgr-F、qvgr-R、qclpV-F和qclpV-R是qRT-PCR扩增hcp-2、vgr和clpV基因所需引物,qgapA-F和qgapA-R是qRT-PCR用于扩增内参基因gapA所需引物。
| 菌株、质粒及引物 | 特征 | 来源 |
| 菌株 | ||
| CF74 | 山羊粪便分离到的弗氏枸橼酸杆菌 | 本实验室保存 |
| CF74ΔT6SS | 精确缺失T6SS基因组岛的CF74菌株 | 本研究构建 |
| E.coli SM10λpir | supE, recA::rp4-2-Tc::Mu,WKmrλpir | 本实验室保存 |
| E.coli DH5αλpir | RP4-2-tet: Mu-Km:: Tn7 integrant Leu-63::IS10 recA1 creC510 hsdR17 endA1 zbf-5 uidA(ΔmluI):pir+ thi | 本实验室保存 |
| 质粒 | ||
| pWM91 | Ampr,f1(+)orilacZa of pBluescript П (SK+); oriRR6Kγ, oriTRP4, sacB, Sucs | 本实验室保存 |
| pWM91ΔT6SS引物 缺失用引物 | pWM91-T6SSup:T6SSdown,氨苄抗性 | 本研究构建 |
| T6-1F | 5′-CCG CTC GAG ACC ACG GCA GTT GCC ACA GG-3′ | 本研究设计 |
| T6-2R | 5′-GGA ATC ATT AAA CGT AAC AAG GAG TTA CCG-3′ | 本研究设计 |
| T6-3F | 5′-TTG TTA CGT TTA ATG ATT CCA GTT CGT TAC-3′ | 本研究设计 |
| T6-4R | 5′-ATT GCG GCC GCG GCT GGA GCA GCA GGG CAA-3′ | 本研究设计 |
| RT-PCR引物 | ||
| hcp-2-F | 5′-GGG GCA AAC CCA GGG CAA TAT CAC C-3′ | 本研究设计 |
| hcp-2-R | 5′-GCC AGT CAT CAG CAC CAG AGG TGC-3′ | 本研究设计 |
| vgr-F | 5′-ACG AGG AAC ATG CCC TCA CCA GC-3′ | 本研究设计 |
| vgr-R | 5′-TCG TCA TTA CCA GCC GGG CCT-3′ | 本研究设计 |
| clpV-F | 5′-TGC GGC AAA TCG GTG ATG ACC G-3′ | 本研究设计 |
| clpV-R | 5′-GCC GCA ATA GCT GGC GAT GAA AG-3′ | 本研究设计 |
| qRT-PCR 引物 | ||
| qhcp-2-F | CCA GCG TTC GCA CAA GC | 本研究设计 |
| qhcp-2-R | AGT TCA GTT TTC GGC AGC A | 本研究设计 |
| qvgr-F | CTC CTT TGT ATC GCT CGG G | 本研究设计 |
| qvgr-R | CCG TAT CGC ACA GCA CCA | 本研究设计 |
| qclpV-F | GCG ACT TGA GGG TGA TTA CTG | 本研究设计 |
| qclpV-R | GGG GAG AAC GAC GGA TAG C | 本研究设计 |
| qgapA-F | GAA CGC CTT TCA TCG GG | 本研究设计 |
| qgapA-R | TCC GTT GTT GAC CTG ACT GT | 本研究设计 |
实验所用硫脲、CHAPS、二硫苏糖醇、碘乙酰胺、Tris Base、甘油、丙烯酰胺、N-N甲叉双丙烯酰胺、SDS、甘氨酸和过硫氨酸均购于Amresco;Taq DNA聚合酶、T4连接酶、高保真酶、dNTPs、DNA Marker为TaKaRa公司产品;质粒提取试剂盒、PCR产物纯化试剂盒、琼脂糖凝胶回收试剂盒为QIAGEN生产;IPG buffer 4-7、固相IPG strip胶条pH 4~7、考马斯亮蓝PhastGel Blue R、低熔点琼脂糖、2D Quant蛋白定量试剂盒、双向电泳设备和双向电泳分析软件ImageMaster 2D Platium购于GE Healthcare;Cocktail联合蛋白酶抑制剂和磷酸酶抑制剂购于Roche;乙腈、三氟乙酸、胰蛋白酶(质谱级)和碳酸氢铵(质谱级)购于Sigma。电泳仪、凝胶成像仪、多功能激光扫描仪和干胶仪购于Bio-Rad。
1.2 方法 1.2.1 培养基及培养条件弗氏枸橼酸杆菌的常规培养条件为:LB液体培养基(1%胰蛋白胨、0.5%酵母提取物、1%NaCl,调节pH至7.4)及LBA固体平板(LB液体培养基中加入1.5%琼脂),37 ℃培养。培养基中所需链霉素(Str)和氨苄西林(Amp)浓度均为100 μg/ml。10%蔗糖LBA平板用于弗氏枸橼酸杆菌突变株的筛选。
1.2.2 弗氏枸橼酸杆菌CF74目的基因缺失突变株的构建通过融合聚合酶链反应(PCR)技术将弗氏枸橼酸杆菌CF74的T6SS基因组岛上下游同源臂融合得到缺失T6SS基因组岛编码区的DNA片段,并将此PCR产物克隆到自杀载体pWM91上,通过DNA测序得到片段正确的重组质粒。将重组质粒转化大肠埃希菌SM10λpir,再接合转移至弗氏枸橼酸杆菌CF74中,经pWM91质粒上sacB基因利用蔗糖平板进行反向筛选并通过PCR进行鉴定,得到T6SS基因组岛缺失突变株。
1.2.3 细菌总RNA的提取与实时荧光定量qRT-PCRCF74野生株和CF74ΔT6SS突变株在LB液体培养基中摇至A600为1.0,离心,收集菌沉淀。菌沉淀被重悬在1 ml Trizol溶液中,再加入氯仿萃取RNA,经过异丙醇沉淀、75%乙醇洗涤,得到RNA沉淀。将RNA样品用RNeasy Mini Kit (Qiagen,Valencia,CA)进行纯化,利用Nano Drop测定RNA浓度。
总RNA (1.0 mg)被反转录成cDNA,作为qRT-PCR的模板。利用特异的引物(表 1),使用SYBR® Premix Ex TaqTMII (Perfect Real Time) (TaKaRa)在Rotor-Gene Q thermal cycler (Qiagen,Valencia,CA)仪器中进行qRT-PCR。Rotor-Gene QSeries 软件 version 1.7 (Qiagen,Valencia,CA)进行数据分析。gapA作为内参,用循环阈值(2-ΔΔCT)法进行基因相对表达量分析。
1.2.4 全菌蛋白和上清蛋白准备CF74野生株和CF74ΔT6SS突变株在LB液体培养基中摇至A600为1.0。菌沉淀被重悬在裂解buffer: 7 mol/L尿素、2 mol/L硫脲、4% CHAPS、65 mmol/L DTT和40 mmol/L Tris含有 1/100 (V/V) protease inhibitors cocktail中,冰上超声破碎,直至细胞裂解液变为澄清;4 ℃超速离心,吸取蛋白上清液,利用2D Quant试剂盒进行蛋白浓度测定,将蛋白分装后冻入-80 ℃保存。
上清培养基,用0.22 μm滤膜(Millipore)过滤除菌,加入10% (V/V) TCA(Sigma-Aldrich),在4 ℃过夜沉淀蛋白。次日,经过高速离心,冰丙酮洗剂,干燥上清蛋白。
1.2.5 2-DE分离按照Amersham公司的2-DE手册描述的进行2-DE。取800 μg蛋白样品,加入1.34 μl IPG(pH 4~7)缓冲液,然后加水化液(266.66 μl)至总体积为350 μl,提前将蛋白与水化液在室温融化1 h,保证蛋白在一向过程中温度不会过低;然后将蛋白加样到上样槽中,胶条正面向下均匀盖住蛋白样品,确保蛋白与胶条之间没有气泡后加入2 ml左右胶条覆盖油,盖好盖子后放入等电聚焦仪器上聚焦;将聚焦好的胶条用SDS-PAGE缓冲液润湿,提前使胶条由聚焦环境转换入二向电泳环境。然后进行二向聚焦。第二向SDS-PAGE胶浓度为12.5%,采用恒流方式电泳,15 ℃循环水冷却,先20 mA,凝胶电泳30 min,待溴酚蓝前沿进入SDS-PAGE约5 mm时将电流加大至60 mA,凝胶。当溴酚蓝迁移至离凝胶底部约3 mm时终止电泳,电泳凝胶进行考马斯亮蓝染色。
1.2.6 图像扫描和分析将考马斯亮蓝染后的胶块用Powerlook Umax 2000扫描仪进行扫描,300 dpi分辨率,透射稿,保存为 .tif格式文件。将扫描的图像导入ImageMaster 2D Platium分析软件中,截取相同大小的图片,生成.mel格式文件。所有凝胶使用相同参数进行自动检测蛋白点,设置参考凝胶(Reference Gel),将其他凝胶的点与参考凝胶进行点匹配,尽量选择小而圆的点进行匹配;将实验组与对照组凝胶进行分组,通过workspace打开所有分组后的胶,在group report中选中所有匹配好的点,再按照Analyze→Statistical test→%Vol→Student T进行统计学检验,根据所需要的临界t值保留具有统计学差异的蛋白点。
1.2.7 胶内酶切及MALDI-TOF MS质谱检测对感兴趣的差异蛋白点切胶、酶解后进行MALDI-TOF MS(4700,MALDI-TOF/TOF-MS,Applied Biosystems,Foster City,CA,USA)检测,获得的数据利用Mascot 2.1.0数据库搜索,然后根据蛋白登录号(IPI或gi)登录Uniprot分析蛋白功能,对感兴趣的蛋白进行进一步验证。
2 结果 2.1 弗氏枸橼酸杆菌CF74ΔT6SS 缺失株的PCR验证前期的研究发现,弗氏枸橼酸杆菌CF74具有强的黏附能力和细胞毒性,并且具有一个完整的T6SS基因组岛[2]。为了解T6SS基因组岛在CF74中的功能,笔者构建了T6SS基因组岛(T6SS gene cluster)缺失突变株CF74ΔT6SS。hcp-2、vgr与clpV是T6SS基因组岛的3个重要的基因,T6SS基因组岛的缺失将导致这3个基因的缺失。通过半定量PCR和qRT-PCR分别扩增T6SS基因组岛中的这3个基因:hcp-2、vgr和clpV,如图 1所示,T6SS基因组岛缺失株没有这3个基因的表达。说明T6SS基因组岛缺失突变株(CF74ΔT6SS)构建成功。
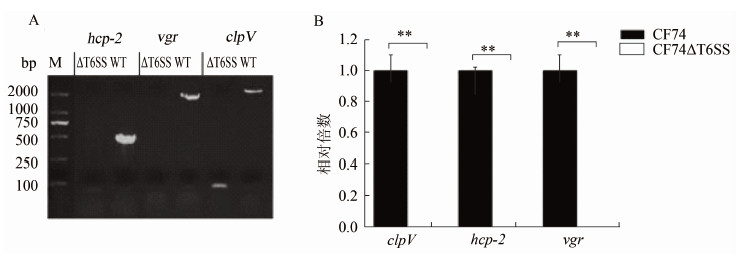
|
| 注:A.通过RT-PCR扩增T6SS基因组岛中的3个基因:hcp-2、vgr和clpV全长,验证CF74的T6SS基因组岛缺失株。B.通过qRT-PCR扩增T6SS基因组岛中的3个基因:hcp-2、vgr和clpV,验证CF74的T6SS基因组岛缺失株。M.DNA Marker。**.P < 0.01。 图 1 CF74缺失T6SS基因组岛的PCR验证结果 Figure 1 Confirmation of T6SS deletion mutant |
在笔者以前的研究中发现T6SS在转录水平影响一些蛋白的转录表达,尤其对鞭毛系统的蛋白转录表达影响十分显著[3]。本研究通过双向电泳技术(2-DE)对培养至稳定期的CF74与CF74ΔT6SS突变株进行全菌蛋白的差异蛋白质组分析发现,在检测到的1200个蛋白点中,有5个蛋白点在CF74ΔT6SS突变株中表达上调,47个蛋白点下调,鉴定为4个上调蛋白和42个下调蛋白(表 2、3)。表达上调的蛋白主要是代谢相关的蛋白。表达下调的蛋白除了鞭毛蛋白FliC(图 2A、B)以外,还有代谢相关的蛋白(包括蛋白代谢、糖代谢和脂肪代谢等)、细胞膜蛋白,另外是一些功能未知的蛋白。
| 蛋白名称 | 基因序列号 | 蛋白分子质量(Da) | 蛋白等电点 | 鉴定的序列号 |
| two-component response regulator [Salmonella enterica subsp.enterica serovar Gallinarum str] | gi|205355309 | 27 286.0 | 5.29 | EQANVALMFLTGR, ILGLEIGADDYITKPFNPR |
| phosphoserine transaminase [Citrobacter youngae ATCC 29220] | gi|283833802 | 39 724.0 | 5.25 | NIGPAGLTIVIVR, ALTDFMVDFER |
| aconitate hydratase [Citrobacter sp. 30_2] | gi|237731708 | 97 393.6 | 5.61 | FGDDDAFEENVR, FVEFYGDGLDTLPLADR |
| isocitrate dehydrogenase [Escherichia coli] | gi|33383669 | 42 907.1 | 5.33 | GPLTTPVGGGIR, DVIADAFLQQILLR |
| 蛋白名称 | 基因序列号 | 蛋白分子质量 (Da) | 蛋白等电点 | 鉴定的序列号 |
| outer membrane protein A [Citrobacter sp.30_2] | gi|237730913 | 38 321.1 | 5.15 | DGSVVVLGFTDR, LGWSQFHDIGNNR |
| PTS enzyme IIAB [Citrobacter sp.30_2] | gi|237731853 | 34 808.3 | 5.74 | TIAIVIGTHGWAAEQLLK, IIVVSDEVAADTVR |
| glycerol dehydrogenase [Citrobacter sp.30_2] | gi|237728059 | 38 584.7 | 4.87 | YLLLPNNPDR, LLAAGIGDALATWFEAR |
| 蛋白名称 | 基因序列号 | 蛋白分子质量 (Da) | 蛋白等电点 | 鉴定的序列号 |
| aspartate ammonia-lyase [Citrobacter sp.30_2] | gi|237729073 | 53 758.4 | 5.37 | LVDALNQLR, ISDIPEFVR |
| trehalase [Citrobacter sp. 30_2] | gi|237731810 | 63 579.7 | 5.71 | SAAASGWDFSSR, EHIDGLWPVLTR |
| peroxiredoxin OsmC [Citrobacter sp. 30_2] | gi|237731535 | 8 417.1 | 5.84 | GQAHWEGDIK, GTVSTESGVLNQQPYGFNTR |
| dihydrodipicolinate synthase [Citrobacter sp. 30_2] | gi|237732464 | 32 031.5 | 6.36 | LAAAGQFAEAR, AIAEHTDLPQILYNVPSR |
| regulatory protein GalF [Citrobacter youngae ATCC 29220] | gi|283832535 | 32 793.1 | 5.67 | AVIPVAGLGMHMLPATK, NAVENHFDTSYELESLLEQR |
| hydroxyacylglutathione hydrolase [Citrobacter sp. 30_2] | gi|237730196 | 28 686.5 | 5.74 | FALSILPHDSFINEYYR, LFEGTATQMYQSLK |
| glutathione reductase [Citrobacter sp. 30_2] | gi|237728827 | 48 710.7 | 5.93 | HYDYIAIGGGSGGIASINR, SSFTAMYTAVTSHR |
| tetrahydrodipicolinate N-succinyltransferase [Citrobacter sp. 30_2] | gi|237729472 | 29 874.4 | 5.76 | VGINELLR, EAVNQVISLLDSGALR |
| thioredoxin-disulfide reductase [Citrobacter youngae ATCC 29220] | gi|283833820 | 34 647.4 | 5.44 | FETEIIFDHISK, ANLQPVLITGMEK |
| inositol 2-dehydrogenase [Citrobacter youngae ATCC 29220] | gi|283835641 | 36 053.2 | 5.73 | EYDVPLFIGFNR, SAYAAEWEHFVAVLR |
| TerE [Citrobacter sp. 30_2] | gi|237728594 | 21 066.3 | 4.72 | LVFAVTIYDAEAR, VLSDAHFIFFNNK |
| tellurite resistance protein [Proteus mirabilis ATCC 29906] | gi|227357349 | 24 660.4 | 6.43 | QSFGQVSGAFIR, NVLVGLGWDAR |
| malate dehydrogenase [Citrobacter sp. 30_2] | gi|237730151 | 32 180.2 | 5.85 | LFGVTTLDIIR, AGGGSATLSMGQAAAR |
| isocitrate dehydrogenase [Citrobacter sp. 30_2] | gi|237731118 | 45 722.5 | 5.16 | DWGYQLAR, VNPGSIILSAEMMLR |
| tyrosine phenol-lyase [Citrobacter youngae ATCC 29220] | gi|283834971 | 51 405.8 | 6.19 | VFYDATR, DEAHDAGLNIAFK |
| conserved hypothetical protein [Citrobacter sp. 30_2] | gi|237730395 | 36 254.5 | 5.30 | VFHQVDDLAEGLSR, NLYNESDENDAQIAAR |
| bifunctional 2′,3′-cyclic nucleotide2′-phosphodiesterase/3′-nucleotidase [Citrobacter sp. 30_2] | gi|237729143 | 70 686.0 | 5.69 | LAPIHSDTPLDIR, AYVEHFIQGDPDLAK |
| pyridoxine 5′-phosphate synthase [Citrobacter sp. 30_2] | gi|237732550 | 26 484.7 | 5.74 | QEVTTEGGLDVAGQR, IPEMHELNIGHAIIGR |
| Flagellin [Escherichia coli] | gi|99645039 | 50 846.7 | 4.82 | DDAAGQAIANR, IEDADYATEVSNMSR |
| putative oxidoreductase protein [Citrobacter sp. MY-5] | gi|58042521 | 38 308.8 | 5.58 | DALNGNGENPVPAR, VILHGTMLAAAESAR |
| PTS system glucose-specific transporter subunit [ Salmonella enterica subsp.enterica serovar Typhi str. CT18] | gi|16761352 | 18 235.8 | 4.73 | VGDPVIEFDLPLLEEK, LSGSVTVGETPVIR |
| glycine acetyltransferase [Citrobacter sp. 30_2] | gi|237728920 | 42 917.7 | 5.63 | EGIYVTGFFYPVVPK, QLTNDLETAR |
| methionine aminopeptidase [Citrobacter sp. 30_2] | gi|237729474 | 29 205.8 | 5.34 | YAEGEGFSVVR, VTQESLYLALR |
| hypothetical protein EcolC_3108 [Escherichia coli ATCC 8739] | gi|170021104 | 28 686.2 | 5.00 | IHYEGMDDVILLDFLPK, GYLNNVTGYR |
| glucokinase [Citrobacter sp. 30_2] | gi|237732389 | 34 412.7 | 5.65 | VLSGPGLVNLYR, YALVGDVGGTNAR |
| succinate-semialdehyde dehydrogenase I[Citrobacter sp. 30_2] | gi|237729618 | 51 825.8 | 5.84 | EETFGPLAPLFR, WFNLMIEHQDDLAR |
| UDP-galactose-4-epimerase [Citrobacter sp. 30_2] | gi|237730734 | 38 779.5 | 5.95 | HPTFVEGDIR, AQPDWSIALLR |
| peroxidase/catalase [Citrobacter sp. 30_2] | gi|237728058 | 79 649.8 | 5.27 | ADLVFGSNSVLR, FLNDPQAFNEAFAR |
| phosphoenolpyruvate carboxykinase [Citrobacter sp. 30_2] | gi|237728722 | 59 786.1 | 5.21 | DAEPEIYNAIR, VIFLTADAFGVLPPVSR |
| glutamine ABC transporter periplasmic protein [Citrobacter sp. 30_2] | gi|237730789 | 27 159.2 | 8.43 | NIDLALAGITITDER, AVGESLEAQQYGIAFPK |
| phosphoribosylaminoimidazole-succinocarboxamidesynthetase [Citrobacter sp. 30_2] | gi|237732462 | 27 007.7 | 5.22 | GEVVLGDEFSPDGSR, TVYSTENPDLLVLEFR |
| FKBP-type peptidyl-prolyl cis-trans isomerase[Citrobacter koseri ATCC BAA-895] | gi|157148918 | 20 708.7 | 4.85 | FNVEVVAIR, DLVVSLAYQVR |
| 3-deoxy-D-arabinoheptulosonate-7-phosphate synthase [Citrobacter sp. 30_2] | gi|237730728 | 40 436.6 | 5.76 | FPATENAANTVAHAR, AGLSAQVMIDFSHANSSK |
| inositol 2-dehydrogenase [Citrobacter youngae ATCC 29220] | gi|283835641 | 36 053.2 | 5.73 | DPSPPPAEYVR, EYDVPLFIGFNR |
| UMP phosphatase [Citrobacter sp. 30_2] | gi|237730641 | 27 142.8 | 5.36 | MQAHSEETVIVGDNLR, AYVVGEGALIHELYK |
| nitrogen regulation protein NR(II) [Citrobacter sp. 30_2] | gi|237727977 | 38 410.2 | 5.44 | NALQALGPEGGEIILR, VVALVSMELPENVTLIR |
| L-arabinose-binding periplasmic protein[Citrobacter sp. 30_2] | gi|237731935 | 35 295.1 | 6.86 | VIAVDDQFANAK, GAEPPAFTEVTDVVLITR |
| alpha/beta hydrolase fold protein [Citrobacter sp. 30_2] | gi|237730595 | 32 856.5 | 6.38 | ESFVEQGLQGSIK, DAVHVGHSTGGGEVAR |
| fumarate hydratase [Citrobacter sp. 30_2] | gi|237731423 | 50 612.8 | 6.11 | SLIPQLNVLTK, AIMQAADEVLADK |
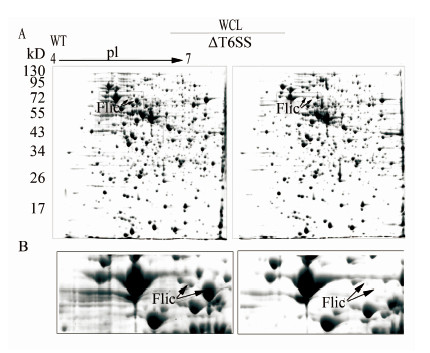
|
| 注:A,稳定期CF74野生株与CF74ΔT6SS突变株全菌蛋白2-DE图谱;B,局部放大结果显示FliC蛋白在CF74ΔT6SS突变株中表达显著下调。 图 2 CF74野生株与CF74ΔT6SS突变株全菌蛋白2-DE结果 Figure 2 Comparative analysis of 2-DE of WCL proteins of C. freundii strainCF74 and CF74ΔT6SS. |
病原菌主要靠分泌蛋白与宿主细胞接触而致病。本研究为进一步了解弗氏枸橼酸杆菌CF74的T6SS对其他蛋白分泌的影响,提取了培养至稳定期的CF74野生株与CF74ΔT6SS突变株的上清蛋白,并进行2-DE分析。共检测到600个蛋白点,有29个蛋白点在CF74ΔT6SS中表达上调,44个蛋白点下调。这些点被鉴定为27个上调蛋白,36个下调蛋白(数据没有给出)。在这些下调蛋白中,FliC、FlgK和FliD蛋白的分泌显著降低(图 3A、B)。
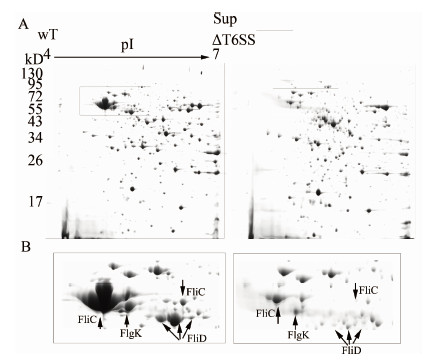
|
| 注:A:稳定期CF74野生株与CF74ΔT6SS突变株培养上清蛋白2-DE图谱,pI值 (IPG 胶条4~7)在胶图中被指出;B:局部放大结果显示FliC、FlgK和FliD蛋白在CF74ΔT6SS突变株中分泌显著下调。 图 3 CF74野生株与CF74ΔT6SS突变株培养上清蛋白2-DE结果 Figure 3 Comparative analysis of 2-DE of supernatant proteins (Sup) of C. freundii strainCF74 and CF74ΔT6SS |
目前对于细菌的T6SS的研究还不是很多,大部分集中在T3SS和T4SS上。在笔者以前的研究中发现1株含有T6SS基因组岛的细胞强毒性弗氏枸橼酸杆菌CF74[2]。为了解T6SS对CF74致病中的贡献,通过构建其T6SS基因组岛缺失突变株,并进行转录组分析发现,T6SS对CF74的大部分基因转录进行正调控,尤其对鞭毛系统的一些基因,包括效应蛋白、伴侣蛋白或调节因子等,其中fliC、flgM、flgL、fliT、flgK、fliD以及MotA这些鞭毛基因在CF74ΔT6SS突变株中表达出现显著下调[3]。T6SS中3个重要的功能蛋白:Vgr、Hcp-2和ClpV,也影响了鞭毛系统相关基因的转录水平表达。在鸟类致病性大肠埃希菌中,icmF的缺失能够降低flhC、flhD、flgM和fliA等鞭毛基因的转录水平表达[10]。本研究通过2-DE分析发现,T6SS基因组岛在蛋白水平影响了一些蛋白的表达,主要为代谢相关的蛋白(包括蛋白代谢、糖代谢和脂肪代谢等)、细胞膜蛋白以及一些功能未知的蛋白,同时对鞭毛蛋白FliC有正调控作用。此外,T6SS基因组岛也影响一些蛋白的分泌,尤其是鞭毛系统的蛋白,如FliC、FlgK和FliD蛋白的分泌。
已经有文献报道T6SS贡献于鸟类致病性大肠埃希菌对宿主细胞的黏附[11],并且介导支气管败血波氏杆菌对小鼠巨噬细胞的细胞毒性[12]。FliC蛋白参与病原菌的细胞毒性[13]。笔者以前的研究发现T6SS参与CF74的细胞黏附和细胞毒性[3],本研究发现T6SS的缺失导致FliC蛋白的表达和分泌降低,推测T6SS通过调控FliC蛋白的表达和分泌而引起CF74的致病。但是,T6SS是如何调控和影响FliC蛋白的表达与分泌还需要进一步研究。
FliC蛋白是组成细菌鞭毛纤维的重要成分,已有报道它可以通过T3SS或T4SS等分泌系统由细胞质向鞭毛运输,再通过帽子蛋白FliD进行聚合,最终形成长长的螺旋形鞭毛纤维[14, 15]。本研究发现,T6SS基因组岛缺失后,FliC蛋白的表达和分泌降低。这说明FliC蛋白的表达降低不仅仅是由fliC基因表达缺陷影响,也受T6SS的影响。
| [1] | Karasawa T, Ito H, Tsukamoto T, et al. Cloning and characterization of genes encoding homologues of the B subunit of cholera toxin and the Escherichia coli heat-labile enterotoxin from clinical isolates of Citrobacterfreundii and E. coli[J]. InfectImmu,2002,70(12):7153-7155. |
| [2] | Bai L, Xia SL, Lan RT, et al. Isolation and characterization of cytotoxic, aggregative Citrobacterfreundii[J]. PLoS One,2012,7(3):e33054. |
| [3] | Liu LY, Hao S, Lan RT, et al. The type Ⅵ secretion system modulates flagellar gene expression and secretion in Citrobacterfreundii and contributes to adhesion and cytotoxicity to host cells[J]. Infect Immun,2015,83(7):2596-2604. |
| [4] | Pukatzki S, Ma AT, Sturtevant D, et al. Identification of a conserved bacterial protein secretion system in Vibriocholerae using the Dictyostelium host model system[J]. Proc Natl Acad Sci USA,2006,103(5):1528-1533. |
| [5] | Dudley EG, Thomson NR, Parkhill J, et al. Proteomic and microarray characterization of the Agg Rregulon identifies a pheU pathogenicity island in enteroaggregative Escherichia coli[J]. Mol Microbiol,2006,61(5):1267-1282. |
| [6] | Parsons DA, Heffron F. sciS, an icmF homolog in Salmonella enterica serovar Typhimurium, limits intracellular replication and decreases virulence[J]. Infect Immun,2005,73(7):4338-4345. |
| [7] | Bönemann G, Pietrosiuk A, Diemand A, et al. Remodelling of VipA/VipB tubules by ClpV-mediated threading is crucial for type Ⅵ protein secretion[J]. EMBO J,2009,28(4):315-325. |
| [8] | Wu HY, Chung PC, Shih HW, et al. Secretome analysis uncovers an Hcp-family protein secreted via a type Ⅵ secretion system in Agrobacteriumtumefaciens[J]. J Bacteriol,2008,190(8):2841-2850. |
| [9] | Zheng J, Leung KY. Dissection of a type Ⅵ secretion system in Edwardsiellatarda[J]. Mol Microbiol,2007,66(5):1192-1206. |
| [10] | de Pace F, Boldrin de Paiva J, Nakazato G, et al. Characterization of IcmF of the type Ⅵ secretion system in an avian pathogenic Escherichia coli (APEC) strain[J]. Microbiology,2011,157(10):2954-2962. |
| [11] | Ma JL, Bao YL, Sun M, et al. Two functional type Ⅵ secretion systems in avian pathogenic Escherichia coli are involved in different pathogenic pathways[J]. Infect Immun,2014,82(9):3867-3879. |
| [12] | Weyrich LS, Rolin OY, Muse SJ, et al. A type Ⅵ secretion system encoding locus is required for Bordetellabronchiseptica immunomodulation and persistence invivo[J]. PLoS One,2012,7(10):e45892. |
| [13] | Olsen JE, Hoegh-Andersen KH, Casadesús J, et al.The role of flagella and chemotaxis genes in host pathogen interaction of the host adapted Salmonellaenterica serovar Dublin compared to the broad host range serovar S. Typhimurium[J]. BMC Microbiol,2013,13(1):67. |
| [14] | Badea L, Beatson SA, Kaparakis M, et al. Secretion of flagellin by the LEE-encoded type Ⅲ secretion system of enteropathogenic Escherichia coli[J]. BMC Microbiol,2009,9(1):30. |
| [15] | Miao EA, Andersen-Nissen E, Warren SE, et al. TLR5 and Ipaf:dual sensors of bacterial flagellin in the innate immune system[J]. Semin Immunopathol,2007,29(3):275-288. |
 2016, Vol. 31
2016, Vol. 31


