扩展功能
文章信息
- 潘军航, 沈伟伟, 张严峻, 占利, 龚璞, 梅玲玲
- PAN Jun-hang, SHEN Wei-wei, ZHANG Yan-jun, ZHAN Li, GONG Pu, MEI Ling-ling
- 一株死亡患者分离的致死创伤弧菌菌株的耐药表型与分子特征
- Drug resistance phenotype and molecular characteristics of a virulent Vibrio vulnificus strain isolated from a fatal case
- 疾病监测, 2016, 31(3): 229-232
- Disease Surveillance, 2016, 31(3): 229-232
- 10.3784/j.issn.1003-9961.2016.03.012
-
文章历史
- 收稿日期: 2015-11-03
2. 台州市疾病预防控制中心, 浙江台州 318000
2. Taizhou Center for Disease Control and Prevention, Taizhou 318000, China
创伤弧菌(Vibrio vulnificus)是一种革兰阴性的条件致病菌,广泛分布于近海与江河口环境中[1]。生食被创伤弧菌污染的海水产品易导致原发性败血症和坏死性筋膜炎。伤口被创伤弧菌感染易导致原发性坏死性筋膜炎和继发性败血症。在我国,创伤弧菌的感染病例主要发生在浙江等沿海地区,其中生食海产品是导致创伤弧菌感染的主要原因,而伤口感染则是次要原因。在浙江省食源性疾病监测系统信息分析时,发现网络报告了1例主诉腹痛腹泻的病例,该患者病情恶化进展很快,于当天晚上临床宣布死亡,次日报告经血培养分离出革兰阴性菌,初步鉴定为创伤弧菌,后续对该致病菌进行耐药表型和分子特征的分析。
1 材料与方法 1.1 材料 1.1.1 病例信息2014年7月16日,患者D某,男,57岁,于当日08:20到浙江省某县人民医院就诊,主诉腹痛腹泻。在10 h内出现阵发性腹痛、胀痛,伴有2~3次腹泻,先呈软便,后呈浠水样便。无明显畏寒发热、头昏头痛、胸闷气促等其他症状。经测体温38.6 ℃,血压112/86 mmHg,神志清醒,两肺呼吸清,未闻及罗音。腹部稍有膨隆,有轻压痛,无反跳痛。10:50,患者腹胀较前加重,有头晕,呼吸促,精神差,全身疲软无力。全身皮肤可见大片状荨麻疹样皮疹,左大腿内侧见大片瘀斑,四肢皮肤冷,无尿。感染科和ICU会诊,使用比阿培南以及解痉解痛药物治疗。11:50病情加重,转ICU病房,当晚20:00临床宣告死亡。
1.1.2 主要试剂VITEK 2 GN鉴定卡和VITEK 2 AST-GN09药敏卡片为法国生物梅里埃公司产品;科玛嘉显色培养基;胰蛋白胨大豆琼脂购自北京路桥技术股份有限公司;PCR等试剂购自宝生物工程有限公司;QIAamp DNA Mini Kit购自QIAGEN公司;引物合成及测序由生工生物工程(上海)股份有限公司完成。
1.1.3 主要仪器法国生物梅里埃VITEK 2-COMPACT全自动微生物分析仪、Eppendorf Mastercycler Gradient PCR仪,BIO-RAD Gel Doc XR凝胶成像仪,ABI 7500 Fast real time PCR仪。
1.2 检测方法 1.2.1 生化鉴定将报送的菌株2014-DJH经科玛嘉弧菌显色培养基、胰蛋白胨大豆琼脂纯化培养后,采用VITEK 2-COMPACT全自动微生物分析仪进行生化复核鉴定。
1.2.2 药物敏感试验将规定浓度的纯菌菌悬液接种至VITEK 2 AST-GN09药敏卡片,VITEK 2-COMPACT全自动微生物分析仪自动判读结果。
1.2.3 基因组DNA提取挑取单菌落至3% NaCl Luria-Bertani(LB)液体培养基,37 ℃过夜培养,根据QIAamp DNA Mini Kit说明提取基因组DNA,于-20 ℃保存备用。
1.2.4 PCR检测vvhA、vcg(virulence-correlated gene)和16S rRNA基因分型参照文献检测[2, 3, 4]。PCR产物经1%琼脂糖凝胶电泳,BIO-RAD Gel Doc XR凝胶成像后判定结果。pilF基因采用real time PCR方法检测[5]。
1.3 多位点序列分析(Multilocus sequence typing,MLST) 1.3.1 PCR引物与反应体系根据MLST网络数据库( http://pubmlst.org/vvulnificus/)创伤弧菌10个管家基因合成聚合酶链反应(PCR)扩增引物和测序引物[6]。10对扩增引物的PCR反应采用50 μl反应体系,反应条件:94 ℃ 5 min;94 ℃ 1 min,50 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。取5 μl PCR产物用1%琼脂糖凝胶电泳后,经BIO-RAD Gel Doc XR凝胶成像,观察扩增效果。扩增出单一条带、大小相符的PCR产物送生工生物工程(上海)股份有限公司进行纯化和双向测序。
1.3.2 等位基因序列提交和ST命名将2014-DJH菌株的10个管家基因双向测序的结果用DNAstar Lasergene 7软件进行拼接[7],将等位基因序列与MLST网络数据库进行比对,获得菌株的各等位基因编号,根据等位基因编号获得ST型。
1.3.3 ST型比较分析将新ST型与数据库中其他ST型进行比对,导出与其相似性高的ST型串联拼接序列(4326 bp),利用Mega 5.0软件进行序列的比对分析[8],采用Kimura 2-parameter模型,bootstrap=1000,构建Minimum Evolution(ME)系统发生树。
2 结果 2.1 生化鉴定与药物敏感试验经VITEK 2-COMPACT生化鉴定,菌株2014-DJH为创伤弧菌(94%概率)。根据菌株生化特征和宿主来源,鉴定为生物1型创伤弧菌。药敏试验结果显示,菌株2014-DJH对氨苄西林、氨苄西林/舒巴坦、哌拉西林、哌拉西林/他唑巴坦、头孢唑啉、头孢曲松、头孢呋肟、头孢替坦、头孢他啶、头孢吡肟、氨曲南、亚胺培南、美罗培南、阿米卡星、庆大霉素、环丙沙星、左氧氟沙星、呋喃妥因、甲氧苄啶/磺胺甲恶唑等抗生素敏感,对妥布霉素中度敏感。
2.2 PCR检测和基因分型经PCR检测,2014-DJH菌株vvhA阳性,pilF阳性,vcg和16S rRNA基因分型为vcgC-16S rRNA B型(CB型)。
2.3 MLST分型将创伤弧菌2014-DJH的10个管家基因序列与PubMLST公共数据库中创伤弧菌的等位基因序列进行比对,得到该菌株各等位基因的编码为glp 5、gyrB 3、mdh 32、metG 68、purM 21、dtdS 39、lysA 115、pntA 4、pyrC 42、tnaA 75,其中metG、lysA和tnaA为新编码的等位基因序列。各等位基因序列编号通过与数据库比对,并经数据库管理员确认该菌株为新ST型,命名为ST 289,注册号(PubMLST id)为id-389。将菌株2014-DJH的ST型与数据库其他ST型进行比较分析,结果显示ST 289型与其他ST型存在较大差异,在10个保守等位基因位点中,具有两个相同位点的ST型共19个,导出上述19个ST型的串联拼接序列,采用Mega 5.0软件进行比对分析,构建ME树(图 1),结果显示ST 289型与ST 69型相似性最高,两者核酸序列比对相似度为99.03%。
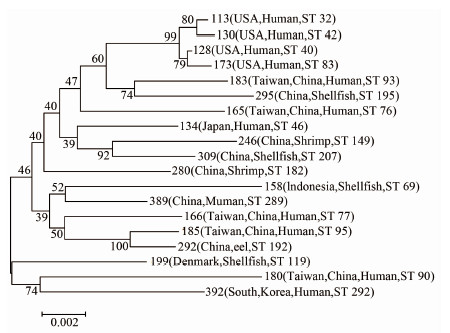
|
| 图1 19个ST型创伤弧菌间最小进化树 Figure 1 ME tree constructed using concatenated sequences of the 19 STs |
浙江省是我国大陆地区报道创伤弧菌感染病例最早也是最多的区域,因此浙江省在开展食源性疾病监测时,在沿海地市将创伤弧菌列入了监测范围。本研究病例并未符合该监测项目的病例定义,但因患者最初以腹痛腹泻为主诉就诊,哨点医院将该病例纳入监测范围,并通过网络平台报告了病例信息及病原检测等后续结果。该病患就诊后病情快速恶化,并最终死亡,经血培养检出创伤弧菌,引起了关注。由于后续发生医疗纠纷等问题,无法开展流行病学调查,缺失了流行病学信息,因此只对该病原菌的药敏表型和分子特征进行分析。创伤弧菌与霍乱弧菌、副溶血性弧菌被认为是最重要的3种致病性弧菌,进食被创伤弧菌污染的食品而引起的食物中毒是最严重的食源性疾患之一,其引起的蜂窝组织炎和败血症,免疫力低下的患者其致死率可高达50%~60%[1]。该病例患者是一名海产养殖户,本身为肝硬化(失代偿期)患者,有腹水史,自身免疫力低下,患者的相关症状中,胃肠道的腹泻症状与腹泻监测中的病例症状相似[9],而其发热、全身皮肤出现大片状皮疹、大腿内侧大片瘀斑、四肢冷及肾功能损伤等症状与Zhao等[10]报道的浙江省创伤弧菌感染病例临床特征和Cazorla等[11]报道的伤口感染病例特征均相似,结合在患者血液中分离出创伤弧菌,可以认为该病例是因感染致病性创伤弧菌而导致病情进展快速,直至死亡。
在该病例的血液标本中检出革兰阴性菌,生化鉴定为创伤弧菌。经PCR方法检测其溶细胞素vvhA基因阳性,鉴定为创伤弧菌。创伤弧菌根据其生化特征和宿主来源可以分成生物1型、2型和3型。其中1型主要分布于海洋环境和海水产品中,可以使人致病,是创伤弧菌主要的生物型别[6]。根据菌株2014-DJH的生化特征可确定为生物1型,与韦俊超等[12]从患者脓液样本中分离的创伤弧菌生物型相同。近年在浙江沿海海产品中分离的创伤弧菌主要为生物1型,仅在虾中有几株生物2型菌株的检出[13]。
药敏结果显示,菌株2014-DJH对妥布霉素中度敏感,对其他19种抗生素均敏感。在临床分离株中,尤荣开等[14]报道11株创伤弧菌对妥布霉素等抗生素均敏感,有3株菌对环丙沙星耐药。韦俊超等[12]从脓液标本中分离的创伤弧菌对头孢唑啉和头孢替坦中度耐药,而从腹泻患者分离的菌株对头孢唑啉、头孢替坦和妥布霉素中度敏感[9]。另外在舟山地区海水产品中分离的部分创伤弧菌对妥布霉素(26.6%)和阿米卡星(15.6%)耐药[15]。而在杭州市售虾中分离的33株创伤弧菌,对头孢唑啉和妥布霉素均中度敏感或耐药[13]。卢中秋等[16]在创伤弧菌脓毒症诊疗方案中将三代头孢菌素和喹诺酮类药物组合作为创伤弧菌感染脓毒症早期的首选用药,而目前头孢噻肟加环丙沙星的组合是治疗疑似创伤弧菌感染的一个很好的选择[17]。对于头孢唑啉和妥布霉素等抗生素,海水产品中分离的菌株比临床分离株表现出更高比例的耐药,其原因可能与养殖环境中抗生素的滥用有关,如果感染耐药的创伤弧菌,将导致更加严重的问题。因此有必要加强菌株耐药性监测,合理使用抗生素,减少耐药株的产生。
PilF蛋白是Ⅳ型菌毛的组成蛋白之一,在一些细菌性致病菌中,pilF基因发生突变后对小鼠的致病力就会减弱[18],pilF基因的多样性被认为与创伤弧菌对人的致病潜力相关。经PCR检测2014-DJH菌株pilF阳性,提示该菌对人类有致病毒力。vcg和16S rRNA基因分型CB型通常认为与其致病性有显著性关系[19],2014-DJH菌株为CB型。多种基因分型的结果均表明该菌株具有较强的致病能力。
MLST是1998年由Maiden等[20]提出的一种新型的微生物分子分型方法,本研究中分离的菌株2014-DJH为一个新ST型,被命名为ST 289(id-389),是我国大陆提交的第一株致死创伤弧菌菌株的MLST信息。经串联序列比对分析,构建最小进化树,结果表明ST 289型与印度尼西亚贝类海产品中分离的菌株ST 69型(id-158)相似性最高(99.03%),其次是中国台湾地区临床分离的ST 77型(id-166)、ST 185(id-185)和大陆地区鳗鱼中分离的ST 192型(id-292)。由于大陆地区对创伤弧菌临床分离株缺少分子特征分析,没有相关的基因型与ST型的信息。而从序列分析看,ST 289型与我国大陆地区报道的海水产品或环境分离菌株ST型存在一定的差异,但与我国台湾地区报道的临床分离株比较接近。
由于创伤弧菌菌株间存在多样性,且可以通过水平基因转移获取其他菌株甚至其他菌种的遗传物质,从而获得新的致病表型[21]。因此需要对创伤弧菌的分离株特别是临床分离株进行分子分型和分子特征研究,从而揭示该区域主要致病型菌株的分布特征与流行趋势。针对该致命菌株,下一步将开展全基因组测序,有必要对其毒力岛,毒力基因的分布与功能等进行深入的分析,以促进相关致病机制的研究。
| [1] | Jones MK, Oliver JD. Vibrio vulnificus:disease and pathogenesis[J]. Infect Immun,2009,77(5):1723-1733. |
| [2] | Pan JH, Jin DZ, Mei LL, et al. Application of a real-time PCR method for rapid detection of Vibrio vulnificus in oyster[J]. Chinese Journal of Health Laboratory Technology,2010,20(6):1314-1318. (in Chinese)潘军航,金大智,梅玲玲,等. 实时荧光定量PCR快速检测创伤弧菌的研究[J]. 中国卫生检验杂志,2010,20(6):1314-1318. |
| [3] | Warner EB, Oliver JD. Multiplex PCR assay for detection and simultaneous differentiation of genotypes of Vibrio vulnificus biotype 1[J]. Foodborne Pathog Dis,2008,5(5):691-693. |
| [4] | Nilsson WB, Paranjype RN, DePaola A, et al. Sequence polymorphism of the 16S rRNA gene of Vibrio vulnificus is a possible indicator of strain virulence[J]. J Clin Microbiol,2003,41(1):442-446. |
| [5] | Baker-Austin C, Lemm E, Hartnell R, et al. pilF polymorphism-based real-time PCR to distinguish Vibrio vulnificus strains of human health relevance[J]. Food Microbiol,2012,30(1):17-23. |
| [6] | Bisharat N, Cohen DI, Harding RM, et al. Hybrid Vibrio vulnificus[J]. Emerg Infect Dis,2005,11(1):30-35. |
| [7] | Burland TG. DNASTAR's lasergene sequence analysis software[J]. Methods Mol Biol,2000,132:71-91. |
| [8] | Tamura K, Peterson D, Peterson N, et al. MEGA5:molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Mol Biol Evol,2011,28(10):2731-2739. |
| [9] | Pan JH, Ye JL, Zhu M, et al. Detection of Vibrio vulnificus in stool samples from diarrhea patients in Zhejiang province[J]. Disease Surveillance,2012,27(1):59-61. (in Chinese)潘军航,叶菊莲,朱敏,等. 腹泻样本中创伤弧菌的检测分析[J]. 疾病监测,2012,27(1):59-61. |
| [10] | Zhao H, Xu LC, Dong HH, et al. Correlations between clinical features and mortality in patients with Vibrio vulnificus infection[J]. PLoS One,2015,10(8):e0136019. |
| [11] | Cazorla C, Guigon A, Noel M, et al. Fatal Vibrio vulnificus infection associated with eating raw oysters, New Caledonia[J]. Emerg Infect Dis,2011,17(1):136-137. |
| [12] | Wei JC, Pan JH, Li YH. Isolation and identification of a new Vibrio vulnificus type by MLST[J]. Chinese Journal of Health Laboratory Technology,2014,24(8):1109-1111, 1115. (in Chinese)韦俊超,潘军航,李月华.一株新MLST型创伤弧菌的分离鉴定[J]. 中国卫生检验杂志,2014,24(8):1109-1111, 1115. |
| [13] | Pan JH, Zhang YJ, Jin DZ, et al. Molecular characterization and antibiotic susceptibility of Vibrio vulnificus in retail shrimps in Hangzhou, People's Republic of China[J]. J Food Prot,2013,76(12):2063-2068. |
| [14] | You RK, Chen XP, Shao ZZ, et al. Sensitivity of Vibrio vulnificus to common antimicrobials[J]. Chinese Journal of Nosocomiology,2007,17(10):1312-1313. (in Chinese)尤荣开,陈秀平,邵朝朝,等. 创伤弧菌对常用抗菌药物的敏感性[J]. 中华医院感染学杂志,2007,17(10):1312-1313. |
| [15] | Yu Y, Pan JH, Shi YS, et al. Genotyping and drug susceptibility test of Vibrio vulnificus strains[J]. Disease Surveillance,2013,28(2):136-139. (in Chinese)虞艳,潘军航,石亚素,等. 多株创伤弧菌的基因分型和药敏试验[J]. 疾病监测,2013,28(2):136-139. |
| [16] | Lu ZQ, Lu CJ, Cheng JY, et al. A protocol for diagnosis and treatment of Vibrio vulnificus sepsis[J].Chinese Journal of Critical Care Medicine,2007,27(8):690-692. (in Chinese)卢中秋,卢才教,程俊彦,等. 创伤弧菌脓毒症诊疗方案(草案)[J]. 中国急救医学,2007,27(8):690-692. |
| [17] | Kim DM, Lym Y, Jang SJ, et al. In vitro efficacy of the combination of ciprofloxacin and cefotaxime against Vibrio vulnificus[J]. Antimicrob Agents Chemother,2005,49(8):3489-3491. |
| [18] | Chakraborty S, Monfett M, Maier TM, et al. Type Ⅵ pili in Francisellatularensis: roles of pilF and pilT in fiber assembly, host cell adherence, and virulence[J]. InfectImmun,2008,76(7):2852-2861. |
| [19] | Warner E, Oliver JD. Population structures of two genotypes of Vibrio vulnificus in oysters (Crassostreavirginica) and seawater[J]. Appl Environ Microbiol,2008,74(1):80-85. |
| [20] | Maiden MCJ, Bygraves JA, Feil E, et al. Multilocus sequence typing:a portable approach to the identification of clones within populations of pathogenic microorganisms[J]. Proc Natl Acad Sci USA,1998,95(6):3140-3145. |
| [21] | Efimov V, Danin-Poleg Y, Raz N, et al. Insight into the evolution of Vibrio vulnificus biotype 3's genome[J]. Front Microbiol,2013,4:393. |
 2016, Vol. 31
2016, Vol. 31


