扩展功能
文章信息
- 夏远志, 王雪枝, 刘海灿, 李马超, 赵秀芹, 楼永良, 吕建新, 万康林
- XIA Yuan-zhi, WANG Xue-zhi, LIU Hai-can, LI Ma-chao, ZHAO Xiu-qin, LOU Yong-liang, LYU Jian-xin, WANG Kang-lin
- 结核分枝杆菌抗原Rv2654c、Rv1985c和Rv3868的克隆表达及血清诊断学初步评价
- Cloning expression of antigens Rv2654c, Rv1985c and Rv3868 of Mycobacterium tuberculosis and value in serological diagnosis of tuberculosis
- 疾病监测, 2016, 31(4): 272-277
- Disease Surveillance, 2016, 31(4): 272-277
- 10.3784/j.issn.1003-9961.2016.04.004
-
文章历史
- 收稿日期: 2015-12-28
2. 中国疾病预防控制中心传染病预防控制所, 传染病预防控制国家重点实验室, 北京102206
2. State Key Laboratory for Communicable Disease Prevention and Control, National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
结核病是由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)感染引起的慢性传染病,可侵袭多种脏器,以肺部感染最常见,是威胁人类健康的主要传染病之一[1]。遏制结核病蔓延的关键在于建立一个简便、快速、准确的诊断方法[2]。目前,临床上诊断结核病的金标准仍是细菌学检查,但是由于痰涂片镜检阳性率偏低,且结核菌的培养十分耗时,因此探索结核病的免疫学诊断具有重要意义[3]。血清学诊断方法是结核病早期诊断的重要手段,对于菌阴肺结核和肺外结核血清学诊断更有意义[4]。其中酶联免疫吸附试验(enzyme linked immunosorbentassay,ELISA)作为一种常见的血清学诊断方法,具有简便、快速的特点,在临床诊断领域被广泛应用。本研究将ELISA与受试者工作特征曲线(receiver operating characteristic curve,ROC)结合,相比传统的比值法(test to negativeratio,TNR),可以对抗原的诊断效能做出更加客观、准确的判断[5]。选取3种特异性蛋白Rv2654c、Rv1985c和Rv3868,探索其在结核病血清学诊断中的应用价值,为进一步研究结核病早期诊断和疫苗的开发提供前期实验基础。
1 材料与方法 1.1 实验菌株结核分枝杆菌标准株H37Rv、pET-32a质粒由本实验室保存,感受态细胞BL21(DE3)购自康为世纪生物科技有限公司。
1.2 血清来源190份血清由中国疾病预防控制中心传染病预防控制所结核病室提供。根据卫生部发布的国家标准WS 2882008《肺结核诊断标准》,其中95份痰涂片和/或细菌培养阳性的样本,确认为结核病,取患者静脉血,分离血清作为阳性样本;另有95份经痰涂片镜检、细菌培养、X线胸片和结核分枝杆菌抗体(IgG)检测试剂盒检测均为阴性的样本,作为对照。
1.3 试剂限制性内切酶及T4 DNA连接酶购自美国New England Biolabs公司;琼脂糖胶回收试剂盒、普通DNA纯化试剂盒及质粒中提试剂盒、辣根过氧化物酶标记的羊抗人IgG(Goat Anti-Human IgG HRP)购自康为世纪生物科技有限公司;异丙基硫代半乳糖苷(IPTG)购自美国Amresco公司;BCA蛋白质定量试剂盒、可溶性单组分TMB底物溶液购自天根生化科技有限公司。
1.4 方法 1.4.1 目的基因的扩增与重组质粒的构建利用Primer 6.0软件设计目的基因的特异性上下游引物,并分别引入EcoRⅠ和HindⅢ酶切位点,并设置相应的保护碱基(表 1)。对用PCR仪扩增得到的目的基因和质粒pET-32a分别进行EcoRⅠ和HindⅢ双酶切,经试剂盒回收后用T4 DNA连接酶连接构建为重组质粒。之后将重组质粒转入DH5a感受态细胞中,接种于含有氨苄霉素的LB固体培养皿上,37 ℃培养过夜。挑取孤立的单克隆菌落接种于含氨苄西林的LB液体培养基中,摇床培养后利用质粒提取试剂盒提取重组质粒并进行测序。返回的测序结果进行BLAST比对,将比对结果达100%的重组质粒转化入BL21(DE3)感受态细胞内进行少量的摇菌,并加入IPTG(1 mmol/L)37 ℃诱导表达3 h,用聚丙烯酰胺凝胶电泳(SDS-PAGE)对表达蛋白进行验证。
| 目的基因 | 引物序列(5′~3′) | 酶切位点 | 扩增基因长度(bp) | 扩增温度(℃) |
| Rv2654c | F: TAT ACG AAT TCA TGA GCG GCC ACG CGT TGG | EcoRⅠ | 246 | 69 |
| R: TAT ATA AGC TTT CAC GGC GGA TCA CCC CGG | HindⅢ | |||
| Rv1985c | F: TCG ACG AAT TCA TGG TGG ATC CGC AGC TTG | EcoRⅠ | 912 | 68 |
| R: TAT ATA AGC TTT CAA CCC GGT CGG CGG CG | HindⅢ | |||
| Rv3868 | F: TCA CTG AAT TCA TGA CTG ATC GCT TGG CCA G | EcoRⅠ | 1722 | 65 |
| R: GCG CGA AGC TTT CAT TCT CTC ATG TTG AGG T | HindⅢ |
对Rv2654c、Rv1985c、Rv3868目的蛋白进行大量表达,采用GE公司的XK纯化柱配合恒流泵、蛋白检测仪,对目的蛋白进行纯化。纯化后的蛋白经SDS-PAGE电泳验证,经0.22 μm滤器过滤后于-70 ℃超低温保存。
1.4.3 ELISA检测目的蛋白对结核病患者的免疫原性最佳抗原和血清稀释度的确定使用BCA蛋白质定量试剂盒对各目的蛋白的浓度进行测定。采用棋盘滴定的方法摸索各抗原的最佳稀释度、对应的最佳血清稀释度和二抗稀释度。根据目的蛋白的浓度,用抗原包被缓冲液对抗原Rv2654c作1:50、1:100、1:200、1:400、1:800、1:1600梯度稀释;对抗原Rv1985c和Rv3868作1:25、1:50、1:100、1:200、1:400、1:800梯度稀释。然后用不同稀释度的抗原每孔100 μl包被酶标板,于4 ℃过夜。洗板,用无蛋白封闭液封闭酶标孔,37 ℃反应2 h。洗板后将阴性血清和阳性血清作1:50、1:100、1:200、1:400稀释后每孔100 μl与不同稀释度的抗原组成方阵,同时每个抗原设定空白对照,于37 ℃反应1 h。洗板,每孔加入1:5000的二抗(Goat Anti-Human IgG HRP)于37 ℃反应50 min。洗板控干,每孔加200 μl TMB底物溶液于37 ℃避光反应15 min,每孔加入100 μl 2 mol/L硫酸终止反应。设定空白孔调零,用波长为450 nm的酶标仪测定各孔的A值,A值最大孔所对应的抗原稀释度和血清稀释度即为该抗原的最佳抗原包被浓度和对应的血清稀释度。
1.4.4 评估单种抗原的免疫原性采用上述各抗原对应的最佳抗原包被浓度和血清稀释度,分别对95份健康人血清和95份结核病患者血清进行检测,得到各抗原测定190份血清的A值。运用MedCalc 15.10软件分析各单种抗原测定190份血清的A值,绘制ROC曲线,可得到相应的约登指数、cut-off值、敏感性、特异性。利用该cut-off值判断95份阴性血清和95份阳性血请,设置A值≥该抗原的cut-off值为阳性,A值<该抗原的cut-off值为阴性,综合计算出各单种抗原的诊断效率。
1.4.5 重复性试验对190份血清进行重复性试验,验证此方法的重复性和稳定性。
1.4.6 不同抗原组合的检测性能评价根据单种抗原的ELISA检测结果,结合各抗原的敏感性和特异性,采用约登指数评价得出最佳的抗原组合方式。
2 结果 2.1 Rv2654c、Rv1985c、eccA1基因的扩增和重组质粒的构建以结核分枝杆菌全基因组DNA为模板,特异性结合各抗原上下游引物扩增得到目的基因的DNA产物,经琼脂糖凝胶电泳后可见246 bp、912 bp、1722 bp处有明显条带,与目的基因Rv2654c、Rv1985c、eccA1大小相符(图 1)。
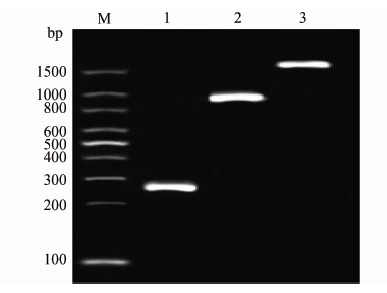
|
| 注:M:100 bp ladder DNA Marker;1:Rv2654c; 2:Rv1985c;3:Rv3868。 图1 Rv2654c、Rv1985c和Rv3868基因PCR结果 Figure 1 Results of PCR amplification of Rv2654c, Rv1985c and Rv3868 |
用限制性内切酶EcoRⅠ和HindⅢ分别对目的基因和pET-32a进行双酶切,然后用T4 DNA连接酶连接构建pET32a-Rv2654c、pET32a-Rv1985c和pET32a-eccA1重组质粒。转化并接种于含LB固体琼脂平皿,过夜培养后选取孤立的单克隆菌落进行摇菌扩增,并提取质粒送擎科生物技术有限公司进行测序鉴定。测序结果与NCBI基因库中的标准序列进行BLAST比对,结果完全一致。
2.3 目的蛋白的表达和纯化将成功构建的重组质粒导入BL21(DE3)中,使用IPTG诱导小量表达3 h,然后对菌体进行破碎并用SDS-PAGE验证,结果显示各目的蛋白正确表达。相同的方法对各目的蛋白进行大量的诱导表达,离心收集菌体后超声破碎,对分别收集的蛋白上清和沉淀进行SDS-PAGE验证,结果显示3种蛋白均存在可溶性表达。对收集的超声后各蛋白上清液采用镍离子亲和层析的方式进行纯化,见图 2。
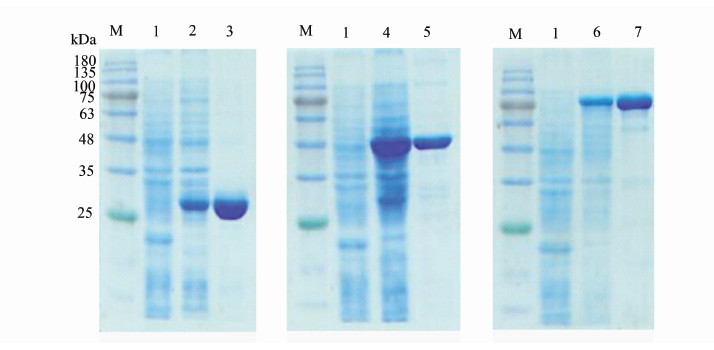
|
| 注:M:蛋白分子质量Marker; 1:转化质粒pET32a的BL21(DE3)诱导后全蛋白裂解物; 2:重组蛋白Rv2654c纯化前全蛋白裂解物; 3:重组蛋白Rv2654c纯化后条带; 4:重组蛋白Rv1985c纯化前全蛋白裂解物; 5:重组蛋白Rv1985c纯化后条带; 6:重组蛋白Rv3868纯化前全蛋白裂解物; 7:重组蛋白Rv3868纯化后条带。 图2 重组蛋白Rv2654c、Rv1985c和Rv3868克隆表达和纯化结果 Figure 2 Results of cloning expression and purification of recombinant proteins Rv2654c, Rv1985c and Rv3868 |
使用BCA蛋白质定量试剂盒测定各蛋白的浓度,蛋白Rv2654c、Rv1985c和Rv3868的浓度分别为1.64 mg/ml、1.04 mg/ml和1.23 mg/ml。综合棋盘滴定结果,可以确定Rv2654c、Rv1985c和Rv3868的最佳包被浓度分别为1.03 μg/ml、 2.60 μg/ml和1.54 μg/ml,而最佳的血清稀释度分别为1:100、1:100和1:50。使用各抗原ELISA反应最佳条件,对95份健康人血清和95份结核病患者血清进行检测。利用MedCalc软件分析得到Rv2654c、Rv1985c、Rv3868蛋白的ROC曲线(图 3),曲线下面积(rea under the curve,AUC)最大的是Rv2654c,为0.79,Rv1985c和Rv3868分别为0.60和0.66。各抗原的AUC、敏感性、特异性、cut-off值和诊断效能,见表 2。通过对190份血清的重复性试验,得到Rv2654c的敏感性为69.47%,特异性为77.89%,AUC为0.78;Rv1985c的敏感性和特异性分别为77.89%和43.16%,其AUC为0.63;Rv3868的敏感性为54.74%,特异性为88.42%,AUC为0.67。3种抗原的检测结果与第一次基本一致,表明该实验的稳定性和重复性较好。

|
| 图3 3种抗原的血清IgG抗体ELISA检测结果的ROC曲线比较 Figure 3 Comparison of ROC curves of ELISA detections of IgG against three antigens |
| 抗原 | AUC | 敏感性 (%) | 特异性 (%) | 约登 指数 | cut- off值 | 诊断效能 (%) |
| Rv2654c | 0.79 | 72.63 | 75.79 | 0.484 | 0.104 | 73.16 |
| Rv1985c | 0.60 | 75.79 | 42.11 | 0.179 | 0.144 | 56.84 |
| Rv3868 | 0.66 | 53.68 | 89.47 | 0.432 | 0.065 | 71.05 |
根据单种抗原ELISA的检测结果,计算出不同抗原组合的敏感性和特异性,综合各组合敏感性和特异性考虑,Rv2654c+Rv3868的组合方式约登指数最高,为0.516,是4种抗原组合方式中的最佳方案。其检测的敏感性达到78.95%,特异性达到72.63%,诊断效能达到了75.79%,见表 3。
| 抗原组合 | 敏感性 (%) | 特异性 (%) | 诊断效能 (%) | 约登 指数 |
| Rv2654c+Rv1985c | 82.11 | 36.84 | 59.47 | 0.189 |
| Rv2654c+Rv3868 | 78.95 | 72.63 | 75.79 | 0.516 |
| Rv1985c+Rv3868 | 77.89 | 37.89 | 57.89 | 0.158 |
| Rv2654c+Rv1985c+Rv3868 | 84.21 | 33.68 | 58.95 | 0.179 |
在全球传染病所致死亡中,结核病是仅次于艾滋病的第二大死因,2014年有150万人死于结核病。据世界卫生组织估计,2014年有960万人罹患结核病,其中37%(约360万)的病例未被确诊或上报[6],可见对结核病的诊断,尤其是快速诊断仍存在困难。目前临床上最常用的结核病辅助诊断方法仍是结核菌素试验(PPD)。结核菌素是一种粗糙的、成分仍未明确多种抗原混合物,其中一些成分在牛型分枝杆菌、环境分枝杆菌、BCG等菌株中同样存在,因此对接种BCG疫苗的人群试验常表现为假阳性[5]。血清学诊断是辅助诊断结核病感染的重要方法,近年来许多研究表明,结核分枝杆菌的特异性蛋白具有结核病快速诊断抗原的潜力[7, 8, 9]。血清学诊断的理论基础是抗原、抗体反应,但是由于个体和菌量的差异,结核病患者血清中的抗体水平往往不相同,导致血清学检测的结果存在误差[10]。现多数血清学商品检测试剂盒不能解决这一问题,往往会出现错误诊断。首先基于血清学诊断快速、廉价的特点,适合对公共卫生领域中大批量人群进行检测、筛查;其次,临床检测人员无统一、规范的操作,对血清学诊断的结果也有一定影响[11]。随着对各种结核分枝杆菌特异性蛋白的深入研究、具有血清学诊断潜力的特异性抗原不断出现。
本研究中探索的3种结核分枝杆菌特异性抗原,其中Rv2654c即TB7.7,是RD11区编码的抗毒素蛋白,是高度特异的结核分枝杆菌抗原[12],其研究多集中在T细胞表位的领域[13]。根据文献报道,使用TB7.7与ESAT-6、CFP10联合诊断,可以有效地提高酶联免疫斑点试验(Enzyme Linked Immunospot assay,ELISPOT)的灵敏度[14];Rv1985c由RD2区编码,被推测是HTH型转录调控因子[15],作为RD2区编码蛋白的代表,MPT64和CFP21作为免疫显性抗原已被用于制备新型保护性疫苗和特异性诊断试剂[16, 17]。有研究证明使用Rv1985c联合ESAT-6和CFP10诊断,可以显著提高ELISPOT诊断的敏感性[18],可见Rv1985c在早期诊断结核病方面具有很大的潜力;Rv3868基因所编码的蛋白即eccA1,eccA1属于ESX-1分泌系统蛋白,编码该分泌系统的基因位于BCG菌株缺失的RD1区上。关于eccA1蛋白结构和功能的研究已有报道[19, 20, 21],多数研究者认为它对于ESX-1系统分泌多种蛋白具有重要的调节作用,同时对结核分枝杆菌正确合成分枝杆菌酸、构成完整细胞壁也是必不可少的[21]。本研究基于eccA1蛋白的重要性,通过表位预测的方法得到eccA1分别含有多个T、B表位,表明其可能具有很强的免疫原性。本研究将焦点集中在探索这3种特异性抗原的血清学诊断的意义,成功构建了pET32a-Rv2654c、pET32a-Rv1985c和pET32a-Rv3868重组质粒,并转化入大肠埃希菌实现了稳定表达。利用镍离子亲和层析的纯化方式得到了纯度较高的目的蛋白,根据棋盘滴定确定了各抗原最佳的ELISA反应条件,按照该条件分别对95份健康人血清和95份结核病患者血清进行检测,从结果可以看出Rv2654c具有较好的诊断效能,其敏感性(72.63%)和特异性(75.79%)均较好;Rv3868虽然敏感性不高,但具有较高的特异性,达到89.47%;Rv1985c的诊断效能一般,但是检测的敏感性达到75.79%,仍具有一定的诊断价值。由于单一抗原刺激机体只能产生特定抗体,因此使用单一抗原进行血清学检测的诊断效能并不是十分理想,如果将不同抗原进行组合,理论上各抗原之间可能形成互补,从而提高血清学的诊断效能。通过ROC曲线确定各抗原的cut-off值,将3种抗原设定为不同组合进行评价,综合敏感性和特异性计算得到最优的抗原组合方案。本实验中得到的最佳抗原组合Rv2654c+Rv3868具有78.95%的敏感性,相比单种抗原有了一定提升,诊断效能和约登指数分别达到了75.79%和0.516,表明该抗原组合具有良好的诊断效果。不足之处是诊断的特异性为72.63%,不是十分理想,表明前期对抗原的纯化仍不完善,下一步工作的重点是结合多种纯化方法提高抗原纯度,从而提升诊断的特异性。
| [1] | Daniel TM. The history of tuberculosis [J]. Respiratory Medicine,2006,100(11):1862-1870. |
| [2] | Alcaide F, Galí N, Domínguez J, et al. Usefulness of a new mycobacteriophage-based technique for rapid diagnosis of pulmonary tuberculosis [J]. Journal of Clinical Microbiology,2003,41(7):2867-2871. |
| [3] | Gennaro ML. Immunologic diagnosis of tuberculosis [J]. Clinical Infectious Diseases an Official Publication of the Infectious Diseases Society of America,2000,30 Suppl 3(6):S243. |
| [4] | Yang YR, Wang QL, Wu XQ, et al. Serodiagnostic value of twelve antigens from M.tuberculosis for tuberculosis[J]. Chinese Journal of Antituberculosis,2011,33(8):486-491. (in Chinese) 阳幼荣,王全立,吴雪琼,等. 结核分枝杆菌12种抗原在结核病血清学诊断中应用价值的研究 [J]. 中国防痨杂志,2011,33(8):486-491. |
| [5] | Britton WJ, Palendira U. Improving vaccines against tuberculosis [J]. Immunology and Cell Biology,2003,81(1):34-45. |
| [6] | Alimuddin Z, Andrew G, Virendra S, et al. The WHO 2014 Global tuberculosis report-further to go [J]. Lancet Global Health,2015,3(1):e10-e2. |
| [7] | Xia Z, Zhonglan S, Xiangrong Z, et al. Generation of Mycobacterium tuberculosis-specific recombinant antigens and evaluation of the clinical value of antibody detection for serological diagnosis of pulmonary tuberculosis [J]. International Journal of Molecular Medicine,2013,31(3):751-757. |
| [8] | Sumi S, Madhavilatha GK, Mundayoor S, et al. Assessment of four recombinant mycobacterial antigens as serodiagnostic markers for pulmonary tuberculosis [J]. Journal of Clinical Medicine Research,2010,1(1):35-40. |
| [9] | Wu X, Yang Y, Zhang J, et al. Humoral immune responses against the Mycobacterium tuberculosis 38-kilodalton, MTB48, and CFP-10/ESAT-6 antigens in tuberculosis [J]. Clinical & Vaccine Immunology,2010,17(3):372-375. |
| [10] | Ivanyi J, Bothamley GH, Jackett PS. Immunodiagnostic assays for tuberculosis and leprosy [J]. British Medical Bulletin, 1988, 44(3):635-649. |
| [11] | Juraj I. Serodiagnosis of tuberculosis: Due to shift track [J]. Tuberculosis,2011,92(1):31-37. |
| [12] | Claus A, Inger B, Anja O, et al. Mapping immune reactivity toward Rv2653 and Rv2654: two novel low-molecular-mass antigens found specifically in the Mycobacterium tuberculosis complex [J]. Journal of Infectious Diseases,2004,189(5):812-819. |
| [13] | Luo W, Qu Z, Xie Y, et al. Identification of a novel immunodominant antigen Rv2645 from RD13 with potential as a cell-mediated immunity-based TB diagnostic agent [J]. Journal of Infection,2015,7(15):534-543. |
| [14] | Jes D, Claus A, Robert L, et al. Exchanging ESAT6 with TB10.4 in an Ag85B fusion molecule-based tuberculosis subunit vaccine: efficient protection and ESAT6-based sensitive monitoring of vaccine efficacy [J]. Journal of Immunology,2005,174(10):6332-6339. |
| [15] | Blokpoel MOTR, Mj. S, Hd. W. Development and application of unstable GFP variants to kinetic studies of mycobacterial gene expression [J]. Journal of Microbiological Methods,2003,54(2):203-11. |
| [16] | Roche PW, Winter N, Triccas JA, et al. Expression of Mycobacterium tuberculosis MPT64 in recombinant Myco. smegmatis: purification, immunogenicity and application to skin tests for tuberculosis [J]. Clinical & Experimental Immunology, 1996, 103(2):226-232. |
| [17] | Chun W, Zhenhua C, Ruiling F, et al. A DNA vaccine expressing CFP21 and MPT64 fusion protein enhances BCG-induced protective immunity against Mycobacterium tuberculosis infection in mice [J]. Medical Microbiology & Immunology,2011,200(3):165-175. |
| [18] | Wang S, Chen J, Zhang Y, et al. Mycobacterium tuberculosis region of difference (RD) 2 antigen Rv1985c and RD11 antigen Rv3425 have the promising potential to distinguish patients with active tuberculosis from M. bovis BCG-vaccinated individuals [J]. Clinical & Vaccine Immunology Cvi,2013,20(1):69-76. |
| [19] | Wagner JM, Evans TJ, Korotkov KV. Crystal structure of the N-terminal domain of EccA1 ATPase from the ESX-1 secretion system of Mycobacterium tuberculosis [J]. Proteins Structure Function & Bioinformatics,2014,82(1):159-163. |
| [20] | Luthra A, Gaur A, Ramachandran R. Rv3868 (EccA1), an essential component of the Mycobacterium tuberculosis ESX-1 secretion system, is thermostable [J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics,2013,1834(6):1181-1186. |
| [21] | Amit L, Anjum M, Ashish A, et al. Characterization of Rv3868, an essential hypothetical protein of the ESX-1 secretion system in Mycobacterium tuberculosis [J]. Journal of Biological Chemistry,2008,283(52):36532-36541. |
 2016, Vol. 31
2016, Vol. 31


