扩展功能
文章信息
- 杨晓东, 陈利娜, 马月, 董小平, 石琦
- YANG Xiao-dong, CHEN Li-na, MA Yue, DONG Xiao-ping, SHI Qi
- 动力相关蛋白Drp1在羊瘙痒因子139A感染小鼠脑组织中变化的研究
- Alteration of dynamin-related protein 1(Drp1) in brain tissue from scrapie-139A infected mice
- 疾病监测, 2016, 31(5): 374-379
- Disease Surveillance, 2016, 31(5): 374-379
- 10.3784/j.issn.1003-9961.2016.05.007
-
文章历史
- 收稿日期:2016-02-25
朊病毒病(prion diseases)又称传播性海绵状脑病 (TSEs),是一类致死性神经退行性疾病,包括人的克雅氏病 (CJD)、库鲁病 (Kuru)、家族型致死性失眠症 (FFI)、牛海绵状脑病(BSE)以及羊瘙痒病 (Scrapie) 等。朊病毒病的发病机制为正常构象的朊蛋白 (PrPC)发生错误折叠,产生具有蛋白酶抗性的异常朊蛋白 (PrPSc),丧失正常功能并在中枢神经系统中沉积导致神经元死亡,病理特征为中枢神经系统出现海绵样变、神经元丢失和神经胶质细胞增生等,异常朊蛋白在中枢神经系统中积累并最终导致神经元细胞死亡[1]。研究显示在prion感染早期即出现了线粒体功能损伤,可能与疾病早期神经元损伤临床症状的出现和进展密切相关[2]。
研究发现线粒体存在持续的转运、分裂、融合和自噬的动态过程[3]。线粒体分裂融合主要受分裂融合蛋白的调节。线粒体分裂主要由Drp1及其上游蛋白Fis1、MFF、MiD49/MiD51等调节。正常情况下Drp1大部分分布于胞浆内,线粒体分裂时,Drp1被募集到线粒体分裂处,在分裂点周围形成环状螺旋,水解GTP释放能量,微管环收缩而切断线粒体。线粒体的分裂融合等动力学改变可影响线粒体的形态、长度、大小、分布,线粒体过度分裂可能导致线粒体碎片化,进而影响线粒体呼吸功能[4],多种神经退行性疾病中都发现了线粒体分裂融合的异常[5-8]。
蛋白质翻译后修饰对其发挥生物活性有着重要的意义。研究显示在多种神经退行性疾病中都存在蛋白巯基亚硝基化的改变[9-11]。最近研究发现Drp1蛋白存在多种翻译后修饰形式,如磷酸化、泛素化、亚泛素化、亚硝基化等[12-16]。有研究表明在阿尔茨海默症(AD)中,Drp1的总含量下降,但亚硝基化Drp1含量显著上升[17]。目前,Drp1亚硝基化与prion疾病的神经元损伤相关及其机制尚不清楚。本研究拟通过检测Drp1在羊瘙痒因子感染小鼠脑组织中的含量、分布及亚硝基化水平的变化,初步探究Drp1在朊病毒病发病中的作用及其机制。
1 材料与方法 1.1 实验材料实验小鼠购自实验动物中心;139A接种毒株来自中国疾病预防控制中心(CDC)病毒病预防控制所(病毒病所)朊病毒室保存;Drp1兔源多克隆抗体购自Santa Cruz公司;β-actin鼠源单克隆抗体购自美国Subrray Biotechnology公司;辣根过氧化物酶标记的羊抗兔,羊抗鼠二抗均购自美国Thermo公司;Alexa Fluor® 568 goat anti-mouse IgG,Alexa Fluor® 488 goat anti-mouse IgG荧光二抗购自美国Invitrogen公司;ECL Kit购自美国Perkin-Elmer公司;亚硝基化检测试剂盒购自美国Cayman科技有限公司;Dynabeads® M-280 Streptavidin购自美国 Invitrogen公司;Bradford蛋白浓度测定试剂盒购自碧云天生物技术研究所。
1.2 脑组织匀浆的制备分别取正常小鼠脑组织和感染羊瘙痒因子139A不同时间点(Ctrl、90 d、 120 d、150 d、180 d)的小鼠脑组织(中国CDC病毒病所朊病毒病室保存),按照100 mg/ml比例加入裂解液(100 mmol/L NaCl,10 mmol/L EDTA,0.5% Nonidet P-40,0.5% sodiam deoxycholate,10 mmol/L Tris-HCl,pH 7.5),匀浆器研磨制成匀浆液,2000 r/min离心,取上清。
1.3 亚硝基化蛋白提取根据本实验室最近报道的S-亚硝基化蛋白纯化方法[18],分别取适量正常和羊瘙痒因子139A感染终末期(180 d)小鼠脑组织匀浆,利用亚硝基化蛋白检测试剂盒将亚硝基化蛋白生物素化标记,然后用加入链霉亲和素磁珠孵育,孵育后的磁珠加入0.5%SDS洗脱液中洗脱。洗脱液加入4倍体积预冷丙酮,置于-20 ℃冰箱2 h,10 000 r/min离心30 min,取等于原体积的蛋白缓冲液重悬沉淀。
1.4 蛋白免疫印迹检测取10 μl脑组织匀浆加入5×Loading Buffer,100 ℃煮沸10 min,10% SDS-PAGE电泳,半干式电转至NC膜,室温下5%BSA/TBST封闭1 h,在55 kD处将膜剪开,分别加入Drp1一抗(1∶1000),β-actin一抗(1∶5000),4 ℃孵育过夜。TBST洗15 min×3,根据一抗来源加入HRP标记的二抗抗体 (1∶5000),室温孵育2 h,TBST洗15 min×3。ECL显色,X光胶片曝光。
1.5 石蜡切片制备三级生物安全柜中,取正常和139A感染小鼠脑组织样本,10%福尔马林浸泡12 h,96%甲酸浸泡2 h,自来水冲洗2 h除去残留,转入10%福尔马林中固定12 h,自来水冲洗6 h,浸入PBS。依次放入75%乙醇(15~30 min),85%乙醇(1 h),95%乙醇Ⅰ(1 h),95%乙醇Ⅱ(1 h),100%乙醇Ⅰ (1 h),100%乙醇Ⅱ (1 h),二甲苯Ⅰ (15 min),二甲苯Ⅱ(15 min),石蜡Ⅰ (1 h),石蜡Ⅱ (1 h),包埋至石蜡凝固。厚度为5 μm连续切片,于37 ℃的水面展开,粘到载玻片上。自然晾干,置于55 ℃烘箱中48 h,待完全干燥后保存备用。
1.6 组织免疫荧光分析将制备的正常和139A小鼠脑切片脱蜡至水;PBS洗3 min;室温下复合酶消化1 min,PBS洗3 min,把切片浸入0.01 mol/L柠檬酸钠修复液中,微波中高火修复30 min,复温30~60 min;0.3% Triton-X100 室温通透20 min;正常山羊血清封闭20 min;滴加一抗,4 ℃过夜;第2天37 ℃复温15 min;PBS洗 5 min×3;滴加荧光二抗,37 ℃孵育1 h,DAPI染色30 min;防荧光猝灭封片剂封片。荧光显微镜下观察。
1.7 数据处理及统计学分析实验重复3次以上,使用 Image J 软件扫描条带灰度,采用GraphPad Prism 6.0软件统计分析并做图,数据以平均值±标准差(x±s)表示,组间差异采用t检验分析,P<0.05为差异有统计学意义。
2 结果 2.1 Drp1在羊瘙痒因子139A感染小鼠脑组织中的含量为探究Drp1在羊瘙痒因子感染小鼠脑组织中的变化规律,利用Western Blot方法,以C57正常小鼠脑组织为对照,β-actin为内参,检测139A感染终末期小鼠脑组织中Drp1含量变化,见图 1。脑组织匀浆上样量均为10 μl,在70~100 kD之间检测到2条Drp1特异性条带(为Drp1的2种同型异构体)。对Western Blots结果进行相对灰度扫描,计算Drp1条带灰度值与其对应的β-actin灰度值的比值(Relative intensity)并进行统计学分析,结果显示139A感染终末期小鼠与C57正常小鼠脑组织相比Drp1含量呈下降趋势,差异有统计学意义(Ctrl:1.47±0.32; 139A:0.88±0.07,P=0.045)。
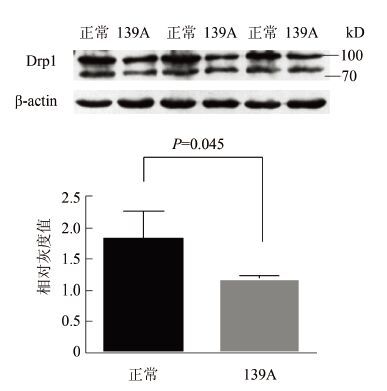
|
| 图 1 Western Blot检测 Drp1在正常/羊瘙痒因子139A感染终末期小鼠脑组织中的含量 Figure 1 Western Blot analysis of Drp1 expression in brains of control/scrapie-139A infected mice at terminal stage |
| |
对感染不同时间点小鼠脑组织中Drp1含量动态分析,见图 2。显示Drp1含量呈降低趋势(Relative intensity:Ctrl:1.24±0.10;90 d:1.15±0.13,P=0.39;120 d:0.95±0.19,P=0.07;150 d:0.64±0.33,P=0.04;180 d:0.82±0.17,P=0.02)。Drp1含量在90 d开始有降低趋势,120 d已有明显降低,在150 d时间点含量达到最低,差异有统计学意义,在终末期稍有回升,但总量仍低于正常对照。
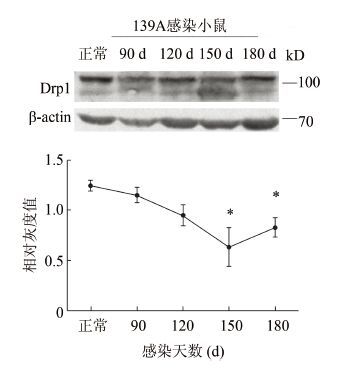
|
| 图 2 Western Blot检测 Drp1在羊瘙痒因子139A感染不同时期小鼠脑组织中的含量动态变化 Figure 2 Western Blot analysis of Drp1 expression in brains of scrapie-139A infected mice at different stages |
| |
Drp1蛋白存在多种翻译后修饰形式,为探究该蛋白巯基亚硝基化水平在羊瘙痒因子感染小鼠脑组织中是否有变化,采用生物素标记法,提取正常和139A感染小鼠脑组织匀浆(已经过蛋白定量)中的亚硝基化蛋白,并检测其中亚硝基化Drp1(SNO-Drp1)含量的变化。实验结果显示较C57正常小鼠脑组织,139A小鼠脑组织中SNO-Drp1的含量明显升高。结果进行相对灰度扫描,对Drp1条带灰度值进行统计学分析。结果显示139A感染小鼠脑组织中SNO-Drp1含量升高,见图 3,分析结果差异具有统计学意义(P=0.009)。
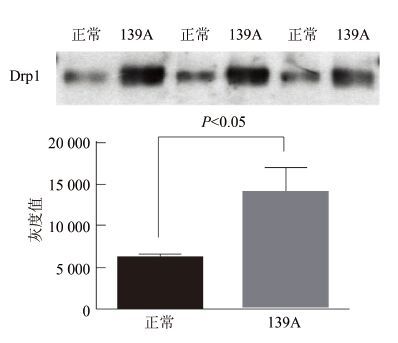
|
| 图 3 Western Blot检测亚硝基化Drp1在正常羊瘙痒因子139A感染终末期小鼠脑组织中的含量 Figure 3 Western Blot analysis of S-nitrosylated Drp1 in brains of Control/scrapie-139A infected mice at terminal stage |
| |
在神经元细胞Drp1是调控线粒体分裂的重要蛋白,中枢神经系统内存在不同种类细胞,代谢状态各异,线粒体分裂融合的速度也不尽相同。为检测Drp1在中枢神经系统内不同细胞的表达情况,利用组织免疫荧光方法检测Drp1在C57正常小鼠,羊瘙痒因子139A感染小鼠脑组织中的分布情况。结果显示在C57正常小鼠,139A小鼠脑组织中Drp1阳性信号均与神经元细胞标记物NeuN阳性细胞存在共定位,而与星形胶质细胞标记物GFAP阳性细胞无共定位情况,见图 4。提示Drp1在中枢神经系统中主要分布在神经元细胞。

|
| 图 4 组织免疫荧光正常小鼠/Scrapie-139A感染终末期小鼠脑组织中Drp1的分布 Figure 4 Immunofluorescence assay results of distribution of Drp1 in control/scrapie-139A infected mouse brain tissue |
| |
朊病毒病是一类神经退行性疾病,其发病机制为朊蛋白异常折叠和沉积,导致神经元细胞不可逆的损伤和丢失。神经元细胞由于其功能活跃,代谢旺盛,对有氧呼吸供能的需求量大,因此对于能量代谢障碍尤为敏感。线粒体作为神经元细胞主要的能量来源,其形态和功能的异常直接影响神经元细胞的能量代谢。生理状态下,线粒体处于不断的分裂与融合的动态过程中,研究显示线粒体分裂与融合与线粒体的运动、能量转运及线粒体损伤修复有关[19]。在多种神经退行性疾病中都发现了能量代谢障碍和线粒体动力学平衡的紊乱。
本研究中组织免疫荧光结果提示Drp1主要分布在神经元细胞中,其分布与神经元细胞的结构功能特点有关。在能量代谢活跃的神经元细胞中线粒体分裂融合更为频繁,线粒体动力学相关蛋白的表达量也相对较大。神经元细胞具有较长的轴突结构延伸至外周,线粒体持续的分裂融合有助于线粒体运动到轴突末端,保证长距离的能量供应[20],保障突触的发育和可塑性。Drp1在细胞内主要分布于胞浆,在线粒体分裂时被募集到线粒体,促进线粒体的分裂。Drp1作为调控线粒体分裂的重要蛋白,其含量和分布的改变以及翻译后修饰的水平都可能影响其活性,进而影响线粒体的动态。氧化应激等病理状态下,Drp1活性增强,线粒体过度分裂导致碎片化。
本研究中Western Blot结果显示,139A感染终末期小鼠与C57正常小鼠脑组织相比,Drp1总量略有下降,而在感染不同时间点的动态分析结果显示Drp1含量呈降低趋势,但在终末期有所回升,总量仍低于正常对照。由于在疾病的进展中,神经元细胞发生凋亡而数量减少;此外,由于线粒体自噬障碍,引发线粒体碎片化和细胞内堆积,产生负反馈而降低Drp1的表达量。Drp1在终末期有所回升,可能与神经元细胞内环境的改变和凋亡的进展有关,此时线粒体分裂融合平衡已经出现紊乱。然而Drp1的表达量并不能完全反映Drp1的活性和线粒体分裂的活跃程度,Drp1蛋白存在多种翻译后修饰形式,其中一种重要的方式为蛋白巯基亚硝基化。许多蛋白亚硝基化修饰都被报道与神经退行性疾病相关,有文献报道Drp1的644位半胱氨酸亚硝基化可以增强其GTP酶活性,促进线粒体片段化以及凋亡的发生[21]。Cho等[22]对AD患者的脑组织以及外周血淋巴细胞中Drp1的表达量及亚硝基化水平进行检测,结果显示AD患者脑组织中Drp1含量下降,亚硝基化水平增高。本研究中139A感染终末期小鼠脑组织中Drp1亚硝基化水平明显增高,提示Drp1的亚硝基化修饰可能与朊病毒病密切相关。
在朊病毒病中,Drp1蛋白亚硝基化可能是疾病发病中的一个重要环节。然而在朊病毒病中Drp1在神经元细胞中表达量和分布改变,在疾病进展各阶段的动态变化情况,以及Drp1与其他蛋白间的相互作用等问题还有待研究。
| [1] | Prusiner SB. Prions[J]. Proc Natl Acad Sci USA, 1998, 95 (23) : 13363–13383 . |
| [2] | Chang CR, Blackstone C. Dynamic regulation of mitochondrial fission through modification of the dynamin-related protein Drp1[J]. Ann New York Acad Sci, 2010 : 34–39 . |
| [3] | Bereiter-Hahn J, Vöth M. Dynamics of mitochondria in living cells: shape changes, dislocations, fusion, and fission of mitochondria[J]. Microsc Res Tech, 1994, 27 (3) : 198–219 . |
| [4] | Wang XL, Su B, Fujioka H, et al. Dynamin-like protein 1 reduction underlies mitochondrial morphology and distribution abnormalities in fibroblasts from sporadic Alzheimer's disease patients[J]. Am J Pathol, 2008, 173 (2) : 470–482 . |
| [5] | Manczak M, Calkins MJ, Reddy PH. Impaired mitochondrial dynamics and abnormal interaction of amyloid beta with mitochondrial protein Drp1 in neurons from patients with Alzheimer's disease: implications for neuronal damage[J]. Hum Mol Genet, 2011, 20 (13) : 2495–2509 . |
| [6] | Deng HS, Dodson MW, Huang HX, et al. The Parkinson's disease genes pink1 and parkin promote mitochondrial fission and/or inhibit fusion in Drosophila[J]. Proc Natl Acad Sci USA, 2008, 105 (38) : 14503–14508 . |
| [7] | Grünewald A, Gegg ME, Taanman JW, et al. Differential effects of PINKl nonsense and missense mutations on mitochondrial function and morphology[J]. Exp Neurol, 2009, 219 (1) : 266–273 . |
| [8] | Reddy PH, Tripathi R, Troung Q, et al. Abnormal mitochondrial dynamics and synaptic degeneration as early events in Alzheimer's disease: implications to mitochondria-targeted antioxidant therapeutics[J]. Biochim Biophys Acta, 2012, 1822 (5) : 639–649 . |
| [9] | Qu J, Nakamura T, Cao G, et al. S-Nitrosylation activates Cdk5 and contributes to synaptic spine loss induced by β-amyloid peptide[J]. Proc Natl Acad Sci USA, 2011, 108 (34) : 14330–14335 . |
| [10] | Uehara T, Nakamura T, Yao D, et al. S-nitrosylated protein-disulphideisomerase links protein misfolding to neurodegeneration[J]. Nature, 2006, 441 (7092) : 513–517 . |
| [11] | Nakamura T, Wang L, Wong CCL, et al. Transnitrosylation of XIAP regulates caspase-dependent neuronal cell death[J]. Mol Cell, 2010, 39 (2) : 184–195 . |
| [12] | Zhang P, Yu PC, Tsang AH, et al. S-nitrosylation of cyclin-dependent kinase 5 (cdk5) regulates its kinase activity and dendrite growth during neuronal development[J]. J Neurosci, 2010, 30 (43) : 14366–14370 . |
| [13] | Qu J, Nakamura T, Holland EA, et al. S-nitrosylation of Cdk5: potential implications in amyloid-β-related neurotoxicity in Alzheimer disease[J]. Prion, 2011, 6 (4) : 364–370 . |
| [14] | Nakamura T, Cieplak P, Cho DH, et al. S-Nitrosylation of Drp1 links excessive mitochondrial fission to neuronal injury in neurodegeneration[J]. Mitochondrion, 2010, 10 (5) : 573–578 . |
| [15] | Chou CH, Lin CC, Yang MC, et al. GSK3 beta-mediated Drp1 phosphorylation induced elongated mitochondrial morphology against oxidative stress[J]. PLoS One, 2012, 7 (11) : e49112. |
| [16] | Figueroa-Romero C, Iiguez-Lluhí JA, Stadler J, et al. SUMO ylation of the mitochondrial fission protein Drp1 occurs at multiple nonconsensus sites within the B domain and is linked to its activity cycle[J]. FASEB J, 2009, 23 (11) : 3917–3927 . |
| [17] | Cho DH, Nakamura T, Fang JG, et al. S-Nitrosylation of Drp1 mediates β-Amyloid: related mitochondrial fission and neuronal injury[J]. Science, 2009, 324 (5923) : 102–105 . |
| [18] | Chen LN, Shi Q, Zhang BY, et al. Proteomic analyses for the global S-Nitrosylated proteins in the brain tissues of different human prion diseases[J]. Mol Neurobiol, 2015, 14 (4) : 854–869 . |
| [19] | Twig G, Elorza A, Molina AJA, et al. Fission and selective fusion govern mitochondrial segregation and elimination by autophagy[J]. EMBO J, 2008, 27 (2) : 433–446 . |
| [20] | Baloh RH, Schmidt RE, Pestronk A, et al. Altered axonal mitochondrial transport in the pathogenesis of Charcot-Marie-Tooth disease from mitofusin 2 mutations[J]. J Neurosci, 2007, 27 (2) : 422–430 . |
| [21] | Choi HS, Choi YG, Shin HY, et al. Dysfunction of mitochondrial dynamics in the brains of scrapie-infected mice[J]. Biochem Biophys Res Commun, 2014, 448 (2) : 157–162 . |
| [22] | Cho B, Choi SY, Cho HM, et al. Physiological and pathological significance of dynamin-related protein 1 (drp1)-dependent mitochondrial fission in the nervous system[J]. Exp Neurobiol, 2013, 22 (3) : 149–157 . |
 2016, Vol. 31
2016, Vol. 31


