扩展功能
文章信息
- 郑雅匀, 戴晓懿, 金东, 孙晖, 熊衍文, 罗雪莲
- ZHENG Ya-yun, DAI Xiao-yi, JIN Dong, SUN Hui, XIONG Yan-wen, LUO Xue-lian
- 一株发热伴血小板减少综合征布尼亚病毒的分离鉴定及其生长特性研究
- Study of isolation and identification of severe fever with thrombocytopenia syndrome bunyavirus and its growth characteristics
- 疾病监测, 2016, 31(8): 707-710
- Disease Surveillance, 2016, 31(8): 707-710
- 10.3784/j.issn.1003-9961.2016.08.020
-
文章历史
- 收稿日期:2015-12-25
2. 感染性疾病诊治协同创新中心, 浙江 杭州 310003
2. Collaborative Innovation Center for Diagnosis and Treatment of Infectious Diseases, Hangzhou 310003, China
2009-2010年,我国淮阳山地区出现多名以不明原因发热、血小板减少、白细胞减少为主要表现的感染性疾病病例。经病原学和血清学研究发现该病毒为布尼亚病毒科白蛉病毒属的新成员,后被命名为发热伴血小板减少综合征布尼亚病毒(severe fever with thrombocytopenia syndrome bunyavirus, SFTSV)[1-2]。据统计,2010年9月至2011年3月,我国湖北、河南、安徽、山东、江苏、辽宁等多个省出现SFTSV感染暴发,确诊病例约171例,死亡36例[1-2]。SFTSV严重危害人类的健康和生命安全。传染病预防控制国家重点实验室接收武汉市某医院的1例疑似SFTSV感染病例抗凝血标本1份,在排除无形体感染后,对患者抗凝血标本进行病原体分离鉴定,确定为SFTSV感染。同时对分离的SFTSV在不同细胞中的生长特性进行研究。
1 材料与方法 1.1 细胞和主要试剂Vero E6(非洲绿猴肾细胞)购于中国医学科学院协和基础研究所。Hep-2(人喉癌上皮细胞)、Hep G2(人肝癌细胞)、THP-1(人单核细胞)、HT29(人结肠癌细胞)均由本实验室保存并提供。1640培养基、DMEM培养基、胰蛋白酶、胎牛血清均购自美国Gibco公司。PMA分化剂购自上海生物工程有限公司。用于核酸提取的QIAamp Virus Spin kit 购于QIAGEN公司。反转录-聚合酶链反应(RT-PCR)检测引物F: CTC AGC CTT TCA GCC TAA TCC; R: CCA TGA GAC ATC CCT ATT ACC由北京擎科生物有限公司合成。FITC标记的羊抗人IgG购自北京中衫金桥生物技术有限公司。病毒荧光定量检测试剂盒QuantiTect®Virus + ROX Viral Kit (Cat. No. 211033) 购于QIGEN公司。荧光定量PCR的引物和探针由上海基康生物有限公司合成,序列为:NSs-F:ACC TCT TTG ACC CTG AGT TWG ACA;NSs-R:CTG AAG GAG ACA GGT GGA GAT GA;探针序列:HEX-TGC CTT GAC GAT CTT A-MGB。
1.2 细胞培养所有细胞培养均按照常规方法进行。其中Vero E6、Hep-2、Hep G2细胞用含10%FBS的DMEM培养基培养,THP-1、HT29用含10%FBS的1640培养基培养。THP-1细胞在使用前需用PMA分化48 h。细胞培养条件均为37 ℃,5%CO2。
1.3 病毒分离采用Vero E6细胞分离。将200 μl 来自武汉某医院抗凝血标本接种于长成单层细胞的T25细胞培养瓶中,37 ℃吸附1 h,然后吸出标本液、加含有2%胎牛血清的细胞维持液,置37 ℃ CO2培养箱培养。每天观察细胞病变,连续观察10 d。若不出现致细胞病变效应(cytopathic effect, CPE),则盲传3代[3]。
1.4 免疫荧光染色将培养成单层的 Vero E6 细胞用 PBS洗2次,然后接种病毒悬液,置 37 ℃ 孵箱中吸附 1 h,加入2%胎牛血清的细胞维持液,置37 ℃ CO2培养箱继续培养,48 h后用胰酶消化细胞后滴片。将滴好的玻片放37 ℃ CO2 孵箱中继续培养8 h后取出玻片,用 PBS 中漂洗,除去未贴壁的悬浮细胞,晾干,放入冷丙酮内-20 ℃ 固定20 min,晾干。将患者血清标本 1∶4梯度稀释后滴加到细胞抗原片上置 37 ℃湿盒中作用 45 min。 PBS 振荡洗3 次,晾干,然后加羊抗人 FITC 标记IgG荧光抗体,置 37 ℃ 湿盒中作用 45 min,PBS冲洗,晾干,在荧光显微镜下观察结果。
1.5 电镜观察病毒粒子用大量Vero E6 细胞培养病毒后,收集上清。超速离心100 000×g,30 min,将沉淀用PBS悬浮后,取1~2 滴样品,滴加至铜网上,1 min后用滤纸沿铜网边缘吸干;再在样品上滴加1~2 滴磷钨酸钠染色液,1 min后用滤纸沿铜网边缘吸干。将制备好的负染色样品,在透射电子显微镜下观测、记录和拍照。
1.6 病毒滴度的测定 1.6.1 定量标准品的制备提取SFTSV毒株WWG的RNA,以NSs-F 和NSs-R为引物,经RT-PCR扩增出目的基因NSs 124 bp。 PCR产物经切胶纯化后,连接到pMD20T载体中,转化至JM109感受态细胞,经蓝白斑筛选、PCR验证,得到阳性克隆子,提取质粒,即为定量标准品。
1.6.2 标准曲线的制备首先测定质粒浓度为 45 ng/μl,根据质粒的分子量将质粒样品浓度换算为拷贝数浓度:拷贝数浓度(copy/ml)= (质量/分子量)× 6.02 × 1023,质粒的分子量660 ×(2692+124)= 1 858 560,其中660是每个碱基的平均分子量,2692为pMD20T载体的碱基数。通过计算得出拷贝数的浓度为1.45 × 1013copy/ml。将质粒10×比稀释后,使浓度达到1.45 × 109 ~ 1.45 × 102进行荧光定量PCR,设3个平行样品。
1.6.3 病毒载量计算本研究使用的病毒载量单位为拷贝(copy)/ml。将待测病毒液200 μl提取RNA后溶解至50 μl无菌水中。取2 μl用于荧光定量PCR的模板,根据标准曲线得出病毒拷贝数。因此,实际病毒载量(copy/ml)= 病毒拷贝数×103/2。
1.7 病毒在不同细胞中的复制效率用于病毒复制效率研究的细胞系为Vero E6、Hep G2、Hep-2、HT29、THP-1。提前一天将细胞铺板,密度为2×105/孔。将病毒接种于细胞,吸附1 h后,弃液,换上2%FBS的新鲜维持液。感染后4、12、24、48和72 h分别取细胞上清,利用荧光定量PCR进行病毒定量检测,绘制不同细胞,不同时间的病毒载量图。每种细胞,每个时间点分别设3个重复,实验重复3次。
2 结果 2.1 病原体分离培养患者抗凝血标本接种Vero E6细胞10 d后,细胞未出现CPE。盲传3代后,收集上清,特异性的RT-PCR检测细胞上清液和裂解液均呈阳性,见图 1,提示病毒可能成功分离。将病毒扩大培养,收集大量细胞培养上清,-80 ℃保存。
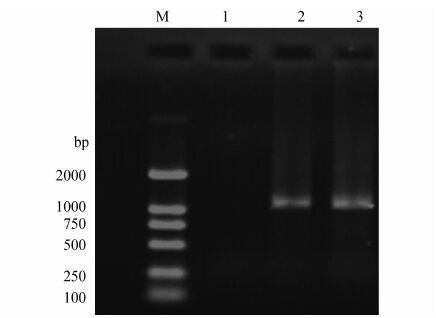
|
| 图 1 RT-PCR检测培养细胞中的SFTSV Figure 1 Detection of SFTSV in cell supernatant and cell lysate by RT-PCR |
| |
将分离的病毒感染Vero E6细胞,制备感染细胞的抗原片,用免疫荧光检测患者血清中是否存在抗分离病毒的抗体。结果表明患者血清标本中存在抗分离的病毒的抗体,而健康人血清为阴性 ,见图 2。
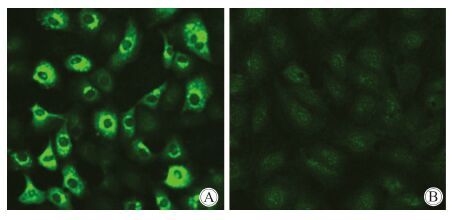
|
| 图 2 患者血清与分离病毒的间接免疫荧光分析 Figure 2 Analysis on patient serum reacting with isolated virus by indirect immunofluorescence assay |
| |
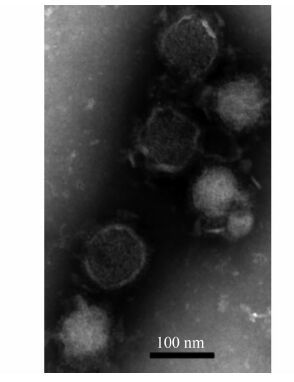
含病毒液的Vero E6细胞上清经负染后可见病毒样颗粒,呈圆形,直径在80~110 nm之间,有包膜,外周有纤突,见图 3。
|
| 图 3 病毒接种后Vero E6细胞培养液中的病毒颗粒 Figure 3 Viral particles in supernatant of Vero E6 cells after infection |
| |
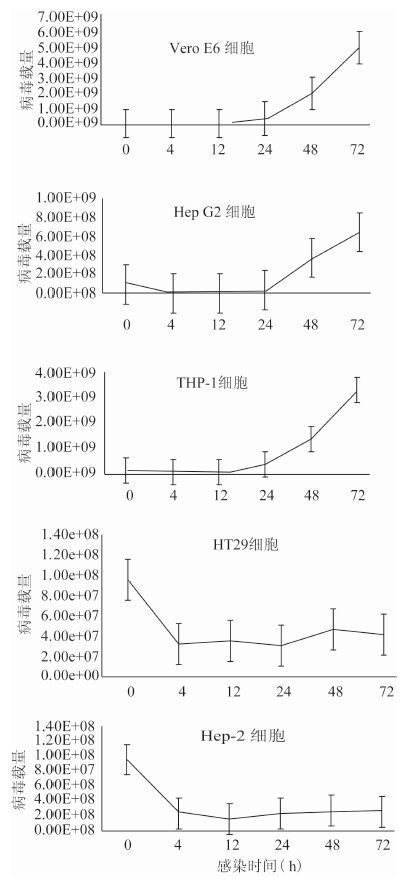
病毒接种的初始量均为1×108 copy/ml,分别感染Vero E6、Hep G2、Hep-2、HT29以及THP-1细胞。检测感染后不同时间点病毒载量的变化。结果发现病毒能够感染Vero E6、Hep G2以及THP-1细胞并有效复制。感染细胞上清中病毒载量随着感染时间的延长而增加。其中Vero E6细胞最敏感,在接种病毒72 h后,病毒载量可达4.89×109 copy/ml。但是病毒不能感染Hep-2和HT29细胞,见图 4。
|
| 图 4 SFTSV感染不同细胞的生长曲线 Figure 4 Growth curves of novel bunyavirus in different cell lines |
| |
SFTSV是一种新发现的布尼亚病毒。由于有限的病毒分离株,SFTSV的生物学特性尚不清楚。分离培养是病原体鉴定的“金标准”,也是生物学特性研究的重要前提。本研究利用Vero E6细胞系从疑似发热伴血小板减少综合征病例抗凝血标本中成功分离出1株SFTSV,提示Vero E6对SFTSV非常敏感,适合用于布尼亚病毒的分离。可能由于Vero E6细胞自身不能表达Ⅰ型干扰素,无法激活自身的先天免疫,从而有利于病毒的增殖。用分离的SFTSV作为抗原,采用免疫荧光检测疑似发热伴血小板减少综合征患者的血清发现,患者血清对所分离的SFTSV抗体呈阳性,而健康人血清中无法检测出相应的抗体(图 2),提示存在SFTSV感染。进一步对病毒的形态学进行观察,在电镜下发现布尼亚病毒样颗粒,证明SFTSV是该病例的病原体(图 3)。
据报道,SFTSV能感染Vero、293T、COS-7等细胞[4-5]。该文对分离的SFTSV进行了细胞嗜性研究。研究发现SFTSV能感染Vero E6、Hep G2以及THP-1细胞,而不能感染HT29和Hep-2细胞。其中Vero E6对SFTSV最敏感,感染24 h后,病毒载量呈指数上升,在72 h后,达到4.89×109 copy/ml,验证了病毒在缺失干扰素系统的细胞中能高效复制的推测。THP-1细胞属于免疫细胞,也是SFTSV的靶细胞。研究表明,SFTSV在THP-1细胞中的复制效率高于Hep G2细胞。有报道指出SFTSV对Vero细胞产生明显的CPE[6]。而本研究中分离的SFTSV感染Vero E6细胞,未见明显的CPE。而且将带病毒的Vero E6细胞继续传代至P7,仍无明显的CPE(图未展示)。Vero E6细胞是Vero细胞的克隆株,两者在形态上有稍微差别,但对病毒的敏感性可能存在很大差异。SFTSV毒株的不同可能会导致CPE的不同。
SFTSV是一种新发现经蜱传播的布尼亚病毒[7-9]。感染后可引起人发热、血小板减少、白细胞减少等症状。重症患者可因多脏器损伤而死亡。SFTSV严重危害人类健康和生命安全。本研究从1例疑似发热伴血小板减少综合征病例中成功分离出1株SFTSV,并通过血清学和形态学方法确诊了SFTSV感染病例。同时,通过该病毒的细胞易感性研究,初步揭示SFTSV的生长特性。这些结果将为后续SFTSV的相关基础研究提供必要的材料以及重要的线索。
| [1] | Zhang YZ, Zhou DJ, Xiong YW, et al. Hemorrhagic fever caused by a novel tick-borne Bunyavirus in Huaiyangshan,China[J]. Chin J Epidemiol , 2011, 32 (3) : 209–220. |
| [2] | Yu XJ, Liang MF, Zhang SY, et al. Fever with thrombocytopenia associated with a novel bunyavirus in China[J]. N Engl J Med , 2011, 364 (16) : 1523–1532. DOI:10.1056/NEJMoa1010095 |
| [3] | Drosten C, Günther S, Preiser W, et al. Identification of a novel coronavirus in patients with severe acute respiratory syndrome[J]. N Engl J Med , 2003, 348 (20) : 1967–1976. DOI:10.1056/NEJMoa030747 |
| [4] | Liu Y, Yao WQ, Geng YZ, et al. Cultivating characteristics and biological characteristics of the new virus of Bunyaviridae isolated from the patient serum in Liaoning province[J]. Chinese Journal of Zoonoses , 2012, 28 (3) : 237–240. (in Chinese) 刘芸, 姚文清, 耿英芝, 等. 辽宁省首次发现的新布尼亚病毒其培养特性的研究[J]. 中国人兽共患病学报 , 2012, 28 (3) : 237–240. |
| [5] | He CC, Li AQ, Liu L, et al. The susceptibility of culture cells to severe fever with thrombocytopenia syndrome virus[J]. Chinese Journal of Experimental and Clinical Virology , 2014, 28 (1) : 10–13. (in Chinese) 何程程, 李阿茜, 刘林, 等. 发热伴血小板减少综合征布尼亚病毒细胞嗜性研究[J]. 中华实验和临床病毒学杂志 , 2014, 28 (1) : 10–13. |
| [6] | Zhang YG, Xie QX, Sun Y, et al. Isolation of novel bunyavirus using vero cell[J]. Anhui Journal of Prevent Medicine , 2012, 18 (4) : 249–251. (in Chinese) 张永根, 谢琴秀, 孙永, 等. 应用Vero细胞分离新型布尼亚病毒[J]. 安徽预防医学杂志 , 2012, 18 (4) : 249–251. |
| [7] | Sun YL, Jin C, Zhan FX, et al. Host cytokine storm is associated with disease severity of severe fever with thrombocytopenia syndrome[J]. J Infect Dis , 2012, 206 (7) : 1085–1094. DOI:10.1093/infdis/jis452 |
| [8] | Zhang YZ, Zhou DJ, Qin XC, et al. The ecology,genetic diversity,and phylogeny of Huaiyangshan virus in China[J]. J Virol , 2012, 86 (5) : 2864–2868. DOI:10.1128/JVI.06192-11 |
| [9] | Chen XP, Cong ML, Li MH, et al. Infection and pathogenesis of Huaiyangshan virus (a novel tick-borne bunyavirus) in laboratory rodents[J]. J Gen Virol , 2012, 93 (6) : 1288–1293. |
 2016, Vol. 31
2016, Vol. 31


