扩展功能
文章信息
- 张颖, 甄若楠, 谢华萍, 陈纯, 耿进妹, 刘静雯, 狄飚, 王鸣
- ZHANG Ying, ZHEN Ruo-nan, XIE Hua-ping, CHEN Chun, GENG Jin-mei, LIU Jing-wen, DI Biao, WANG Ming
- 2010-2015年广州地区手足口病Cox A6, Cox A4和Cox A10的病原监测和流行分析
- Surveillance for hand foot and mouth disease pathogens Cox A6, Cox A4 and Cox A10 in Guangzhou
- 疾病监测, 2016, 31(10): 817-823
- Disease Surveillance, 2016, 31(10): 817-823
- 10.3784/j.issn.1003-9961.2016.10.006
-
文章历史
- 收稿日期:2016-04-29
手足口病(hand foot and mouth disease,HFMD)自1981年开始在我国陆续发生,是能够导致手、足、口疱疹,发热和神经系统受累等多种临床症状甚至死亡的一种儿童常见传染病[1]。柯萨奇病毒A16型(coxsackievirus A16,Cox A16)与人肠道病毒71型(human enterovirus 71,EV71)一直被认为是HFMD的主要病原体。从近年国内外HFMD病原谱的变化趋势来看,EV71和Cox A16并非是一成不变地引起HFMD的优势病毒株,其他型别的肠道病毒有可能在与环境适应过程中共流行或演变成为优势流行株[2]。本研究对2010-2015年广州市的HFMD病例标本进行检测和资料分析,并对Cox A6、Cox A4和Cox A10阳性病例的VP1基因进行了测序分析,并与国内外毒株进行同源比对和系统进化分析。
1 材料与方法 1.1 标本来源2010年1月至2015年6月期间采集广州市疾病预防控制中心从各监测医院接收到的HFMD病例的临床标本,标本类型包括咽拭子、粪便和肛拭子等,共计12 054份。样本采集根据《手足口病预防控制指南(2009版)》要求进行。
1.2 核酸提取使用天根RNA核酸提取试剂盒,按说明书进行操作。提取的RNA溶于50 μl RNase free ddH2O,-80 ℃保存。
1.3 实时荧光反转录-聚合酶链反应(RT-PCR)检测采用肠道病毒Cox A16型/EV71型/肠道病毒通用型核酸三重实时荧光PCR检测试剂盒(江苏硕世生物科技公司)对样品RNA进行检测。选择肠道病毒通用型阳性、EV71和Cox A16核酸阴性的样本,采用Cox A6、Cox A4及Cox A10核酸检测单通道荧光PCR试剂盒(江苏硕世生物科技公司)检测核酸。该试剂盒的灵敏度使用CCID50标定法为2.0×10-2CCID50/0.1 ml,敏感性为1×103~5×103copies/ml,特异性为检测目标与感染部位相同,或感染症状相似且与常见的其他病毒无交叉反应。反应液配置和PCR程序按说明书进行。使用美国ABI公司7500 Real-time PCR System扩增,荧光检测通道为FAM,VIC和ROX,扩增曲线为典型“S”形且Ct值≤35.0判断为阳性标本。
1.4 病毒VP1区RT-PCR扩增对荧光检测Cox A6、Cox A4和Cox A10阳性的样本进行巢式RT-PCR,扩增肠道病毒部分VP1基因片段。具体扩增引物及RT-PCR反应程序参见文献[3]。
1.5 病毒分子分型的同源性和系统进化分析扩增产物送至上海英潍捷基公司,以测序引物AN232及AN233进行双向测序。测序结果采用DNAStar 5.0软件中的Seqman程序进行拼接。采用Mega 6.0软件进行比对和构建进化树,用Kimura双校正模型和邻接法(neighbor-joining,NJ),建树的可靠性通过1000 bootstrap值评估。
1.6 统计学分析采用EpiData 3.1软件建立数据库,核查无误后录入SPSS 18.0软件进行统计学分析。对肠道病毒阳性率进行描述性分析,采用χ2检验进行不同肠道病毒阳性率差异的比较,P < 0.05为差异有统计学意义。
2 结果 2.1 肠道病毒型别分布12 054份HFMD疑似病例中,共检测到8945份肠道病毒阳性,阳性率74.21%(8945/12 054)。不同肠道病毒型检测结果见表 1。
| 年份 | 采集标本 | 阳性例数 | EV71 (%) |
Cox A16 (%) |
Cox A6 (%) |
Cox A4 (%) |
Cox A10 (%) |
EV71和Cox A16 混合感染(%) |
其他肠道病毒 (%) |
| 2010 | 1 243 | 1173 | 529(45.10) | 227(19.35) | 106(9.00) | 10(0.85) | 27(2.30) | 21(1.79) | 253(21.57) |
| 2011 | 2 049 | 1206 | 363(30.10) | 436(36.15) | 212(17.60) | 4(0.33) | 28(2.30) | 11(0.91) | 152(12.60) |
| 2012 | 2 192 | 1732 | 551(31.81) | 598(34.53) | 402(23.20) | 17(0.98) | 20(1.15) | 51(2.94) | 93(0.54) |
| 2013 | 2 140 | 1630 | 204(12.52) | 221(13.56) | 1040(63.80) | 0(0.00) | 27(1.66) | 1(0.06) | 137(8.40) |
| 2014 | 3 205 | 2371 | 631(26.61) | 1091(46.01) | 158(6.70) | 83(3.50) | 25(1.05) | 44(1.86) | 339(14.30) |
| 2015 | 1 225 | 833 | 180(21.61) | 109(13.09) | 256(30.70) | 30(3.60) | 28(3.36) | 0(0.00) | 230(27.61) |
| 合计 | 12 054 | 8945 | 2458(27.48) | 2682(29.98) | 2174(24.30) | 144(1.61) | 155(1.73) | 128(1.43) | 1204(13.46) |
6年间除了EV71和Cox A16外共检测出3677份其他肠道病毒,主要以Cox A6、Cox A4和Cox A10为主,其阳性率分别为59.12%(2174/3677)、3.92%(144/3677)和4.22%(155/3677)。
2.2 流行特征 2.2.1 性别与年龄分布分析Cox A6、Cox A4和Cox A10阳性患者的性别和年龄,对阳性患者不同年龄段进行χ2检验发现,Cox A6和Cox A10阳性患者在1岁年龄段占的比例最高(分别为30.82%和23.23%),Cox A4阳性患者在3岁年龄段占的比例最高(27.78%),年龄分布差异有统计学意义(χ2=79.84,P<0.01),见表 2。
| 年龄组 (岁) |
Cox A6 | Cox A4 | Cox A10 | |||||||||||
| 阳性 | 构成比(%) | 男性 | 女性 | 阳性 | 构成比(%) | 男性 | 女性 | 阳性 | 构成比(%) | 男性 | 女性 | |||
| 0~ | 185 | 8.51 | 120 | 65 | 9 | 6.25 | 6 | 3 | 13 | 8.39 | 13 | 0 | ||
| 1~ | 670 | 30.82 | 398 | 272 | 30 | 20.83 | 20 | 10 | 36 | 23.23 | 20 | 16 | ||
| 2~ | 466 | 21.44 | 268 | 198 | 25 | 17.36 | 15 | 10 | 20 | 12.90 | 9 | 11 | ||
| 3~ | 364 | 16.74 | 236 | 128 | 40 | 27.78 | 25 | 15 | 35 | 22.58 | 19 | 16 | ||
| 4~ | 197 | 9.06 | 137 | 60 | 31 | 21.53 | 16 | 15 | 28 | 18.06 | 20 | 8 | ||
| 5~ | 63 | 2.90 | 48 | 15 | 7 | 4.86 | 3 | 4 | 12 | 7.74 | 8 | 4 | ||
| 6~ | 222 | 10.21 | 140 | 82 | 2 | 1.30 | 1 | 1 | 10 | 6.45 | 6 | 4 | ||
| ≥18 | 7 | 0.32 | 2 | 5 | 0 | 0.00 | 0 | 0 | 1 | 0.65 | 1 | 0 | ||
| 男女比例 | 1.64 | 1.48 | 1.63 | |||||||||||
| 合计 | 2174 | 1349 | 825 | 144 | 86 | 58 | 155 | 96 | 59 | |||||
对不同病毒阳性的性别比例进行统计学分析,Cox A6、Cox A4和Cox A10阳性患者的男性均多于女性,差异有统计学意义(χ2=0.31,P=0.86)。
2.2.2 时间分布Cox A6阳性病例在7月出现第1个高峰,占病例总数的23.51%(451/1918),第2个高峰发生在9月,占总数的14.39%(276/1918)。Cox A4和Cox A10阳性病例的高峰期均发生在5月,分别占总病例数的40.35%(46/114)和28.35%(36/127)(图 1)。
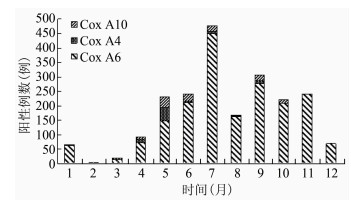
|
| 图 1 2010-2015年肠道病毒Cox A6、Cox A4和Cox A10阳性的月份分布 Figure 1 Monthly distribution of Cox A6、Cox A4 and Cox A10 isolates from 2010-2015 in Guangzhou, China |
| |
根据病例的发病月份、地区以及不同来源,随机选取53份Cox A6阳性病例,23份Cox A4阳性病例以及30份Cox A10阳性病例的VP1序列,对核苷酸和推导的氨基酸序列进行同源性分析。VP1基因序列片段长度为351 bp,编码117个氨基酸。结果显示,53份Cox A6的核苷酸和氨基酸序列具有较高同源性,分别为93.10%~100.00%和96.30%~100.00%,与GenBank中Cox A6的原型株Gdula的同源性分别为82.00%~83.50%和92.70%~95.40%。23份Cox A4的核苷酸和氨基酸序列具有较高同源性,分别为94.12%~99.77%和96.37%~100.00%,与原型株High Point株的同源性分别为83.30%~86.45%和92.86%~94.61%。30份Cox A10核苷酸与氨基酸序列同样具有较高同源性,分别为92.94%~100.00%和95.53%~100.00%,与原型株Kowalik株的同源性分别为72.82%~75.39%和93.65%~95.12%。
2.4 VP1区序列的系统发生学分析为进一步明确Cox A6、Cox A4和Cox A10的遗传进化规律,将53个Cox A6,23个Cox A4和30个Cox A10的VP1区部分核苷酸序列与原型株,以及GenBank上公布国内外毒株的部分序列株构建分子进化树,选用Cox A16原型株G10和EV71原型株BrCr为组外对照。
进化树分析表明,Cox A6可分为A、B、C、D、E、F6个簇,原型株Gdula被划分至F簇,与Lu等[4]和He等[5]对Cox A6的研究一致。广州地区2010-2015年Cox A6毒株均被划分于A簇,亲缘关系最接近的是2011、2012和2013年广东病毒株和2011年上海毒株,位于同一进化分支的还有2011年日本毒株,2010年台湾毒株和2010年法国毒株(图 2)。可见广州市Cox A6流行株和广东省近年的Cox A6流行株属于同一进化分支。
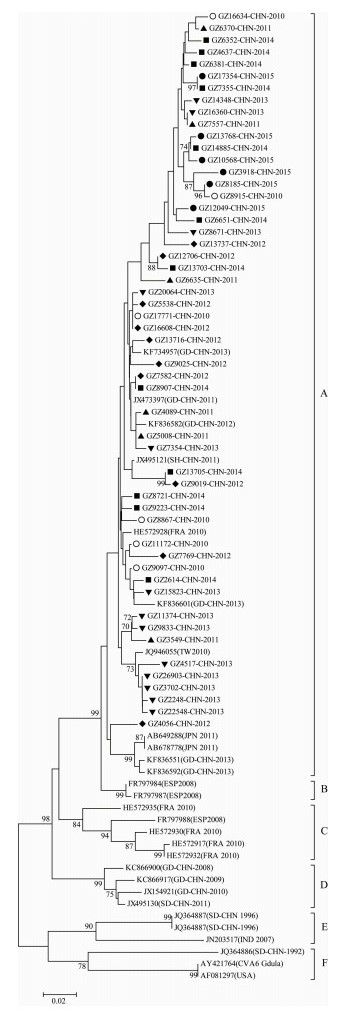
|
| 图 2 2010-2015年广州市肠道病毒Cox A6型VP1部分基因片段进化关系树 Figure 2 Phylogenetic analysis of 53 Guangzhou Cox A6 isolates from 2010-2015 注:●2015年病毒,■2014年病毒,▼ 2013年病毒,◆2012年病毒,▲2011年病毒,○2010年病毒。 |
| |
进化树分析显示,Cox A4可分为3个簇。本研究的23序列均属于C簇,同簇还包括中国大陆株、欧洲亚洲株和原型株High Point。亲缘关系最接近的主要是中国各地的地方株,欧洲亚洲株包括2005年美国、2005年瑞典、2013和2014年俄罗斯及部分亚洲地区2003和2004年日本、2011年印度的Cox A4毒株(图 3),与相关Cox A4的研究结果一致[6-8]。
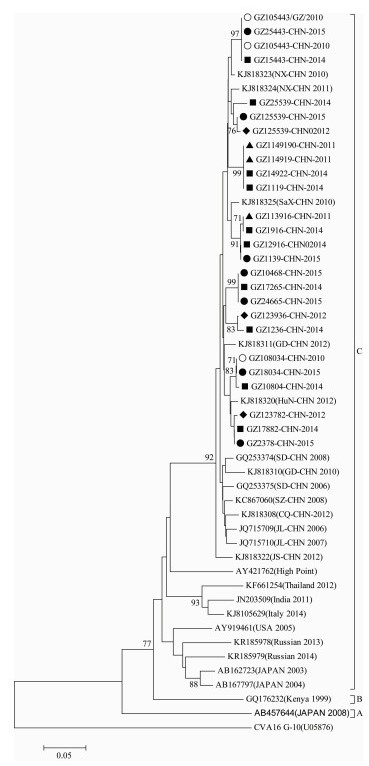
|
| 图 3 广州市肠道病毒Cox A4型VP1部分基因片段进化关系树 Figure 3 Phylogenetic analysis of 23 Guangzhou Cox A4 isolates from 2010-2015 注:●2015年病毒,■2014年病毒,◆2012年病毒,▲2011年病毒,○2010年病毒。 |
| |
进化树分析显示,Cox A10可分为A、B、C 3个簇,原型株Kowalik独立成为C簇,与Hu等[8]对Cox A10的分型结果一致。A簇中的A1亚簇包括本研究的30株Cox A10和中国其他地区毒株,如深圳市、河南省、北京市和台湾地区等。引起2008年芬兰全国性HFMD暴发的优势株与意大利株、俄罗斯等欧洲株则同属B簇(图 4)。
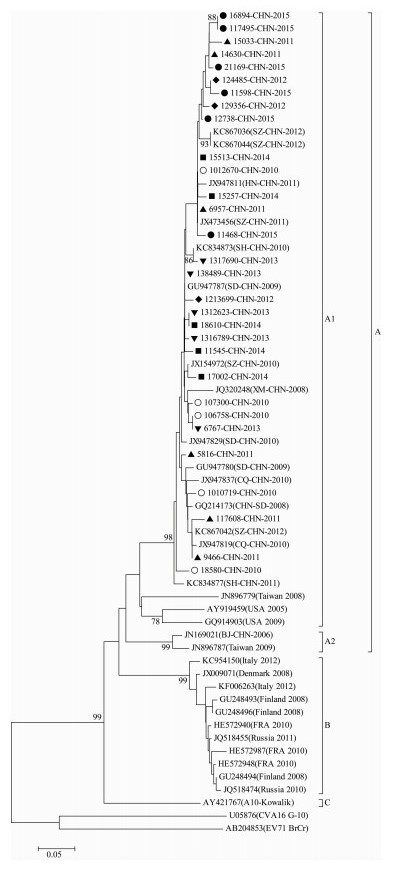
|
| 图 4 广州市肠道病毒Cox A10型VP1部分基因片段进化关系树 Figure 4 Phylogenetic analysis of 30 Guangzhou Cox A10 isolates from 2010-2015 注:●2015年病毒,■2014年病毒,▼ 2013年病毒,◆2012年病毒,▲2011年病毒,○2010年病毒。 |
| |
HFMD是我国日益严重的公共卫生问题,近年来的研究显示,越来越多其他型别的肠道病毒引起HFMD暴发或流行[9-11]。
广州市2010-2015年引起HFMD发病的肠道病毒病原体监测分析表明,2010-2012年间EV71和Cox A16仍占主要地位,且Cox A6呈持续上升趋势,2013年成为主要病原体,构成比为63.80%,EV71和Cox A16的构成比则下降至12.52%和13.56%。2014年,Cox A6的阳性率明显下降至6.70%而Cox A16则上升至46.01%。2015年上半年,Cox A6的阳性率再次上升至30.70%。研究结果显示,广州地区引起HFMD流行的优势病毒株包括EV71、Cox A16和Cox A6 3种肠道病毒,并呈交替或共同流行状态。本研究与广东省、深圳市和长春市近年的HFMD监测结果一致[4-5, 12]。
Cox A4在2010-2012年间的阳性构成比较低且变化较为稳定,甚至在2013年出现了检出率为零的状况,但是在2014年突然上升至3.50%,并在2015年维持为3.60%。Cox A10的阳性构成比略高于Cox A4且在5年间的变化呈小幅度波动,构成比最高出现在2015年(3.36%)。监测结果显示近年Cox A4和Cox A10呈低幅度流行,但将有可能在与环境的适应过程中逐渐演变成为优势流行株。
本研究显示,广州地区HFMD的发病时间集中于4-10月,Cox A6在7月达到高峰,而Cox A4和Cox A10则在5月达到高峰,与国内外其他地区的流行时间基本一致[6, 8, 13]。广州市地处亚热带地区,夏季较长,9月是下学期开学,易感人群集中而增加密切接触的机会,故HFMD的小高峰也出现在9月。也有研究发现2010年的Cox A10在上海地区冬季发生,高峰出现在12月[11],其中差异还需进一步探讨。与EV71和Cox A16导致的HFMD发病规律相同[14-16],Cox A4、Cox A6和Cox A10 3种肠道病毒阳性患者的性别分布均为男性高于女性,但年龄分布差异有统计学意义。Cox A6和Cox A10的易感人群年龄段更小,1~岁年龄组在整体年龄分布中所占比例最大,Cox A4的易感人群年龄段则与EV71和Cox A16一致,3~岁年龄组所占比例最大[17]。提示广州市HFMD的防控工作重点除了托幼机构和学校外,也需重视未入托幼机构的散居幼儿,必须密切关注和加强社区与家庭的健康教育与防控工作的落实。
参照Oberste等[18]对肠道病毒的分型依据,本研究获得的序列经同源性和进化分析表明,广州市Cox A6株与近年国内Cox A6流行株亲缘性较高,位于同一进化分支的还有2010年引起法国全国性HFMD暴发的Cox A6优势株和2011年引起日本HFMD大流行的优势株。分型结果提示,本地Cox A6流行株有可能成为引起我国南方甚至东南亚地区HFMD暴发流行的主要病毒株,
Cox A4在1950年首次出现在美国,1998年发展为肯尼亚株(GQ176232)、亚洲株(GI-A型别)[即2008日本株(AB457644)]和亚洲欧洲株(GⅡ-A型别)3种基因型别[8-9]。本研究的所有毒株与Cox A4原始株High Point位于同一进化分支,推断属于GⅡ-A型别,该亚型还包括中国大陆、日本、印度、中国台湾和部分美国的分离株。研究显示我国广州地区目前的Cox A4流行株也是主要流行株,是由原始株发生了明显的基因变化而快速产生的流行毒株[9]。
广州地区Cox A10与国内其他毒株及美国等地毒株均属于同一簇,与芬兰、俄罗斯等欧洲毒株属于不同簇。目前国内虽未出现Cox A10导致的HFMD暴发,但有研究表明Cox A10可能是除EV71外另一种可单独引起重症HFMD的病原体[13],且Cox A10与Cox A6同样是疱疹性咽峡炎的主要病原体。新加坡研究报道,Cox A10在引起HFMD的病原中与Cox A16和EV71具有同等重要性[19]。
本研究表明,广州地区HFMD病原谱已经发生改变,主要是EV71、Cox A16和Cox A6这3种肠道病毒交替或共同流行。由于肠道病毒种类繁多,且不存在交叉免疫,当一种型别毒株建立的免疫屏障后,另一型别毒株就会上升为主导。当多种病毒在同一地区共同流行,重组和突变而造成的核苷酸变异累积,会导致高致病性的新型肠道病毒出现,进而引起新发传染病的流行。加强对肠道病毒长期系统的监测及深入研究,掌握其生物学特性及分子流行特征,可以为HFMD的监控、预警和防治工作提供科学依据。
作者贡献:张颖:检验除EV71和COX A16外的肠道病毒,VP1基因测序,进化树建立,撰写文章
甄若楠:检验除EV71和COX A16外的肠道病毒,VP1基因测序,进化树建立,修改文章
谢华萍:检验大部分手足口病中的EV71、Cox A17和肠道病毒阳性标本
陈纯:手足口病流行病学资料收集与分析输入
耿进妹:检验部分手足口病中的EV71、Cox A17和肠道病毒阳性标本
刘静雯:检验少部分手足口病中的EV71、Cox A17和肠道病毒阳性标本
狄飚:通讯作者,实验总体指导和质量控制
王鸣:审阅修改文章,资深顾问
| [1] | Zhang Y, Zhu Z, Yang WZ, et al. An emerging recombinant human enterovirus 71 responsible for the 2008 outbreak of hand foot and mouth disease in Fuyang city of China[J]. Virol J , 2010, 7 : 94. DOI:10.1186/1743-422X-7-94 |
| [2] | Zhang Y, Wang M. Hand-foot-mouth disease in China:epidemiology and strategy for the control and prevention[J]. Chinese Journal of Viral Disease , 2013, 3 (2) : 81–84. (in Chinese) 张颖, 王鸣. 有关当前手足口病的流行特征和防控对策的探索[J]. 中国病毒病杂志 , 2013, 3 (2) : 81–84. |
| [3] | Nix WA, Oberste MS, Pallansch MA, et al. Sensitive, seminested PCR amplification of VP1 sequences for direct identification of all enterovirus serotypes from original clinical specimens[J]. J Clin Microbiol , 2006, 44 (8) : 2698–2704. DOI:10.1128/JCM.00542-06 |
| [4] | Lu J, Zeng H, Zheng H, et al. Hand, foot and mouth disease in Guangdong, China, in 2013:new trends in the continuing epidemic[J]. Clin Microbiol Infect , 2014, 20 (7) : O442–O445. DOI:10.1111/1469-0691.12468 |
| [5] | He QY, Chen L, Xu WB, et al. Emergence, circulation, and spatiotemporal phylogenetic analysis of coxsackievirus A6 and coxsackievirus A10-associated hand, foot, and mouth disease infections from 2008 to 2012 in Shenzhen, China[J]. J Clin Microbiol , 2013, 51 (11) : 3560–3566. DOI:10.1128/JCM.01231-13 |
| [6] | Li JS, Dong XG, Qin M, et al. Outbreak of febrile illness caused by coxsackievirus A4 in a nursery school in Beijing, China[J]. Virol J , 2015, 12 : 92. DOI:10.1186/s12985-015-0325-1 |
| [7] | Chu PY, Lu PL, Tsai YL, et al. Spatiotemporal phylogenetic analysis and molecular characterization of coxsackievirus A4[J]. Infect Genet Evol , 2011, 11 (6) : 1426–1435. DOI:10.1016/j.meegid.2011.05.010 |
| [8] | Hu YF, Yang F, Du J, et al. Complete genome analysis of coxsackievirus A2, A4, A5, and A10 strains isolated from hand, foot, and mouth disease patients in China revealing frequent recombination of human enterovirus A[J]. J Clin Microbiol , 2011, 49 (7) : 2426–2434. DOI:10.1128/JCM.00007-11 |
| [9] | Fujimoto T, Iizuka S, Enomoto M, et al. Hand, foot, and mouth disease caused by coxsackievirus A6, Japan, 2011[J]. Emerg Infect Dis , 2012, 18 (2) : 337–339. DOI:10.3201/eid1802.111147 |
| [10] | Mirand A, Henquell C, Archimbaud C, et al. Outbreak of hand, foot and mouth disease/herpangina associated with coxsackievirus A6 and A10 infections in 2010, France:a large citywide, prospective observational study[J]. Clin Microbiol Infect , 2012, 18 (5) : E110–E118. DOI:10.1111/j.1469-0691.2012.03789.x |
| [11] | Zhang XL, Yu HJ, Yu Y, et al. The pathogenic spectrum and molecular epidemiology analysis of 440 hand, foot and mouth disease cases in Shanghai in 2010[J]. Journal of Microbes and Infections , 2011, 6 (4) : 214–224. (in Chinese) 张晓玲, 俞慧菊, 余曜, 等. 2010年上海部分地区440例手足口病病例的病原谱及分子流行病学分析[J]. 微生物与感染 , 2011, 6 (4) : 214–224. |
| [12] | Li JL, Yuan J, Yang F, et al. Epidemic characteristics of hand, foot, and mouth disease in southern China, 2013:coxsackievirus A6 has emerged as the predominant causative agent[J]. J Infect , 2014, 69 (3) : 299–303. DOI:10.1016/j.jinf.2014.04.001 |
| [13] | Lu QB, Zhang XA, Wo Y, et al. Circulation of coxsackievirus A10 and A6 in hand-foot-mouth disease in China, 2009-2011[J]. PLoS One , 2012, 7 (12) : e52073. DOI:10.1371/journal.pone.0052073 |
| [14] | Wang LS, Bi ZQ, Fang YY, et al. Epidemiology analysis of hand, foot and mouth disease in Shandong, 2008[J]. Shandong Medical Journal , 2009, 49 (19) : 45–47. (in Chinese) 王连森, 毕振强, 房玉英, 等. 2008年山东省手足口病流行病学分析[J]. 山东医药 , 2009, 49 (19) : 45–47. |
| [15] | Xie HP, Geng JM, Zhang Y, et al. Genotyping analysis of enterovirus 71 isolated from severe and mild cases of hand-foot-mouth disease in Guangzhou, China[J]. Chinese Journal of Viral Disease , 2013, 3 (2) : 96–101. (in Chinese) 谢华萍, 耿进妹, 张颖, 等. 广州市2011年肠道病毒71型VP1基因特征分析[J]. 中国病毒病杂志 , 2013, 3 (2) : 96–101. |
| [16] | Liang HY, Kang Y, Tao X, et al. Dynamic analysis of the epidemiological characteristics of hand-foot-mouth disease during 2008-2011, Guangzhou[J]. Journal of Tropical Medicine , 2011, 11 (12) : 1410–1413. (in Chinese) 梁会营, 康燕, 陶霞, 等. 广州市2008-2011年手足口病流行特征动态研究[J]. 热带医学杂志 , 2011, 11 (12) : 1410–1413. |
| [17] | Zhang Y, He P, Chen C, et al. Molecular epidemiology characteristics of human enterovirus coxsackievirus A6 in Guangzhou, in 2011[J]. Chinese Journal of Epidemiology , 2014, 35 (1) : 103–104. (in Chinese) 张颖, 和鹏, 陈纯, 等. 广州市2011年柯萨奇病毒A组6型的分子流行病学特征[J]. 中华流行病学杂志 , 2014, 35 (1) : 103–104. |
| [18] | Oberste MS, Maher K, Kilpatrick DR, et al. Molecular evolution of the human enteroviruses:correlation of serotype with VP1 sequence and application to picornavirus classification[J]. J Virol , 1999, 73 (3) : 1941–1948. |
| [19] | Ang LW, Koh BK, Chan KP, et al. Epidemiology and control of hand, foot and mouth disease in Singapore, 2001-2007[J]. Ann Acad Med Singapore , 2009, 38 (2) : 106–112. |
 2016, Vol. 31
2016, Vol. 31


