扩展功能
文章信息
- 梅玲玲, 徐昌平, 杨勇, 占利, 陈鸿鹄, 张云怡, 张俊彦, 陈建才, 程苏云
- MEI Ling-ling, XU Chang-ping, YANG Yong, ZHAN Li, CHEN Hong-hu, ZHANG Yun-yi, ZHANG Jun-yan, CHEN Jian-cai, CHENG Su-yun
- 食品中志贺活菌叠氮溴乙锭实时荧光聚合酶链反应技术研究
- Alive foodborne pathogen Shigella detection by EMA real-time fluorescence PCR
- 疾病监测, 2016, 31(11): 909-914
- Disease Surveillance, 2016, 31(11): 909-914
- 10.3784/j.issn.1003-9961.2016.11.006
-
文章历史
- 收稿日期:2016-05-04
志贺菌可引起细菌性痢疾和食物中毒,全球每年因志贺菌感染的人次估计为1.65亿,可造成110万人死亡,细菌性痢疾的发病率和死亡率均居感染性腹泻之首位[1]。细菌性痢疾是我国传染病防治法中规定报告的乙类传染病,志贺菌是主要食物中毒病原菌之一[2-3]。志贺菌的传染源为患者和带菌者,主要通过食用被志贺菌污染的食品而感染发病。我国多种食品卫生标准中规定不得检出志贺菌。
目前食品中志贺菌的检测主要通过培养法分离、鉴定,整个过程操作繁琐,耗时长,检出率低。实时荧光聚合酶链反应(PCR)方法具有敏感性、特异性高和稳定性强等特点,可很好地弥补上述不足。但由于相当一部分志贺菌在食品加工过程中已经死亡,DNA却能在死菌中保留很长时间,造成传统的实时荧光PCR方法检测结果为阳性,干扰了检测的真实性,使食品中志贺菌实时荧光PCR检测技术的推广应用受到很大的限制。
本文应用叠氮溴乙锭(ethidium monoazide bromide,EMA)能穿过死细菌的细胞膜,在光激活的作用下与基因组DNA共价结合,抑制样品中死菌体的DNA进行PCR扩增的特性[4-5],将EMA与PCR技术结合,建立了EMA实时荧光PCR技术,该技术可快速、准确和特异性地检测食品中的志贺活菌,现将结果报道如下。
1 材料与方法 1.1 材料 1.1.1 实验用菌株痢疾志贺菌(CMCC 51570)、宋内志贺菌(CMCC 51334)、福氏志贺菌(CMCC 51573 )、鸭沙门菌(CMCC 50083)、伤寒沙门菌(CMCC 50079)、鼠伤寒沙门菌(CMCC 50013)、甲型副伤寒沙门菌(CMCC 50002)、副溶血弧菌(ATCC 17802、ATCC 33847)、阪崎肠杆菌(ATCC 51329)、大肠埃希菌(ATCC 25922)、单增李斯特菌(CMCC 54001)和金黄色葡萄球菌(ATCC 25923)等标准菌株均购自中国生物制品检定所和中国微生物菌种保藏中心。17株福氏志贺菌、11株宋内志贺菌、20株沙门菌、25株单增李斯特菌、10株致病性大肠埃希菌、10株阪崎肠杆菌和23株副溶血弧菌由本实验室自食品或患者粪便标本中分离获得。
1.1.2 仪器和试剂7500Fast实时荧光定量PCR仪为美国life technology公司产品。EMA购自美国Biotium公司,PCR反应试剂(DRR039S)购自宝生物工程(大连)有限公司。所有相关培养基均购自英国OXOID公司,经鉴定合格,在有效期内使用。
1.1.3 引物和探针用DNAMan 7.0软件分析比较NCBI网站发布的志贺菌ipaH基因。选择志贺菌ipaH基因保守序列(登录号M32063.1),用Primer Express 3.0软件设计特异性引物和探针。在探针5′端标记报告荧光染料6-Carboxyfluorescein(FAM),3′端标记淬灭荧光染料BHQ1。引物和特异性探针委托美国life technology公司合成。特异性引物和荧光探针序列:上游引物(ipaHF)5′-CAG GCA TCA GAA GGC CTT TT-3′,下游引物(ipaHR)5′-TCG AGG CGG AAC ATT TCC-3′,荧光探针(ipaHpb)5′-FAM-CGG CGC TCT GCT CTC CCT GG-BHQ1-3′。
1.2 方法 1.2.1 志贺菌实时荧光PCR检测方法 1.2.1.1 食品样品取样称取或吸取食品样品10 g,放至盛有90 ml稀释液的无菌均质袋中,用拍击式均质器拍打1~2 min,制成匀液,1000 r/min,离心5 min,取上清,3000 r/min离心10 min,去上清,沉淀加无菌生理盐水1 ml溶解后移至1.5 ml eppendorf管(EP管)。若为菌培养物,则直接吸取1 ml至1.5 ml EP管。
1.2.1.2 DNA核酸提取100 ℃10 min,10 000 r/min离心5 min,吸取上清作为模板DNA,-40 ℃保存备用。
1.2.1.3 反应体系包括2×Premix Ex TaqTM 10 μl,上、下游引物(10 μmol/L)各0.4 μl,探针 (10 μmol/L)0.8 μl,ROX 0.2 μl,模板DNA 为 3.0 μl,用ddH2O补足至20 μl。
1.2.1.4 反应条件预变性95 ℃ 30 s,变性95 ℃ 10 s,退火60 ℃ 40 s,40个循环。在60 ℃处设定荧光检测点。荧光检测模式选择FAM荧光,基线调整取3~15个循环的荧光信号,以阈值线刚好超过正常阴性对照的最高点设定阈值线。
1.2.1.5 结果判断若待测样品荧光增长曲线超过阈值线,并呈良好的对数增长,循环阈值(Ct) 值≤30,判断为阳性。若Ct值>30或无Ct值,则判断为阴性。
1.2.2 志贺菌EMA实时荧光PCR检测方法样品EMA前处理按1.2.1.1方法称取10 g样品,至盛有90 ml稀释液的无菌均质袋中,用拍击式均质器拍打1~2 min,制成匀液,1000 r/min,离心5 min,取上清,3000 r/min,离心10 min,去上清,沉淀加无菌生理盐水1 ml溶解后移至1.5 ml EP管。若为菌培养物,则直接吸取1 ml至 1.5 ml EP管即可。然后按1.2.3实验结果获得的最佳EMA作用浓度和处理次数对样品进行光处理,用生理盐水沉淀3次后用于DNA核酸提取。DNA核酸提取、反应体系、反应条件、结果判断方法同1.2.1。
1.2.3 EMA作用浓度和处理次数优化方法取0.5麦氏浓度的志贺菌(CMCC 51573 )悬液3.0 ml,95 ℃加热10 min彻底杀死细菌后,分别置1.5 ml EP管,每管 200 μl,按EMA终浓度为0、5、10、20和30 μg/ml,光处理(黑暗处放置8 min,650 W卤素灯光照8 min)1次、2次和3次作矩阵配比,进行EMA前处理和实时荧光PCR检测。对同浓度的志贺活菌用同样的方法进行EMA前处理和实时荧光PCR检测。选择同一EMA作用条件死菌、活菌Ct值相差最大,即对死菌抑制效果高,对活菌影响最小的EMA作用条件作为本次实验的最佳EMA作用浓度和处理次数。
1.2.4 对志贺死菌抑制性验证取浓度为7.3×107 CFU/ml、7.3×106 CFU/ml、7.3×105 CFU/ml、7.3×104 CFU/ml经95 ℃加热10 min的志贺死菌(CMCC 51573)各2 ml,分别置1.5 ml EP管,每管 1 ml,离心,沉淀用100 μl TE溶解,其中,1管不作EMA前处理、1管按最佳的EMA作用浓度和处理次数进行EMA前处理。然后将2种处理方法的样品,重复3次,同时开展实时荧光PCR检测,以验证方法对死菌抑制效果。
对死菌DNA抑制效率计算方法:将用EMA实时荧光PCR扩增测得的平均Ct值,代入到未经EMA处理的Ct=39.96-3.168×log(菌量)公式,换算出EMA处理后死菌的DNA扩增浓度。再用1-(EMA处理后死菌的DNA扩增浓度/实际死菌浓度)×100得出死菌DNA抑制效率。
1.2.5 敏感性验证取志贺菌(CMCC 51573)悬液1.0 ml,作10倍梯度稀释成100 ~10-6 7种浓度,各取1 ml,离心,去上清,加100 μl TE溶解沉淀后,按最佳的EMA作用浓度和处理次数进行EMA前处理、实时荧光PCR扩增,以验证方法的敏感性。同步用营养琼脂作平板计数法进行菌落计数结果,100 菌浓度为7.3×107 CFU/ml,各反应管菌量分别为2.2×105 CFU/反应、2.2×104 CFU/反应、2.2×103 CFU/反应、2.2×102CFU/反应、2.2×101 CFU/反应、2.2CFU/反应和0.22 CFU/反应。
1.2.6 特异性验证用3株志贺菌标准株、28株志贺菌分离株以及98株非志贺菌(沙门菌、阪崎肠杆菌、副溶血弧菌、致病性大肠埃希菌、单增李斯特菌、金黄色葡萄球菌等)菌悬液,进行EMA实时荧光PCR扩增,以验证方法的特异性。
1.2.7 稳定性验证对1株志贺菌标准菌株(CMCC 51573)、2株志贺菌分离株、1株沙门菌(CMCC 50013)和1株大肠埃希菌标准株(ATCC 25922)隔天连续重复5次进行EMA实时PCR检测,通过计算反应Ct值变异系数(coefficient of variation,CV)验证方法的稳定性。
1.2.8 模拟样品检测取15份熟肉制品,15份饮料,各称或吸取25 g到225 ml GN增菌液中,其中每类样品有4份添加了活的志贺菌(菌浓度约为10 CFU/ml、102 CFU/ml、103 CFU/ml和104 CFU/ml),4份添加了死的志贺菌(菌浓度约为104 CFU/ml),2份既添加了死的志贺菌(菌浓度约为104 CFU/ml)、又添加了活的志贺菌(菌浓度约为103 CFU/ml),5份样品未添加任何菌,所有样品中添加了大肠埃希菌(菌浓度约为104 CFU/ml)。用GN增菌液增菌 5 h后,各吸取1 ml,按最佳的EMA作用浓度和处理次数进行EMA前处理方法后,进行EMA实时荧光PCR扩增。同步按《食品安全国家标准 食品微生物学检验 志贺氏菌检验》(GB 4789.5-2012)方法进行常规分离培养,以验证2种方法的一致性。
2 结果 2.1 EMA作用浓度和处理次数优化结果将EMA终浓度为0、5、10、20和30 μg/ml,光处理(黑暗处放置8 min,650 W卤素灯光照8 min)1次、2次和3次进行矩阵配比设计死、活菌各15种排列组合,同时进行EMA前处理和实时荧光PCR检测结果,不加EMA的3种死菌组合和3种死菌组合Ct值在同一水平,Ct值在15.06~15.68之间。加EMA的12种死菌组合Ct值在22.07~29.41之间。EMA对志贺菌死菌DNA的抑制能力随着EMA浓度和光处理次数增加不断提升,但EMA浓度的提升效率明显高于光处理次数。进一步根据加EMA的12种活菌组合Ct值在15.34~16.74之间。EMA对志贺菌死菌DNA的抑制能力随着EMA浓度和光处理次数增加不断提升,但EMA浓度的提升效率明显高于光处理次数(表 1)。最终确定EMA终浓度为30 μg/ml,光处理(黑暗处放置8 min,650 W卤素灯光照8 min)1次作为本研究的最佳EMA作用浓度和处理次数。
| 编 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| EMA终浓度 (μg/ml) | 0 | 5 | 10 | 20 | 30 | 0 | 5 | 10 | 20 | 30 | |
| 光处理次数 | 1 | 15.51 | 22.11 | 23.87 | 28.26 | 29.41 | 15.38 | 15.34 | 15.53 | 15.62 | 15.67 |
| 2 | 15.25 | 22.07 | 23.13 | 27.03 | 29.91 | 15.43 | 15.58 | 15.44 | 16.28 | 15.40 | |
| 3 | 15.68 | 22.40 | 23.57 | 26.42 | 28.43 | 15.06 | 15.78 | 16.18 | 15.36 | 16.74 | |
| 注:1~5号加志贺死菌(CMCC 51573); 6~10号加同浓度的志贺活菌(CMCC 51573)。 | |||||||||||
取浓度为7.3×107 CFU/ml、7.3×106 CFU/ml、7.3×105 CFU/ml和7.3×104CFU/ml 4种菌量的志贺菌死菌重复3次同时进行EMA不处理、前处理2种方法的实时荧光PCR扩增结果,未经EMA前处理的4种浓度死菌样品平均Ct值分别为15.23、17.98、21.34和24.69,Ct=39.96-3.168×log(菌量)(R2=0.999)。经EMA处理的4种浓度死菌样品平均Ct值分别为26.36、30.03、34.96和36.33,Ct=54.09-3.484×log(菌浓度)(R2=0.961)。经Ct=39.96-3.168×log(菌量)公式换算后计算,每种浓度的死菌DNA抑制效率≥99.97%。当样品中志贺死菌浓度<105 CFU/ml时,Ct>35,见表 2。
| 菌浓度(CFU/ml) | EMA未处理管(活菌) | EMA处理管(活菌) | EMA处理管(死菌) | 死菌抑制效率(%) | |||||||||
| Ct1 | Ct2 | Ct3 | 平均 | Ct1 | Ct2 | Ct3 | 平均 | Ct1 | Ct2 | Ct3 | 平均 | ||
| 7.3×107 | 15.13 | 15.32 | 15.23 | 15.23 | 15.24 | 15.38 | 15.47 | 15.36 | 26.48 | 26.25 | 26.34 | 26.36 | >99.97 |
| 7.3×106 | 17.91 | 18.05 | 17.98 | 17.98 | 18.32 | 18.15 | 18.29 | 18.25 | 30.12 | 29.89 | 30.08 | 30.03 | >99.98 |
| 7.3×105 | 21.24 | 21.54 | 21.23 | 21.34 | 21.35 | 21.58 | 21.40 | 21.44 | 35.21 | 34.68 | 34.99 | 34.96 | >99.99 |
| 7.3×104 | 24.54 | 24.88 | 24.64 | 24.69 | 24.38 | 24.79 | 24.97 | 24.70 | 36.94 | 35.59 | 36.46 | 36.33 | >99.98 |
分别用浓度为2.2×105 CFU/反应、2.2×104 CFU/反应、2.2×103 CFU/反应、2.2×102CFU/反应、2.2×101 CFU/反应、2.20CFU/反应和0.22 CFU/反应 7种浓度志贺菌菌培养物进行EMA实时荧光PCR扩增结果,Ct值与待检菌浓度对数具有良好线性关系,Ct=32.10-3.19×log(菌量),R2=0.994。方法的最低检测浓度达到2.20 CFU/反应(图 1)。
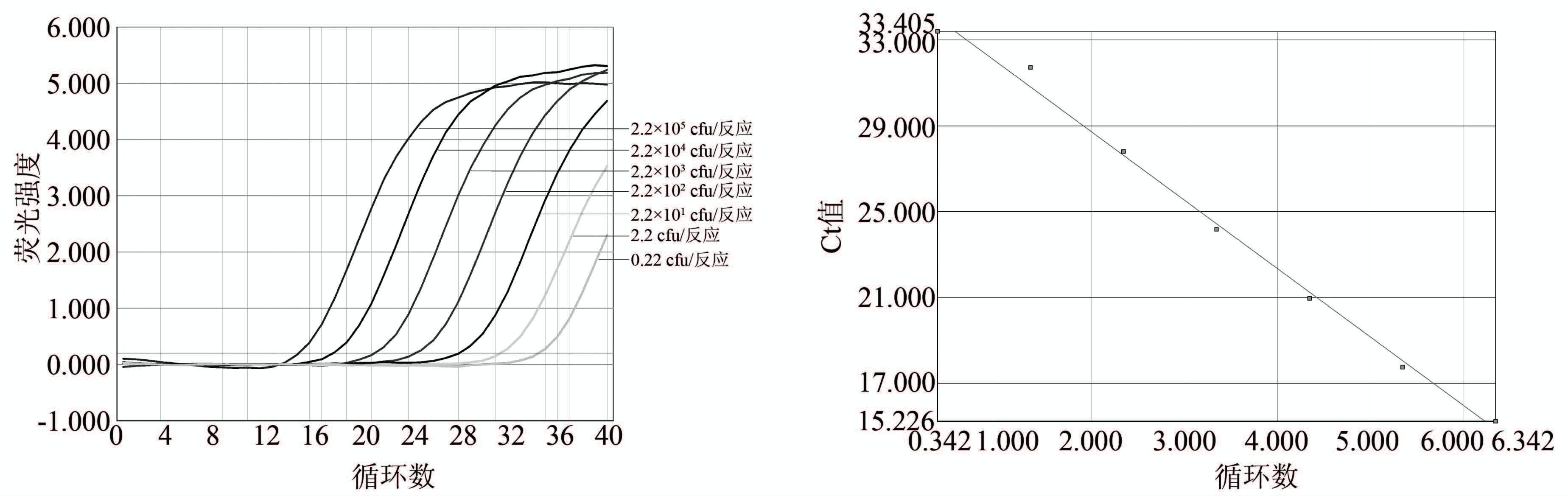
|
| 图 1 志贺菌EMA实时荧光PCR检测技术敏感性检测结果 Figure 1 Sensitivity of EMA real-time fluorescence PCR to detect Shigella |
| |
对3株志贺菌标准株、28株志贺菌分离株以及97株非志贺菌(沙门菌、阪崎肠杆菌、副溶血弧菌、致病性大肠埃希菌、单增李斯特菌和金黄色葡萄球菌等)菌悬液进行EMA实时荧光PCR扩增结果显示,3株志贺菌标准株和28株志贺菌分离株Ct值最低为15.04,最高为26.54,而97株非志贺菌的Ct值均>35或无Ct值(呈一条线)。部分菌株的扩增结果见图 2。

|
| 图 2 部分菌株志贺菌EMA实时荧光PCR检测结果 Figure 2 Detection results of some Shigella strains by EMA real-time fluorescence PCR |
| |
对志贺菌标准菌株(CMCC 51573)、2株志贺菌分离株、1株沙门菌(CMCC 50013)和1株大肠埃希菌标准株(ATCC 25922)隔天连续重复5次进行EMA实时荧光PCR检测,5种细菌均能够正确判定,除2种阴性菌部分结果无Ct值,无法计算CV外,其余3株菌Ct值的CV均<5%,见表 3。
| 样 品 | Ct1 | Ct2 | Ct3 | Ct4 | Ct5 | Ct(M) | s | CV(%) |
| 志贺菌标准菌株(CMCC 51573) | 16.62 | 16.07 | 16.93 | 16.33 | 16.30 | 16.45 | 0.26 | 0.96 |
| 志贺菌分离株(14-Y-1222) | 19.98 | 19.09 | 18.99 | 18.14 | 18.58 | 18.96 | 0.37 | 1.48 |
| 志贺菌分离株(14-Y-1251) | 18.01 | 16.51 | 16.71 | 20.57 | 18.68 | 18.09 | 0.81 | 3.24 |
| 沙门菌 (CMCC 50013) | 35.02 | 36.16 | 35.37 | - | - | - | - | - |
| 大肠埃希菌 (ATCC 25922) | 35.89 | - | - | - | - | - | - | - |
对分别添加志贺菌活菌、死菌或不加任何菌的15份饮料,15份熟肉制品,按最佳的EMA作用浓度和处理次数进行EMA前处理方法后,同时进行EMA实时荧光PCR扩增和常规分离培养结果,4份添加活的志贺菌和2份既添加死的志贺菌又添加活的志贺菌样品,用2种方法检测结果均为阳性,其余样品均为阴性。EMA实时荧光PCR检测结果与常规分离培养方法完全一致,见表 4。
| 编 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 活志贺菌量(CFU/ml) | 10 | 102 | 103 | 104 | 0 | 0 | 0 | 0 | 103 | 103 | 0 | 0 | 0 | 0 | 0 | |
| 死志贺菌量(CFU/ml) | 0 | 0 | 0 | 0 | 104 | 104 | 104 | 104 | 104 | 104 | 0 | 0 | 0 | 0 | 0 | |
| 大肠埃希菌量(CFU/ml) | 104 | 104 | 104 | 104 | 104 | 104 | 104 | 104 | 104 | 104 | 104 | 104 | 104 | 104 | 104 | |
| 饮料检测 | EMA-PCR法 | + | + | + | + | - | - | - | - | + | + | - | - | - | - | - |
| 常规分离法 | + | + | + | + | - | - | - | - | + | + | - | - | - | - | - | |
| 熟肉制品检测 | EMA-PCR法 | + | + | + | + | - | - | - | - | + | + | - | - | - | - | - |
| 常规分离法 | + | + | + | + | - | - | - | - | + | + | - | - | - | - | - | |
| 注:“+”表示阳性或检出;“-”表示阴性或未检出。 | ||||||||||||||||
实时荧光PCR 技术是1996 年由美国Applied Biosystems 公司推出的一种新核酸检测技术,其通过荧光染料或荧光标记的特异性探针,对PCR产物进行标记跟踪,实时在线监控反应过程,该技术的出现,极大地简化了各类检测过程[6],现已广泛应用于禽流感病毒、人类免疫缺陷病毒、霍乱弧菌、沙门菌和志贺菌等病原微生物的诊断领域[7]。然而,以核酸为基础的PCR检测方法,无法有效地区分细胞的死活,也就是说,无论是活细胞,还是死细胞均能扩增出目标基因。对于食品这类样品,在加工过程中,多数病原菌已被杀死,这些死菌或自由状态的DNA已经不会对人体造成危害,却仍然被检测出来,导致假阳性结果和较低的准确性,从而限制了PCR检测方法在食品检测领域的推广使用。EMA作为一种光敏感的DNA染料,能渗透到细胞壁或细胞膜不完整的死细胞体内,并插入DNA共价结合,共价结合的DNA,用PCR 检测方法不能发生扩增。而活细胞具有完整细胞壁、细胞膜,能够阻止EMA 渗透到菌体内与DNA共价结合,其PCR扩增不受影响,从而可有效地检测区分死、活病原细菌[8-9]。从本次建立的EMA实时荧光PCR技术研究结果看,志贺菌EMA实时荧光PCR检测技术Ct值与待检菌对数值具有很好线性关系(R2=0.994)。方法的最低检测浓度达到了2.2 CFU/反应。而对死菌DNA抑制效率≥99.97%,对沙门菌、阪崎肠杆菌、副溶血弧菌、大肠埃希菌、单增李斯特菌和金黄色葡萄球菌等的Ct均>35或无Ct。对5种不同细菌重复检测5次,Ct值CV均<5%,对分别添加了志贺菌活菌、死菌或不加任何菌的15份奶粉,15份熟肉制品,同时进行EMA实时荧光PCR扩增和常规分离培养结果2种方法完全一致。表明志贺菌EMA实时荧光PCR检测技术即具有荧光定量PCR的特异性强,敏感度高,简便、快速的优点,又仅能检测食品中志贺活菌,这对将实时荧光PCR等DNA快速技术在食品领域的推广使用具有深远的作用与意义。
本次实验结果表明,EMA的作用效率首先与光照强度密切相关。用650 W卤素灯光照,需要提前10 min将灯打开预热。照射时要尽量接近光源,但必须避免高温对核酸的破坏,可以通过将装待处理样品的EP管插在冰盒中来解决此问题。其次,EMA的作用效率与EMA浓度密切相关,EMA终浓度在5~30 μg/ml的范围内,EMA对志贺菌死菌DNA的抑制能力随着EMA浓度和光处理次数增加不断提升,但提升效率EMA浓度明显高于光处理次数。最终本研究认为EMA终浓度为30 μg/ml,光处理(黑暗处放置8 min,650 W卤素灯光照8 min) 1次是最佳EMA作用浓度和处理次数,死菌DNA扩增效率<0.01%。
作者贡献:
梅玲玲:负责方案设计、论文撰写,主要实验室研究
徐昌平:负责引物设计
杨勇:负责英文摘要翻译、实验研究
占利、陈鸿鹄、张云怡、张俊彦、陈建才:参与实验研究
程苏云:负责方案、文章审核
| [1] | Kotlof KL, Winickof JP, Ivanof B, et al. Global burden of Shigella infections:implications for vaccine development and implementation of control strategies[J]. Bull World Health Organ , 1999, 77 (8) : 651–666. |
| [2] | Chang ZR, Sun QZ, Pei YX, et al. Surveillance for bacillary dysentery in China,2012[J]. Disease Surveillance , 2014, 29 (7) : 528–532. (in Chinese) 常昭瑞, 孙强正, 裴迎新, 等. 2012年中国大陆地区细菌性痢疾疫情特点与监测结果分析[J]. 疾病监测 , 2014, 29 (7) : 528–532. |
| [3] | Qu M, Liu GR, Zhang X, et al. Distribution of different serotypes and analysis of virulence genes in Shigella species in Beijing from 2004 to 2010[J]. Chinese Journal of Health Laboratory Technology , 2011, 21 (8) : 1850–1853. (in Chinese) 曲梅, 刘桂荣, 张新, 等. 北京市2004-2010年志贺菌菌型分布及毒力基因分析[J]. 中国卫生检验杂志 , 2011, 21 (8) : 1850–1853. |
| [4] | Gu WM, Levin RE. Quantification of iable Plesiomonas shigelloides in a mixture of viable and dead cells using ethidium bromide monoazide and conventional PCR[J]. Food Biotechnol , 2007, 21 (2) : 145–159. DOI:10.1080/08905430701410548 |
| [5] | Lee JM, Levin RE. Use of ethidium bromide monoazide for quantification of viable and dead mixed bacterial flora from fish fillets by polymerase chain reaction[J]. J Microbiol Methods , 2006, 67 (3) : 456–462. DOI:10.1016/j.mimet.2006.04.019 |
| [6] | Heid CA, Stevens J, Livak KJ, et al. Real time quantitative PCR[J]. Genome Res , 1996, 6 (10) : 986–994. DOI:10.1101/gr.6.10.986 |
| [7] | Li HH, Hou XM. Real-time fluorescent quantitative PCR and its application in pathogen detection[J]. Occupation and Health , 2015, 31 (18) : 2586–2589. (in Chinese) 李海红, 侯锡苗. 实时荧光定量PCR技术及其在几类病原体检测中的应用[J]. 职业与健康 , 2015, 31 (18) : 2586–2589. |
| [8] | Feng JJ, Jin ZJ, Liu XL, et al. Differentiation of live and dead cell of bacterial plant pathogen in polymerase chain reaction assays using a DNA binding dye[J]. Chemical Journal of Chinese Universities , 2008, 29 (5) : 944–948. (in Chinese) 冯建军, 金志娟, 刘西莉, 等. 一种DNA染料结合聚合酶链反应检测鉴别植物病原细菌死活细胞[J]. 高等学校化学学报 , 2008, 29 (5) : 944–948. |
| [9] | Zhu RG, Lyu SX, Liu YP, et al. Quantification of pathogenic viable cells of Vibrio parahaemolyticus in seafood by ethidium bromide monoazide staining and real-time polymerase chain reaction[J]. Food Science , 2011, 32 (8) : 219–225. (in Chinese) 祝儒刚, 吕淑霞, 刘月萍, 等. 基于DNA染料EMA的RT-PCR技术定量检测海产品中病原性副溶血弧菌活细胞[J]. 食品科学 , 2011, 32 (8) : 219–225. |
 2016, Vol. 31
2016, Vol. 31


