扩展功能
文章信息
- 谭翰清, 谭海芳, 朱颖梅, 程洁萍, 苏乐斌, 林凤, 邓廷国, 黄强, 黎碧坚
- TAN Han-qing, TAN Hai-fang, ZHU Ying-mei, CHENG Jie-ping, SU Le-bin, LIN Feng, DENG Ting-guo, HUANG Qiang, LI Bi-jian
- 广东省肇庆市2014-2015年登革病毒分子分型及初步溯源研究
- Genotyping and molecular tracing of dengue virus in Zhaoqing, Guangdong, 2014-2015
- 疾病监测, 2016, 31(12): 1012-1017
- Disease Surveillance, 2016, 31(12): 1012-1017
- 10.3784/j.issn.1003-9961.2016.12.009
-
文章历史
- 收稿日期:2016-05-28
登革病毒(dengue virus,DENV)属于黄病毒科(Flaviviridae)黄病毒属(Flavivirus),主要通过埃及伊蚊或白纹伊蚊叮咬传播[1]。近年来,由于全球气候变暖、生态环境改变、人口贸易跨境交往日益频繁等因素,加剧了DENV的扩散,估计有128个国家或地区约3.9亿人口受感染,成为全球关注的公共卫生问题[2]。
多年来,我国持续报告登革热疫情,但仍主要以境外输入引发本地传播的暴发疫情为主,具有偶然性和突发性的特点,是否形成持续性本地疫源地仍需做进一步流行病学调查和实验室分析。2014年,我国广东、福建和云南等地出现大规模DENV暴发疫情[3-5],为近20多年来的最高水平。考虑到该地区DENV媒介伊蚊高度活跃,这次暴发流行,势必对我国登革热疫情防控形势造成影响。对暴发疫情及时开展流行病学调查,分析病毒血清型、基因型以及遗传进化特征,对于掌握登革热流行的基本特征和风险评估具有重要意义。广东省肇庆市1995年曾发生过本地登革热暴发疫情,2014年再次暴发本地疫情,2015年仅报告少量输入散发病例。本研究对肇庆市2014年和2015年登革热病例血标本进行病毒检测、病毒分离和E基因测序等研究,明确病毒型别特征,以完成初步溯源分析。
1 材料与方法 1.1 标本收集与血清分离疑似登革热病例血标本来源于肇庆市辖区各级医院,各级医院根据《登革热诊断标准》(WS 216-2008)和国家卫生和计划生育委员会颁发的《登革热诊疗指南(2014版)》进行临床诊断,通过传染病报告信息管理系统及时录入和报告病例相关的背景信息,收集流行病学资料,采集病例急性期非抗凝血3~5 ml,2~8 ℃冷藏条件下送至肇庆市疾病预防控制中心实验室。实验室收到标本后,采用低温冷冻离心机3000 r/min离心5 min,分离血清并分装2份至螺口冻存管中,用于实验室检测。
1.2 实时荧光RT-PCR疑似病例血清样本RNA采用QIAamp Viral RNA Mini Kit提取(Qiagen,德国),具体操作参照试剂说明书进行,提取的核酸-80 ℃冰箱保存备用。用DENV通用型实时荧光RT-PCR试剂盒对所有急性期样品进行检测,再用DENV 1~4试剂盒对阳性样品进行分型(硕世生物技术有限公司,江苏)。对DENV通用型核酸弱阳性且不能分型的标本,采集患者恢复期血清进行IgG抗体检测。
1.3 病毒分离用RPMI1640培养液10倍稀释DENV核酸阳性血清,取200 μl接种C6/36传代细胞,吸附1 h后弃上清液,加入RPMI1640培养液(含5%胎牛血清)后置5% CO2培养箱33 ℃培养7 d (Thermo,美国),每天观察细胞状况,出现75%以上的病变则收获,如无病变,连续传代3次,最后取培养物上清液进行实时荧光RT-PCR鉴定。
1.4 E基因扩增和序列测定采用SuperScript® Ⅲ One-Step RT-PCR System with Platinum®Taq试剂盒(Invitrogen,美国)扩增DENV 1~4E基因,引物序列参考文献[3]合成及进行扩增。PCR产物纯化后在ABI3730测序仪上进行双向测序,用DNAStar软件的Seqman程序进行序列拼接。
1.5 序列分析对所获得的DENV株E基因序列通过NCBI进行核苷酸序列比对检索工具(basic local alignment search tool,BLAST)比对,应用DNAStar的MegAlign程序进行同源性比对,应用Mega 5.1软件进行系统进化分析,采用Kimura-2参数模型,邻接法(Neighbor-joining,N-J)构建进化发生树,从GenBank下载近年来国内外DENV E基因序列做为参比。
2 结果 2.1 基本情况2014年肇庆市共报告270例登革热确诊病例,发病率6.89/10万,均为本地感染病例。流行时间为9月8日至12月7日,发病高峰在10月。首例病例发生在四会市,患者到广州市出差经蚊叮咬后发病。全市仅有3个县(区)没有报告病例,其中端州区171例(61.70%)、高要区67例(24.20%)、四会市19例(6.90%)、鼎湖区18例(6.50%),大旺高新区和德庆县各1例(0.40%)。男女性病例分别为140例和130例,发病年龄集中在25~30岁。2015年报告3例输入病例(1例缅甸输入、2例佛山市南海区输入),发病率0.02/10万。
2.2 实时荧光RT-PCR共收集登革热疑似病例急性期血清标本409份,其中2014年361份,2015年48份。实时荧光RT-PCR显示,2014年DENV阳性率39.99%(144/361),以DENV 1为主(96.53%,139/144);2015年阳性率6.25%(3/48),其中1份为DENV 2、2份为DENV 3(表 2)。不同年份DENV核酸阳性率差异有统计学意义(χ2=20.82,P < 0.05)。
| 年份 | 标本数 | 实时荧光RT-PCR通用型结果 | 实时荧光RT-PCR分型结果 | ||||||
| 阳性数 | 阳性率(%) | 1型 | 2型 | 3型 | 4型 | 未分型 | |||
| 2014 | 361 | 144 | 39.99 | 139 | 1 | 0 | 0 | 4 | |
| 2015 | 48 | 3 | 6.25 | 0 | 1 | 2 | 0 | 0 | |
| 合计 | 409 | 147 | 35.94 | 139 | 2 | 2 | 0 | 4 | |
随机选取73份(2014年70份,2015年3份) DENV核酸阳性血清标本,采用细胞培养法进行病毒分离,其中30份标本观察到细胞病变,对上清液进行的实时荧光RT-PCR鉴定结果显示,22份扩增阳性,其中2014年DENV 1 20株、2015年DENV 3 2株(图 1),与原始标本的分型结果相一致,共获得22株DENV,总分离率为30.14%。
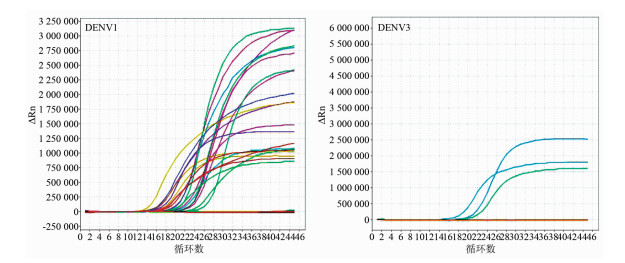
|
| 图 1 DENV培养物实时荧光RT-PCR鉴定与分型结果 Figure 1 Identifying and serotyping results of dengue virus by real-time RT-PCR |
| |
20份DENV毒株通过序列测定均获得1485 bp、编码495个氨基酸的E基因片段,经NCBI网站BLAST比对,均归属为DENV 1。从GenBank下载了45条国内外genotype Ⅰ~Ⅴ的DENV 1序列做参比,构建进化树。分析结果显示,20份DENV 1分离株分属genotype Ⅰ和genotype Ⅲ(图 2)。其中,8份毒株序列属于genotype Ⅰ,彼此间核苷酸同源性99.90%~100.00%,与2013-2014年广州市分离株(KJ438297、KJ545462、KR919613、KU672342、KX458014)、佛山市分离株(KJ545452、KT453229)处于同一进化分支,核苷酸同源性99.40%~100.00%;此外,与近年来马来西亚(JN415512)、新加坡(JN415521)、泰国(JN415528)、印度尼西亚(KM21669)分离株的亲缘关系也较近,核苷酸同源性97.30%~99.90%。另12份毒株序列属于genotype Ⅲ,核苷酸同源性99.20%~100.00%,与2014年广州市(KU672341、KP723473)、佛山市(KT453239)分离株亲缘关系最近,核苷酸同源性99.20%~99.90%;此外,与新加坡2011-2013年的分离株(JN544409、KP685233、KP685234、KM403634)以及印度尼西亚分离株(KM216667)处于同一进化分支,核苷酸同源性97.10%~99.80%。同源性和进化分析结果提示,2014年肇庆市暴发流行的的DENV 1可能由邻近的广州市、佛山市输入。
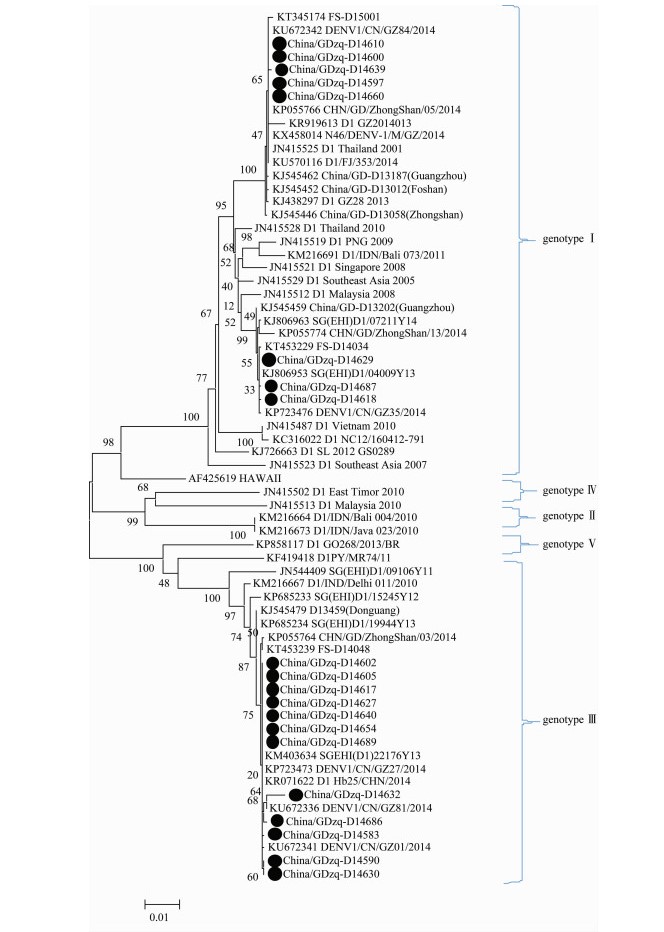
|
| 图 2 肇庆市DENV 1分离株E基因进化树 Figure 2 Phylogenetic tree of E genes of DENV 1 isolates from Zhaoqing, 2014 注:●表示2014年分离毒株。 |
| |
2015年获得的2份DENV株源于一对在佛山南海区工作的肇庆籍夫妻,序列测定获得1485 bp、编码495个氨基酸的E基因,经NCBI网站BLAST比对,均归属为DENV 3。从GenBank下载30条不同地区和年份genotype Ⅰ~Ⅳ的DENV 3序列为参比,进化树分析结果显示,该2份毒株序列为genotype Ⅲ(图 3),其核苷酸及推导的氨基酸同源性为100.00%,属于同一来源,与近年来东南亚各国分离株的genotype Ⅲ序列亲缘关系近,核苷酸同源性98.20%~99.70%,其中与2012年台湾分离到的泰国输入株KP176707、2013年柬埔寨分离株KF543274、2014年新加坡分离株KX224286核苷酸同源性99.70%,与近年分离的广州株(KF954948、HM466964)核苷酸同源性97.60%~97.80%,而与2013年从老挝输入的佛山分离株(KU291641)核苷酸同源性为92.30%,分属不同的基因亚型,提示2015年佛山地区存在着genotype Ⅲ的DENV 3输入性传播。

|
| 图 3 肇庆市DENV 3型分离株E基因进化树 Figure 3 Phylogenetic tree of E genes of DENV 3 isolates from Zhaoqing, 2015 注:●表示2015年分离毒株。 |
| |
登革热实验室诊断方法主要包括病毒分离、核酸检测、抗体和NS1抗原检测等[6-7]。病毒分离检测周期长、操作繁琐,且影响分离率的因素多,不利于快速诊断和疫情研判。本研究73份样本的分离率仅为30.14%,部分标本因未能在发病早期采集、保存不当、上送不及时等因素影响了分离效果。核酸检测包括常规RT-PCR、实时荧光RT-PCR、反转录环介导反转录等温扩增技术(reverse transcription-loop mediated isothermal amplification,RT-LAMP)等方法[8-9]。实时荧光RT-PCR可对DENV 1~4快速分型[10],为疫情研判提供初步的病原学依据。本研究采用实时荧光RT-PCR监测2014年样本,DENV核酸阳性率39.99%,其中DENV 1占96.53%,初步分型与测序结果一致。NS1抗原在登革热患者发病后9~18 d的外周血中仍可被检测到,为登革热的确诊提供了更广泛的时间窗口。研究表明,NS1抗原的ELISA或免疫层析法与核酸检测方法相结合,可把登革热监测的灵敏度提高到99.00%以上[11-12]。采用合适的检测方法与策略,有助于提高登革热监测体系的预警与防控能力。
东南亚为登革热主流行区[13],广东与东南亚各国贸易、旅游往来频繁,独特的地理位置和适宜伊蚊孳生的湿热环境与气候,更容易引发DENV的输入、本地流行与传播[14]。广东省为我国历史以来DENV高度活跃区域,1978年我国首次登革热疫情就在广东省佛山地区发生。中国大陆登革热疫情时空分布的研究表明,2005-2013年广东省具有最高年均发病率[15]。2014年广东省暴发了历史以来第三次以DENV 1为主的大疫情,其中历年的高发区广州和佛山最为严重,已发现了本土循环流行[3, 16]。肇庆市除1995年发生过1次小范围输入性疫情外,2013年以前均维持较低的发病率,2014年在广东省DENV 1大范围暴发流行形势下,肇庆地区DENV 1发病率创历史新高,与广东省及广州地区DENV 1的阳性率一致[3]。肇庆市地理位置毗邻广州、佛山,极容易发生输入性传播。
DENV E基因主要编码病毒包膜蛋白,是病毒与受体结合的主要部位,通过基因进化分析研究,通常可将DENV 1分为5个基因亚型、DENV 2分属6个基因亚型、DENV 3与DENV 4各分4个基因亚型[17-21]。肇庆市2014年的20株DENV 1分为genotypeⅠ、Ⅲ,与2014年广东省及广州地区流行的DENV 1基因亚型相一致[3, 16, 21],核苷酸同源性分析结果显示,与近年来广州市、佛山市分离株亲缘关系最近,与新加坡、印度尼西亚等东南亚流行株次之。2015年分离的2例DENV 3毒株属于genotype Ⅲ,与2012-2014年泰国、柬埔寨、新加坡等地区流行株同源性99.70%,而与2013年佛山市分离的老挝输入株(KU291641)分属不同基因亚型。同源性与进化分析结果显示,肇庆市2014-2015年登革热疫情毒株可能最初源于新加坡、印度尼西亚等东南亚国家的流行株,输入广州市、佛山市后发生本土循环再传播至肇庆市。
志谢: 特别感谢广东省疾病预防控制中心病原微生物检验所副所长吴德博士在DENV进化分析中的指导。作者贡献:
谭翰清 ORCID:0000-0003-0160-698X
谭翰清:标本检测与分离、序列测定与分析、论文撰写
谭海芳、朱颖梅、程洁萍、苏乐斌、林凤、邓廷国、黄强、黎碧坚:标本处理、核酸提取与检测工作
| [1] | Cui XY, Wu YH, An J. Dengue virus and dengue fever[J]. Journal of Capital Medical University, 2014, 35 (6) : 683–688. (in Chinese) 崔晓云, 吴艳花, 安静. 登革病毒和登革热[J]. 首都医科大学学报, 2014, 35 (6) : 683–688. |
| [2] | Brady OJ, Gething PW, Bhatt S, et al. Refining the global spatial limits of dengue virus transmission by evidence-based consensus[J]. PLoS Negl Trop Dis, 2012, 6 (8) : e1760. DOI:10.1371/journal.pntd.0001760 |
| [3] | Sun JF, Wu D, Zhou HQ, et al. The epidemiological characteristics and genetic diversity of dengue virus during the third largest historical outbreak of dengue in Guangdong, China, in2014[J]. J Infect, 2016, 72 (1) : 80–90. DOI:10.1016/j.jinf.2015.10.007 |
| [4] | Liu YH, Feng Y, Yin XX, et al. Molecular epidemiology of dengue virus types1and2in Ruili, Yunnan, 2014[J]. Disease Surveillance, 2016, 31 (1) : 8–13. (in Chinese) 刘永华, 冯云, 尹小雄, 等. 2014年云南省瑞丽市登革1和2型病毒流行的分子流行病学研究[J]. 疾病监测, 2016, 31 (1) : 8–13. |
| [5] | Ou JM, Wu SG, Chen W, et al. Epidemiology of dengue fever in Fujian, China, 2014[J]. Disease Surveillance, 2016, 31 (1) : 14–17. (in Chinese) 欧剑鸣, 吴生根, 陈武, 等. 福建省2014年登革热流行病学特征分析[J]. 疾病监测, 2016, 31 (1) : 14–17. |
| [6] | Bhat VG, Chavan P, Ojha S, et al. Challenges in the laboratory diagnosis and management of dengue infections[J]. Open Microbiol J, 2015, 31 (9) : 33–37. |
| [7] | Health Department of the People's Republic of China.WS216-2008Diagnostic criteria and principle of management of Dengue fever[S].Beijing:China Standard Press, 2008:1-7.(in Chinese) 中华人民共和国卫生部.WS216-2008登革热诊断标准[S].北京:中国标准出版社, 2008:1-17. |
| [8] | Zheng K, Ding GY, Zhou HQ, et al. Rapid detection of Dengue virus and Chikungunya virus by multiplex real-time RT-PCR assay with an internal control[J]. Chinese Journal of Zoonoses, 2013, 29 (3) : 242–247. (in Chinese) 郑夔, 丁国允, 周惠琼, 等. 应用含内参的多重实时荧光RT-PCR方法快速检测登革病毒和基孔肯雅病毒[J]. 中国人兽共患病学报, 2013, 29 (3) : 242–247. |
| [9] | Hu SF, Li M, Zhong LL, et al. Development of reverse-transcription loop-mediated isothermal amplification assay for rapid detection and differentiation of dengue virus serotypes1-4[J]. BMC Microbiol, 2015, 15 : 265. DOI:10.1186/s12866-015-0595-1 |
| [10] | Alm E, Lindegren G, Falk KI, et al. One-step real-time RT-PCR assays for serotyping dengue virus in clinical samples[J]. Bmc Infect Dis, 2015, 15 : 493. DOI:10.1186/s12879-015-1226-z |
| [11] | Huhtamo E, Hasu E, Uzcátegui NY, et al. Early diagnosis of dengue in travelers:comparison of a novel real-time RT-PCR, NS1antigen detection and serology[J]. J Clin Virol, 2010, 47 (1) : 49–53. DOI:10.1016/j.jcv.2009.11.001 |
| [12] | Parkash O, Shueb RH. Diagnosis of dengue infection using conventional and biosensor based techniques[J]. Viruses, 2015, 7 (10) : 5410–5427. DOI:10.3390/v7102877 |
| [13] | Huang JH, Su CL, Yang CF, et al. Molecular characterization and phylogenetic analysis of Dengue Viruses imported into Taiwan during2008-2010[J]. Am J Trop Med Hyg, 2012, 87 (2) : 349–358. DOI:10.4269/ajtmh.2012.11-0666 |
| [14] | Shen JC.Impact of vector and meteorological factors on Dengue epidemic in Guangzhou and Establishment of forecasting model[D].Guangzhou:Southern Medical University, 2015.(in Chinese) 沈纪川.媒介和气象因素对广州登革热流行的影响及其预测模型的建立[D].广州:南方医科大学, 2015. |
| [15] | Yue YJ, Ren DS, Liu QY. Spatial-temporal distribution of dengue fever in the mainland of China, 2005-2013[J]. Disease Surveillance, 2015, 30 (7) : 555–560. (in Chinese) 岳玉娟, 任东升, 刘起勇. 2005-2013年中国大陆登革热疫情时空分布[J]. 疾病监测, 2015, 30 (7) : 555–560. |
| [16] | Lin YP, Luo Y, Chen Y, et al. Clinical and epidemiological features of the2014large-scale dengue outbreak in Guangzhou city, China[J]. BMC Infect Dis, 2016, 16 (1) : 102. DOI:10.1186/s12879-016-1379-4 |
| [17] | Bai ZJ, Cao YM, Cao Q, et al. Genotyping of dengue virus type1and2strains isolated in Guangzhou area, 2012[J]. Chinese Journal of Zoonoses, 2014, 30 (2) : 207–212. (in Chinese) 白志军, 曹毅敏, 曹庆, 等. 广州地区2012年1、2型登革病毒基因型特征研究[J]. 中国人兽共患病学报, 2014, 30 (2) : 207–212. |
| [18] | Afreen N, Naqvi IH, Broor S, et al. Phylogenetic and molecular clock analysis of dengue serotype1and3from New Delhi, India[J]. PLoS One, 2015, 10 (11) : e0141628. DOI:10.1371/journal.pone.0141628 |
| [19] | Chew MH, Rahman MM, Hussin S. Molecular epidemiology and phylogenetic analysis of Dengue virus type-1and2isolated in Malaysia[J]. Pak J Med Sci, 2015, 31 (3) : 615–620. |
| [20] | Waman VP, Kolekar P, Ramtirthkar MR, et al. Analysis of genotype diversity and evolution of Dengue virus serotype2using complete genomes[J]. PeerJ, 2016, 4 : e2326. DOI:10.7717/peerj.2326 |
| [21] | Shen SQ, Wei HX, Fu YH, et al. Multiple sources of infection and potential endemic characteristics of the large outbreak of Dengue in Guangdong in2014[J]. Sci Rep, 2015, 5 : 16913. DOI:10.1038/srep16913 |
 2016, Vol. 31
2016, Vol. 31


