扩展功能
文章信息
- 吉兴照, 侯雪新, 孙丽娜, 谭晓罗, 司晨琛, 徐帅, 唐璐, 韦超, 李振军
- JI Xing-zhao, HOU Xue-xin, SUN Li-na, TAN Xiao-luo, SI Chen-chen, XU Shuai, TANG Lu, WEI Chao, LI Zhen-jun
- 鼻疽诺卡菌感染小鼠足垫后组织病理变化以及细胞因子分泌情况的初步研究
- Preliminary study of histopathologic changes and cytokine secretion in foot pad of mice infected with Nocardia farcinica
- 疾病监测, 2017, 32(3): 195-199
- Disease Surveillance, 2017, 32(3): 195-199
- 10.3784/j.issn.1003-9961.2017.03.007
-
文章历史
- 收稿日期:2016-11-22
2. 郴州市疾病预防控制中心, 湖南 郴州 423000;
3. 温州医科大学, 浙江 温州 325035;
4. 山西医科大学, 山西 太原 030000
2. Chenzhou Prefecture Center for Disease Control and Prevention, Chenzhou 423000, Hunan, China;
3. Wenzhou Medical University, Wenzhou 325035, Zhejiang, China;
4. Shanxi Medical University, Taiyuan 030000, Shanxi, China
诺卡氏菌 (Nocardia) 是一种全球分布的机会致病菌、革兰染色阳性、需氧,在自然界中广泛存在。通常感染免疫力缺陷、器官移植、糖尿病、肿瘤患者以及长期服用类固醇激素等患者[1-3],主要引起肺部感染[4-7],也可通过血行播散等方式感染其他部位,如皮肤、中枢神经系统等[8-9]。经以往病例统计,在美国每年大约有500~1 000例患者、日本约有150~200例、法国约有90~130例[10-11]。目前已知对人致病的诺卡菌约有25种[5],其中主要有巴西诺卡菌、星形诺卡菌、鼻疽诺卡菌、新星诺卡菌等,其中新星诺卡菌、星形诺卡菌和鼻疽诺卡菌引起的感染占诺卡菌感染总数的85%左右[12-14]。鼻疽诺卡菌感染后如果没有进行正确的诊断和治疗通常会危及生命,因为其感染后容易播散且具有多重耐药的特点,包括耐三代头孢[2, 15-17],据报道,预后很容易复发,死亡率在14%~40%,播散感染死亡率可达100%[18]。近年来,鼻疽诺卡菌感染病例报道越来越多,包括局部感染及播散感染,除肺部感染外还会感染大脑、肾脏、关节、前列腺、角膜、心脏[2, 6, 19-22]等,然而对于鼻疽诺卡菌致病机制尚不清楚。
本研究通过对感染鼻疽诺卡菌小鼠足垫的组织病理变化过程以及感染过程中细胞因子分泌情况的分析,动态了解其感染过程特点,对分析鼻疽诺卡菌致病机制具有重要的意义。
1 材料与方法 1.1 材料 1.1.1 试验动物与菌株6~8周雌性BALB/c小鼠购自北京维通利华实验动物技术有限公司;鼻疽诺卡菌标准株CDC90(DSMZ43131) 购自德国微生物菌种保藏中心。
1.1.2 主要试剂与仪器苏木精、伊红购自于Amresco公司;SP免疫组化试剂盒和DAB试剂盒购自北京中杉金桥生物技术有限公司。石蜡切片机、加热石蜡包埋系统和正置荧光显微镜 (德国Leica公司)。
1.2 方法 1.2.1 菌液制备从BHI固体培养基上挑取鼻疽诺卡菌单个菌落接种于BHI液体培养基中,在37 ℃、180 r/min振荡条件下培养过夜,按1 : 100比例稀释于BHI液体培养基中继续培养18 h达到对数生长期,5 500 r/min离心10 min,弃上清,用PBS重悬沉淀洗涤,重复3次,调整菌液A值为0.8,此时菌液浓度约为108 cfu/ml, 备用。
1.2.2 小鼠感染模型构建及足垫组织获取按照文献中小鼠足垫感染诺卡菌方法建立感染模型[23],感染组用PBS重悬的对数生长期的菌注射于小鼠足垫,注射量为100 μl;对照组注射相同剂量的PBS。小鼠足垫感染后,1、3、7和14 d将小鼠脱臼处死,用手术刀片切取的小鼠足垫, 并用4%多聚甲醛浸泡固定,备用。
1.2.3 HE染色及免疫组织化学染色常规HE染色,依次进行甲醛固定、石蜡包埋、切片、HE染色, 在光镜下观察病例组织变化。S-P免疫组化法按照试剂盒实验步骤进行。每张切片随机选取5个不重复视野,用Imagepro plus图像分析软件对图像进行分析,以光密度强度值作为分析标准,以均数±标准差 (x±s) 表示。
1.3 统计学分析实验数据以x±s表示,应用SPSS 17.0软件对数据进行统计学分析,采用两组独立样本t检验, P < 0.05为差异有统计学意义。
2 结果 2.1 感染小鼠模型足垫组织病理变化光镜下观察,小鼠足垫感染第1天后皮下组织可见条带状中性粒细胞聚集,周围出现中性粒细胞浸润,轻微炎症形成;感染后第3天皮下组织间出现中性粒细胞脓肿,脓肿周围有组织细胞聚集倾向,弥漫性中性粒细胞浸润,进入急性感染期;感染后第7天皮下组织间出现大量肌纤维母细胞及血管内皮细胞增生,伴散在分布的中性粒细胞及淋巴细胞,感染转入慢性感染时期;感染后第14天皮下组织间大量肌纤维母细胞及血管内皮细胞增生,伴中性粒细胞及淋巴细胞散在分布,可见局灶小脓肿,周围见片状增生的泡沫样巨噬细胞,进入感染修复期, 见图 1。
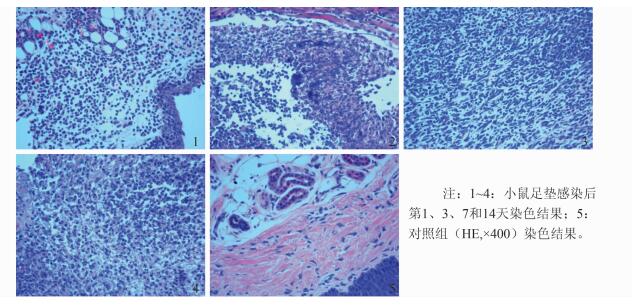
|
| 图 1 小鼠足垫组织 (HE, ×400) 染色结果 Figure 1 Results of (HE, ×400) staining of mouse foot pad tissues |
| |
本研究通过组织免疫组化结果发现,IL-6在整个感染过程中分泌变化最大,尤其在感染第14天,即感染修复期后分泌量最高,其次是第7天,与对照组结果比较差异有统计学意义 (t7=6.36、t14=17.24,P < 0.05)。见图 2、3。
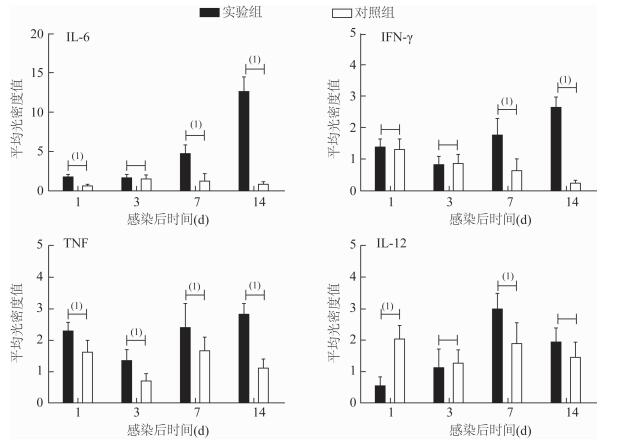
|
| 图 2 小鼠足垫皮下组织IL-6、IL-12、IFN-γ和TNF阳性表达光密度强度值 Figure 2 Intensity of optical density of IL-6, IL-12, IFN-γ and TNF in mouse foot pad tissues 注:(1)P<0.05。 |
| |
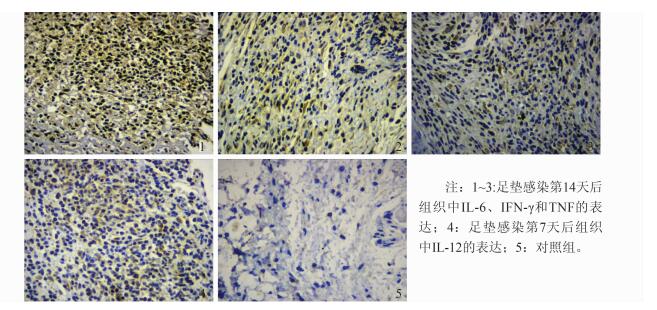
|
| 图 3 小鼠足垫感染组及对照组组织中IL-6、IFN-γ、TNF和IL-12表达情况 (HE, ×400) Figure 3 Expression of IL-6, IFN-γ, TNF and IL-12 in infected group and control group (HE, ×400) |
| |
组织中的IL-12在感染后第1、3、14天分泌量未见升高,与对照组比较差异无统计学意义;仅在感染后第7天分泌量增加,与对照组结果比较差异有统计学意义 (t7=3.46,P < 0.05)。
组化结果显示,IFN-γ在感染后第1、3天分泌量未见增加,与对照组结果比较差异无统计学意义;在感染后第7、14天分泌量增加,且在第14天分泌量最多,与对照组结果比较差异有统计学意义(t7=4.63、t14=18.21,P < 0.05)。
组化结果显示,TNF在感染后第1、3、7、14天分泌量均增加,与对照组结果比较差异有统计学意义 (t1=3.82、t3=3.73、t7=2.76、t14=11.02, P < 0.05),感染过程中分泌量变化不明显。
3 讨论鼻疽诺卡菌属于分枝杆菌,造成局部感染以及播散感染,常见感染部位为肺组织约占43%,其次皮下组织约占10%[2],但随着鼻疽诺卡菌感染病例越来越多,感染部位涉及肾[3]、脊柱[24]等以及通过播散引起其他器官的感染。尽管临床对于鼻疽诺卡菌的感染采取积极治疗,但死亡率依然很高约39%[24],其中可能是由于临床缺乏快速诊断方法而延误最佳治疗时间,其次,鼻疽诺卡菌感染后通过播散感染引起重要器官感染如大脑、脊柱等而危及生命。
目前对于鼻疽诺卡菌感染皮下组织的研究较少,主要是针对肺部组织感染的研究。本研究通过模拟巴西诺卡菌感染足垫模型建立的方法建立了皮下组织感染模型,有报道发现使用对数生长期的巴西诺卡菌建立足垫感染模型更容易成功和重复性强[25]。本研究应用对数生长期的菌液感染小鼠,分析了鼻疽诺卡菌在感染皮下组织中的病理变化特点以及研究了病理变化过程中参与的细胞因子,初步了解了鼻疽诺卡菌感染皮下组织的基本特点。感染初期大量中性粒细胞参与,可见初期炎症反应较为严重,后期逐渐出现淋巴细胞以及纤维母细胞、血管内皮细胞和泡沫样巨噬细胞,尤其在感染后第14天,脓肿周围聚集有大量泡沫样巨噬细胞,其作用是限制并吞噬脓肿组织的重要细胞,在巴西诺卡菌感染小鼠足垫第10天HE染色同样可以发现泡沫样巨噬细胞[25],与巴西诺卡菌感染皮下组织过程相似。IL-6是一种多功能细胞因子,主要由巨噬细胞、内皮细胞、B细胞等多种细胞产生,具有调节免疫应答功能,在机体的抗感染免疫反应中起重要作用,能促进Th0向Th17亚群分化,并能促进CTL的分化,增强其杀伤功能。IL-12又称为自然杀伤细胞刺激因子,主要由树突状细胞、巨噬细胞等产生,能够促进TH1细胞增殖,诱导T细胞产生IFN-γ。IFN-γ可激活巨噬细胞和NK细胞等,趋化树突状细胞的迁移等,能明显促进CTL的分化,并增强其杀伤功能。TNF在调节适应性免疫、杀伤靶细胞等过程发挥重要作用,还可以诱导树突状细胞的成熟分化,促进中性粒细胞浸润,发挥吞噬效应。从免疫组化结果看出,随着感染进展,IL-6在第1、3天分泌较少,第7天分泌量增加,到第14天分泌量达最高。从病理组织变化看出,在慢性感染期和组织修复时期,IL-6大量地表达,促进Th17细胞分化,与结核杆菌感染类似[26]。促进大量纤维母细胞和血管内皮细胞形成,发挥了促进细胞增殖分化功能。然而在巴西诺卡菌感染小鼠足垫实验中,研究者检测小鼠血清中IL-6发现在感染第1~4天其分泌量逐渐增加,随着感染时间延长,分泌量逐渐减少。IFN-γ在胞内菌感染过程中能起到重要的保护作用,研究者在巴西诺卡菌感染小鼠模型血清中能够持续检测到大量IFN-γ,甚至在感染后第300天仍然可以检测到[25]。鼻疽诺卡菌引起皮下组织感染后可能是通过诱导Th0向Th1或Th17细胞分化,诱导中性粒细胞聚集形成炎症反应,活化巨噬细胞和NK细胞等促进其吞噬和杀伤胞内细菌。其中Th17细胞主要分泌IL-17、IL-6和TNF-α等细胞因子[27-28], 在胞内菌鼻疽诺卡菌感染过程中的作用有待研究,需要进一步研究感染过程中与Th17细胞相关的细胞因子,以确定其在感染中发挥的作用。
鼻疽诺卡菌感染小鼠足垫的模型对了解人在感染鼻疽诺卡菌后人体与菌体在急性期、慢性期和修复期的相互作用特点和致病机制的研究有所帮助。应用敲除某些基因的小鼠或者是与人同源基因的小鼠进行进一步研究也许会更有意义。
作者贡献:
吉兴照 ORCID:0000-0001-7232-1725
吉兴照:试验操作、论文撰写、数据分析
侯雪新:实验指导、样本处理
孙丽娜:实验指导、论文修改
谭晓罗、司晨琛、徐帅、唐璐、韦超:协助实验
李振军:经费提供、论文修改
| [1] | Kim J, Kang M, Kim J, et al. A case of Nocardia farcinica pneumonia and mediastinitis in an immunocompetent patient[J]. Tuberc Respir Dis, 2016, 79(2): 101–103. DOI:10.4046/trd.2016.79.2.101 |
| [2] | de Nardo P, Giancola ML, Noto S, et al. Left thigh phlegmon caused by Nocardia farcinica identified by 16S rRNA sequencing in a patient with leprosy: a case report[J]. BMC Infect Dis, 2013, 13(1): 162. DOI:10.1186/1471-2334-13-162 |
| [3] | Tachezy M, Simon P, Ilchmann C, et al. Abscess of adrenal gland caused by disseminated subacute Nocardia farcinica pneumonia[J]. BMC Infect Dis, 2009, 9(1): 194. DOI:10.1186/1471-2334-9-194 |
| [4] | Ambrosioni J, Lew D, Garbino J. Nocardiosis: updated clinical review and experience at a tertiary center[J]. Infection, 2010, 38(2): 89–97. DOI:10.1007/s15010-009-9193-9 |
| [5] | Kandi V. Human Nocardia infections: a review of pulmonary nocardiosis[J]. Cureus, 2015, 7(8): e304. |
| [6] | Scorey H, Daniel S. Nocardia farcinica bacteraemia presenting as a prostate abscess[J]. IDCases, 2016, 5: 24–26. DOI:10.1016/j.idcr.2016.06.001 |
| [7] | Li LX, Li ZJ, Lou YL. Identification of Nocardia species based on gyrB gene[J]. Disease Surveillance, 2016, 31(6): 503–506. (in Chinese) 李路茜, 李振军, 楼永良. gyrB基因在诺卡菌菌种鉴定中的应用研究[J]. 疾病监测, 2016, 31(6): 503–506. |
| [8] | Inamadar AC, Palit A. Primary cutaneous nocardiosis: a case study and review[J]. Indian J Dermatol Venereol Leprol, 2003, 69(6): 386–391. |
| [9] | Zakaria A, Elwatidy S, Elgamal E. Nocardia brain abscess: severe CNS infection that needs aggressive management; case report[J]. Acta Neurochir, 2008, 150(10): 1097–1101. DOI:10.1007/s00701-008-0026-2 |
| [10] | Beaman BL, Burnside J, Edwards B, et al. Nocardial infections in the United States, 1972-1974[J]. J Infect Dis, 1976, 134(3): 286–289. DOI:10.1093/infdis/134.3.286 |
| [11] | Farina C, Boiron P, Ferrari I, et al. Report of human nocardiosis in Italy between 1993 and 1997[J]. Eur J Epidemiol, 2001, 17(11): 1019–1022. DOI:10.1023/A:1020010826300 |
| [12] | Tsukamura M, Ohta M. Nocardia farcinica as a pathogen of lung infection[J]. Microbiol Immunol, 1980, 24(3): 237–241. DOI:10.1111/mim.1980.24.issue-3 |
| [13] | Ertl G, Schaal KP, Kochsiek K. Nocardial endocarditis of an aortic valve prosthesis[J]. Br Heart J, 1987, 57(4): 384–386. DOI:10.1136/hrt.57.4.384 |
| [14] | Tsukamura M, Shimoide H, Kaneda K, et al. A case of lung infection caused by an unusual strain of Nocardia farcinica[J]. Microbiol Immunol, 1988, 32(5): 541–546. DOI:10.1111/mim.1988.32.issue-5 |
| [15] | Muñoz J, Mirelis B, Aragón LM, et al. Clinical and microbiological features of nocardiosis 1997-2003[J]. J Med Microbiol, 2007, 56(Pt 4): 545–550. |
| [16] | Peleg AY, Husain S, Qureshi ZA, et al. Risk factors, clinical characteristics, and outcome of Nocardia infection in organ transplant recipients: a matched case-control study[J]. Clin Infect Dis, 2007, 44(10): 1307–1314. DOI:10.1086/514340 |
| [17] | Hitti W, Wolff M. Two cases of multidrug-resistant Nocardia farcinica infection in immunosuppressed patients and implications for empiric therapy[J]. Eur J Clin Microbiol Infect Dis, 2005, 24(2): 142–144. DOI:10.1007/s10096-005-1285-y |
| [18] | Martinez R, Reyes S, Menéndez R. Pulmonary nocardiosis: risk factors, clinical features, diagnosis and prognosis[J]. Curr Opin Pulm Med, 2008, 14(3): 219–227. DOI:10.1097/MCP.0b013e3282f85dd3 |
| [19] | Kumar VA, Augustine D, Panikar D, et al. Nocardia farcinica brain abscess: epidemiology, pathophysiology, and literature review[J]. Surg Infect, 2014, 15(5): 640–646. DOI:10.1089/sur.2012.205 |
| [20] | Park SD, Kim HJ, Jang IH, et al. First report of Nocardia farcinica bursitis in a patient with diabetes mellitus[J]. Ann Lab Med, 2014, 34(3): 252–255. DOI:10.3343/alm.2014.34.3.252 |
| [21] | Sirijatuphat R, Niltwat S, Tiangtam O, et al. Purulent pericarditis and cardiac tamponade caused by Nocardia farcinica in a nephrotic syndrome patient[J]. Int Med, 2013, 52(19): 2231–2235. DOI:10.2169/internalmedicine.52.0453 |
| [22] | Sharma N, O'Hagan S. The role of oral co-trimoxazole in treating Nocardia farcinica keratitis—a case report[J]. J Ophthalmic Inflamm Infect, 2016, 6(1): 23. DOI:10.1186/s12348-016-0091-2 |
| [23] | Solis-Soto JM, Quintanilla-Rodriguez LE, Meester I, et al. In situ detection and distribution of inflammatory cytokines during the course of infection with Nocardia brasiliensis[J]. Histol Histopathol, 2008, 23(5): 573–581. |
| [24] | Budzik JM, Hosseini M, Mackinnon AC Jr, et al. Disseminated Nocardia farcinica: literature review and fatal outcome in an immunocompetent patient[J]. Surg Infect, 2012, 13(3): 163–170. DOI:10.1089/sur.2011.012 |
| [25] | Salinas-Carmona MC, Torres-Lopez E, Ramos AI, et al. Immune response to Nocardia brasiliensis antigens in an experimental model of actinomycetoma in BALB/c mice[J]. Infect Immun, 1999, 67(5): 2428–2432. |
| [26] | Zhu JH. The research progress of Th17/IL-17 in tuberculosis infection[J]. Chinese Journal of Immunology, 2013, 29(4): 434–438. (in Chinese) 朱杰华. Th17/IL-17在结核感染中的研究进展[J]. 中国免疫学杂志, 2013, 29(4): 434–438. |
| [27] | Harrington LE, Hatton RD, Mangan PR, et al. Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages[J]. Nat Immunol, 2005, 6(11): 1123–1132. DOI:10.1038/ni1254 |
| [28] | Park H, Li ZX, Yang XO, et al. A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17[J]. Nat Immunol, 2005, 6(11): 1133–1141. DOI:10.1038/ni1261 |
 2017, Vol. 32
2017, Vol. 32


