扩展功能
文章信息
- 邓建平, 刘海灿, 王斌, 张红梅, 张正东, 宁柱, 赵秀芹, 李群, 万康林
- DENG Jian-ping, LIU Hai-can, WANG Bin, ZHANG Hong-mei, ZHANG Zheng-dong, NING Zhu, ZHAO Xiu-qin, LI Qun, WAN Kang-lin
- 自贡市非结核分枝杆菌临床分离株的菌种鉴定结果分析
- Identification of clinical isolates of non-tuberculous mycobacteria in Zigong city
- 疾病监测, 2017, 32(3): 237-240
- Disease Surveillance, 2017, 32(3): 237-240
- 10.3784/j.issn.1003-9961.2017.03.016
-
文章历史
- 收稿日期:2016-11-16
2. 中国疾病预防控制中心传染病预防控制所传染病预防控制国家重点实验室 感染性疾病诊治协同创新中心, 北京 102206
2. State Key Laboratory for Communicable Disease Prevention and Control, Infectious Disease Diagnosis Collaboration and Innovation Center, Institute for Communicable Disease Prevention and Control, Chinese Center for Disease Control and Prevention, Beijing 102206, China
非结核分枝杆菌 (non-tuberculous Mycobacteria,NTM) 系指分枝杆菌属中除结核分枝杆菌复合群菌株 (Mycobacterium tuberculosis complex,MTBC) 和麻风分枝杆菌 (Mycobacterium leprae) 以外的所有分枝杆菌。迄今为止,发现的NTM种类有180余种 (http://www.bacterio.net/mycobacterium.html)。近年来由于人们感染NTM的发病率日益增多,其作为一种严重的卫生问题,已引起世界范围的广泛关注[1]。我国第五次全国结核病流行病抽样调查显示,NTM感染率也呈逐年上升趋势[2]。NTM引起的肺病极易误诊为结核病,且多数NTM对抗结核药物耐药。但长期以来,分枝杆菌属的分型鉴定一直采用以表型特征为主的方法,随着分子生物学的发展,聚合酶链反应 (polymerase chain reaction,PCR)、PCR-限制性片段长度多态性分析 (PCR restriction fragment length polymorphism analysis,PCR-RFLP),PCR-核酸杂交,以及直接核酸测序技术为分枝杆菌的分型鉴定开辟了新途径[3]。本研究对通过罗氏培养基 (L-J)、对硝基苯甲酸 (PNB) 和噻吩-2-羧酸肼 (TCH) 鉴别培养基初步鉴定为NTM的菌株,再使用多位点PCR,并结合对rpoB、hsp65及its基因进行测序和分析完成鉴定工作。
1 材料与方法 1.1 材料选取2012-2016年期间,由自贡市各区 (县) 及市结核病防治所临床患者痰标本中分离获得,经鉴别培养基鉴定为NTM的全部菌株 (共计35株)。结核分枝杆菌标准株 (H37Rv) 作为标准参考菌株,来源于中国药品生物制品检定所,并由中国疾病预防控制中心 (CDC) 传染病预防控制所结核病室传代培养、保藏,并提供作为参照。改良L-J培养基和PNB/TCH鉴别培养基由自贡市CDC结核病实验室按照中国防痨协会《结核病诊断实验室检验规程》要求配制[4]。引物合成及测序由生工生物工程 (上海) 股份有限公司完成。2×Taq MasterMix购自北京康为世纪有限公司。
1.2 方法及步骤 1.2.1 初步鉴别取新鲜分枝杆菌菌体,制备成0.01 mg/ml菌悬液,分别取0.1 ml均匀涂布于PNB、TCH鉴别培养基和改良L-J空白对照培养基斜面上,37 ℃孵育,接种后3~7 d观察,每周观察1次结果,直至孵育4周。结核分枝杆菌、牛分枝杆菌及NTM鉴定依据[5]见表 1。
| 菌株 | PNB | TCH | L-J |
| M. tuberculosis | - | + | + |
| M. bovis | - | - | + |
| NTM | + | + | + |
| 注:+为生长,-为不生长。 | |||
选择在分枝杆菌基因组中存在不同分布的7个位点作为扩增的目的条带[6],在25 μl PCR的反应体系中,10 μmol/L的上、下游引物各1 μl,2×Taq PCR MasterMix 13 μl,DNA模板4 μl,ddH2O 6 μl。反应条件为预变性94 ℃ 5 min,变性94 ℃ 1 min,退火60 ℃ 1 min,延伸72 ℃ 1 min,循环30次,最后充分延伸72 ℃ 10 min,每次扩增分别设阳性及阴性对照。扩增产物经2%琼脂糖凝胶电泳进行检测。
1.2.3 hsp65、rpoB和its基因测序及分析使用引物tb11、tb12[7],rpoBF、rpoBR[8]和16SF、23SR[9]扩增hsp65、rpoB和its基因,引物序列见表 2。50 μl PCR体系包括10 μmol/L引物各2 μl,2×Taq MasterMix 25 μl,DNA模板5 μl,ddH2O 16 μl。PCR条件为预变性94 ℃ 10 min,变性94 ℃ 1 min,退火62 ℃ 1 min,延伸72 ℃ 1 min,30次循环,最后充分延伸72 ℃ 10 min。扩增产物送生工生物工程 (上海) 股份有限公司测序,并将获得的hsp65、rpoB和its基因序列提交NCBI-BLAST网站 (http://blast.ncbi.nlm.nih.gov/Blast.cgi) 进行同源性比较。
| 基因 名称 |
引物名称 | 引物序列 (5′~3′) | 目的片段 大小 (bp) |
| hsp65 | tb11 | ACC AAC GAT GGT GTG TCC AT | 440 |
| tb12 | CTT GTC GAA CCG CAT ACC CT | ||
| rpoB | rpoBF | TCA AGG AGA AGC GCT ACG A | 360 |
| rpoBR | ATG TTG ATC AGG GTC TGC | ||
| its | 16SF | ACC TCC TTT CTA AGG AGC ACC | 280 |
| 23SR | GAT GCT CGC AAC CAC TAT CCA |
经改良L-J培养基、PNB/TCH鉴别培养基初步培养鉴定的35株疑似NTM,经多位点PCR鉴定确认NTM为32株,其余3株为结核分枝杆菌,见图 1。
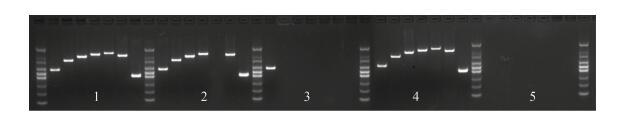
|
| 图 1 不同种分枝杆菌临床菌株Multi-locus PCR鉴定 Figure 1 Results of Multi-locus PCR for different Mycobacterium strains 注:1:ZGCDCJ2016019 (Mycobacterium tuberculosis);2:ZGCDCJ2016007 (Mycobacterium africanum Ⅰ type);3:ZGCDCJ2015011 (non-tuberculosis Mycobacterium,NTM);4:Standard strain of Mycobacterium tuberculosis H37Rv;5:Negative control. |
| |
经多位点PCR鉴定为NTM的32株菌株,使用rpoB、hsp65及its测序鉴定出脓肿分枝杆菌 (M. abscessus)11株,约占34.38%;胞内分枝杆菌 (M. intracellulare)7株,约占21.88%;堪萨斯分枝杆菌 (M. kansasii)5株,约占15.63%;鸟分枝杆菌 (M. avium)3株,约占9.38%;脓毒分枝杆菌 (M. septicum)1株,约占3.12%;马赛分枝杆菌 (M. masseillense)1株,约占3.12%;戈登分枝杆菌 (M. gordonae)2株,约占6.25%;副瘰疬分枝杆菌 (M. parascrofulaceum)1株,约占3.12%;Mycobacterium peregrinum1株,约占3.12%。
3 讨论NTM在自然环境中普遍存在,可以在自然环境下增殖,并通过空气等途径传播。现已发现,部分NTM菌种为人类致病菌或者条件致病菌,可导致的人类疾病主要损害肺部,具有与结核病临床表现相似的全身症状和局部损害,因此,在无菌种鉴定结果的情况下,可能误诊为结核病。另外,由于多数NTM对抗结核药物耐药,治疗疗效不佳,并且此类药物对患者的肝及神经系统有所损害,导致NTM患者和结核分枝杆菌患者在治疗上存在着差异,因此对NTM的菌种进行快速准确的鉴别,对于疾病的确诊及其合理用药至关重要[10]。目前分枝杆菌菌种的鉴定方法多样,且各有利弊。常规表型鉴定方法主要是通过观察菌株形态、培养特征和生化实验等进行,但由于这些方法繁琐、费力、耗时,且对于NTM菌种的鉴定不太准确,不利于开展快速诊断和治疗。PCR检测方法以及DNA直接测序方法,更为快速、准确,因此常被用于分枝杆菌的快速鉴定[8]。
在本研究中,经改良L-J培养基、PNB/TCH鉴别培养基初步培养鉴定为NTM的35株分枝杆菌样品,经多位点PCR再次鉴定,确认NTM为32株,其余3株为结核分枝杆菌。出现生化鉴定与分子生物学鉴定结果不一致现象,原因可能是由于个别菌株生化特性发生变异,导致PNB/TCH初步生化鉴别结果并不完全准确,因此实验室需要结合传统方法和分子生物学方法完成对临床分离株的鉴定。使用rpoB、hsp65及its测序,可以进一步将经过多位点PCR鉴定为NTM的32株菌株,鉴定为9种NTM。其中,菌株数最多为脓肿分枝杆菌,共11株 (约占34.38%),其次为胞内分枝杆菌7株 (约占21.88%),再次为堪萨斯分枝杆菌5株 (约占15.63%)。该结果与湖南省、甘肃省、宁波市、福建省、山东省报道相似[11-16],临床NTM菌种鉴定结果以胞内分枝杆菌、鸟分枝杆菌和龟分枝杆菌等为主有显著差异,分析可能与地域环境、感染方式有一定关系,同时,也可能是由于本次研究菌株数相对较少存在一定的数据偏倚。但是,本研究中鉴定出的以上3种NTM均为国内外文献报道引起NTM肺病的主要病原菌。近年来,脓肿分枝杆菌作为常见的致病性分枝杆菌,其病例报道越来越多,并且治疗异常困难[17],临床应加强对其的认识和诊断。此外,亦在临床患者中鉴定出脓毒分枝杆菌、马赛分枝杆菌和副瘰疬分枝杆菌等国内少见病原[18-19],新的NTM病原菌的出现应引起高度重视和警惕,同时应进一步加强新病原溯源调查和流行病学研究。
鉴定NTM是诊断和研究相关疾病的重要基础,通过本研究发现,传统生化鉴定方法,可以为分枝杆菌的菌种鉴别提供参考,但是PCR、核酸测序等分子生物学技术,可以更为快速、准确地获得分枝杆菌鉴定结果。因此,检验实验室等检测部门应通过采用分子生物学技术,对于NTM进行快速、准确鉴别,为临床诊断和治疗NTM感染以及制订NTM的防控策略提供准确的参考依据。同时,临床医生应提高对NTM肺病的认识,掌握诊治标准,以便于早诊断、早治疗。
作者贡献:
邓建平 ORCID:0000-0002-8187-6615
邓建平:项目设计,实验室检测,数据收集、整理、分析,论文撰写及修改
刘海灿:数据分析
王斌、张红梅:实验室检测
张正东、宁柱:流行病学调查
赵秀芹:实验室检测
李群、万康林:项目设计及技术指导
| [1] | Wang HX, Yue J, Han M, et al. Nontuberculous mycobacteria: susceptibility pattern and prevalence rate in Shanghai from 2005 to 2008[J]. Chin Med J, 2010, 123(2): 184–187. |
| [2] | Wang Y. Compilation of the data of the fifth national tuberculosis epidemiological sampling survey[M]. Beijing: Military Medical Science Press, 2011: 26. (in Chinese) 王宇. 全国第五次结核病流行病学抽样调查资料汇编[M]. 北京: 军事医学科学出版社, 2011: 26. |
| [3] | Huang MX. Advances in laboratory diagnosis of non-tuberculosis Mycobacterial disease[J]. Chinese Journal of Antituberculosis, 2013, 35(7): 538–541. (in Chinese) 黄明翔. 非结核分枝杆菌病的实验室诊断技术进展[J]. 中国防痨杂志, 2013, 35(7): 538–541. |
| [4] | China anti tuberculosis association based Specialized Committee. Rules for the detection of tuberculosis diagnostic laboratory[M]. Beijing: China Education Press, 2006: 30-56. (in Chinese) 中国防痨协会基础专业委员会. 结核病诊断实验室检测规程[M]. 北京: 中国教育文化出版社, 2006: 30-56. |
| [5] | Xu JG, Kan B, Zhang JZ, et al. Field bacteriology[M]. Beijing: Science Press, 2011: 452. (in Chinese) 徐建国, 阚飙, 张建中, 等. 现场细菌学[M]. 北京: 科学出版社, 2011: 452. |
| [6] | Huard RC, de Oliveira Lazzarini LC, Butler WR, et al. PCR-based method to differentiate the subspecies of the Mycobacterium tuberculosis complex on the basis of genomic deletions[J]. J Clin Microbiol, 2003, 41(4): 1637–1650. DOI:10.1128/JCM.41.4.1637-1650.2003 |
| [7] | Telenti A, Marchesi F, Balz M, et al. Rapid identification of Mycobacteria to the species level by polymerase chain reaction and restriction enzyme analysis[J]. J Clin Microbiol, 1993, 31(2): 175–178. |
| [8] | Kim BJ, Lee KH, Park BN, et al. Differentiation of Mycobacterial species by PCR-restriction analysis of DNA (342 base pairs) of the RNA polymerase gene (rpoB)[J]. J Clin Microbiology, 2001, 39(6): 2102–2109. DOI:10.1128/JCM.39.6.2102-2109.2001 |
| [9] | Roth A, Reischl U, Streubel A, et al. Novel diagnostic algorithm for identification of Mycobacteria using genus-specific amplification of the 16S-23S rRNA gene spacer and restriction endonucleases[J]. J Clin Microbiol, 2000, 38(3): 1094–1104. |
| [10] | Zamarioli LA, Coelho AGV, Pereira CM, et al. Descriptive study of the frequency of nontuberculous mycobacteria in the Baixada santista region of the state of São Paulo, Brazil[J]. J Bras Pneumol, 2008, 34(8): 590–594. DOI:10.1590/S1806-37132008000800008 |
| [11] | Zhao XQ, Lian LL, Yi SL, et al. Identification of 51 clinical isolates suspicious of non-tuberculosis Mycobacteria in Hnnan province, China[J]. China Preventive Medicine, 2013, 14(3): 161–166. (in Chinese) 赵秀芹, 连璐璐, 易松林, 等. 湖南省51株疑似非结核分枝杆菌临床分离株的菌种鉴定[J]. 中国预防医学杂志, 2013, 14(3): 161–166. |
| [12] | Lian LL, Jiang Y, Zhao XQ, et al. Identification of 44 suspicious clinical isolates of non-tuberculosis Mycobacteria to species in Gansu, China[J]. Chinese Journal of Zoonoses, 2013, 29(4): 343–348. (in Chinese) 连璐璐, 姜元, 赵秀芹, 等. 44株甘肃疑似非结核分枝杆菌临床分离株的菌种鉴定[J]. 中国人兽共患病学报, 2013, 29(4): 343–348. |
| [13] | Ping GH, Yu M, Pan AZ, et al. The analysis of Mycobacterium tuberculosis pathogen spectrum in Ningbo, China[J]. Journal of Hygiene Research, 2014, 43(5): 849–850. (in Chinese) 平国华, 于梅, 潘爱珍, 等. 宁波地区非结核分枝杆菌病原谱的分析[J]. 卫生研究, 2014, 43(5): 849–850. |
| [14] | Huang MX, Wan KL, Chen LZ, et al. Distribution of non-tuberculous Mycobacteria of clinical Mycobacterium isolates from Fujian province, China[J]. Chinese Journal of Zoonoses, 2014, 30(12): 1227–1230. (in Chinese) 黄明翔, 万康林, 陈力舟, 等. 福建省临床分离非结核分枝杆菌菌种分布研究[J]. 中国人兽共患病学报, 2014, 30(12): 1227–1230. |
| [15] | Jing H, Wang Y, Li XX, et al. Distribution of non-tuberculous Mycobacteria in Shandong province[J]. Chinese Journal of Antituberculosis, 2009, 31(5): 273–276. (in Chinese) 景辉, 王燕, 李欣欣, 等. 山东省非结核分枝杆菌感染的菌种分布研究[J]. 中国防痨杂志, 2009, 31(5): 273–276. |
| [16] | Lian LL. Identification on species of nontuberculosis Mycobacterium clinical isolates from 8 provinces of China[D]. Hengyang: University of South China, 2013:23-26. (in Chinese) 连璐璐. 中国8省非结核分枝杆菌临床分离株的菌种鉴定[D]. 衡阳: 南华大学, 2013: 23-26. |
| [17] | Griffith DE, Aksamit T, Brown-Elliott BA, et al. An official ATS/IDSA statement: diagnosis, treatment and prevention of non-tuberculous Mycobacterial diseases[J]. Am J Respir Crit Care Med, 2007, 175(4): 367–416. DOI:10.1164/rccm.200604-571ST |
| [18] | Lian LL, Deng JP, Zhao XQ, et al. The first case of pulmonary disease caused by Mycobacterium septicum in China[J]. Int J Infect Dis, 2013, 17(5): 352–354. DOI:10.1016/j.ijid.2012.12.011 |
| [19] | Zong WK, Zhang XD, Wang HS, et al. The first case of cutaneous infection with Mycobacterium parascr of ulaceum[J]. Ther Clin Risk Manag, 2012, 8: 353–358. |
 2017, Vol. 32
2017, Vol. 32


