扩展功能
文章信息
- 徐小峰, 张仁庆, 马月, 吕燕, 黎建乐, 石强, 肖康, 孙静, 杨晓东, 董小平, 陈操
- XU Xiao-feng, ZHANG Ren-qing, MA Yue, LYU Yan, LI Jian-le, SHI Qiang, XIAO Kang, SUN Jing, YANG Xiao-dong, Dong Xiao-ping, CHEN Cao
- 羊瘙痒因子139A感染引起小鼠脑组织中的α1-ACT表达增加
- Remarkable up-regulation of α1-antichymotrypsin in brains of scrapie agent 139A infected mice
- 疾病监测, 2017, 32(4): 282-286
- Disease Surveillance, 2017, 32(4): 282-286
- 10.3784/j.issn.1003-9961.2017.04.007
-
文章历史
- 收稿日期:2017-01-20
2. 黑龙江八一农垦大学生命科学技术学院, 黑龙江 大庆 163000
2. College of Life Science and Technology, Heilongjiang Bayi Agricultural University, Daqing 163000, Heilongjiang, China
朊病毒病 (prion diseases) 是一类侵袭人类及哺乳动物中枢神经系统 (central nervous system,CNS) 的神经退行性疾病,潜伏期长,致死率100%[1]。目前认为朊病毒病是由一种不含核酸、具有自我复制能力的感染性蛋白粒子-朊病毒 (PrPSc) 所引起[2]。当机体感染PrPSc时,PrPSc会促使宿主细胞表面的PrPC转化为富含β折叠结构、具有部分蛋白酶K (proteinase K,PK) 抗性的聚集物并在细胞内沉积[3-4]。当PrPSc通过外周神经入侵到中枢神经系统时,会引发严重的神经退行性病变,导致大量神经元死亡,继而引发剧烈的炎症反应并最终导致宿主死亡[5]。朊病毒病中典型的神经病理学改变为脑组织中出现大量海绵状空泡样变性、淀粉样斑块沉积、神经元丢失和胶质细胞增生[6]。
α1-抗胰凝乳蛋白酶 (α1-ACT),属于丝氨酸蛋白酶抑制剂超家族成员[7],其主要功能是通过结合丝氨酸蛋白酶来抑制其活性,至今已发现大量α1-ACT的底物,如弹性蛋白酶、组织蛋白酶和颗粒酶等[8-10]。目前研究较多的聚焦于α1-ACT在阿尔茨海默病 (Alzherimer's disease,AD) 中的作用。研究发现在AD患者脑组织中α1-ACT可与β淀粉样蛋白 (amyloid β,Aβ) 相互作用形成特殊的复合物,促进Aβ斑块的形成,并使α1-ACT丧失抑制蛋白酶的活性,从而引发炎症反应[11]。相似的变化在朊病毒病中也有类似的报道,研究者在朊病毒感染患者的尿液中发现α1-ACT的含量明显上升[12],我们近期的蛋白质组学研究推测在羊瘙痒因子感染的啮齿类动物模型及散发型克雅病 (sCJD) 患者脑组织中α1-ACT明显上调[13],提示朊病毒感染脑组织中α1-ACT可能存在明显的变化并参与了朊病毒的致病机制作用。
为探究α1-ACT在朊病毒感染脑组织中是否增加,本研究以羊瘙痒因子139A感染的小鼠脑组织为研究对象,利用多种方法检测朊病毒感染后脑组织中α1-ACT的表达水平及在脑组织中的分布情况,并推测了α1-ACT增加的可能原因,为进一步了解朊病毒的致病机制提供科学依据。
1 材料与方法 1.1 实验材料实验用C57BL/6小鼠购自北京维通利华实验动物技术有限公司;139A接种毒株来自中国疾病预防控制中心病毒病预防控制所朊病毒病室保存;α1-ACT兔源多克隆抗体购自Cloud Clone Corp公司;C3鼠源单克隆抗体购自Abcam公司;β-actin鼠源单克隆抗体购自Subrray Biotechnology公司;辣根过氧化酶 (HRP) 标记的羊抗兔、羊抗鼠二抗均购自Thermo公司;Alexa Fluor® 568 goat anti-mouse IgG,Alexa Fluor® 488 goat anti-rabbit IgG荧光二抗购自Invitrogen公司;ECL试剂盒购自Perkin-Elmer公司;DAB购自博士德公司。
1.2 脑组织匀浆的制备依据出现临床症状、病理变化及死亡节点 (终末期)[21],选取羊瘙痒因子139A感染小鼠第0、86、117、147天和终末期第179天脑组织为检测样品,以同龄正常C57BL/6小鼠脑组织为对照,用裂解液 (100 mmol/L NaCl,10 mmol/L EDTA,0.5% Nonidet P-40,0.5% sodium deoxycholate,10 mmol/L Tris,pH 7.5含蛋白酶抑制剂) 制成10% (W/V) 的脑匀浆,2 000 g离心10 min后取上清分装,-80 ℃保存备用。
1.3 蛋白免疫印迹检测将蛋白样品变性处理后上样至12% SDS-PAGE电泳,半干转移至NC膜,室温下5%脱脂奶/TBST封闭1 h,α1-ACT兔多抗或β-actin鼠单抗 (1:200)4 ℃孵育过夜。次日TBST洗10 min×3次,加HRP标记的抗兔或抗鼠IgG二抗 (1:5 000) 室温孵育2 h,TBST洗10 min×3次。ECL显色,使用Image J软件进行定量分析。
1.4 免疫组织化学实验将制备的羊瘙痒因子139A感染小鼠终末期脑组织切片脱蜡至水,PBS洗3 min;滴加3%H2O2阻断内源性过氧化物酶活性;微波中高温修复抗原30 min,山羊血清封闭后滴加α1-ACT兔多抗 (1:100)4 ℃孵育过夜,次日PBS洗3 min,加羊抗兔IgG二抗,37 ℃孵育1 h,DAB显色,苏木素复染,中性胶封片,光镜下观察。
1.5 组织间接免疫荧光实验将制备的羊瘙痒因子139A感染小鼠终末期脑组织切片脱蜡至水,PBS洗3 min;用0.3% TritonX-100处理30 min,PBS洗3 min;山羊血清封闭后滴加α1-ACT多抗及C3多抗 (1:100) 4 ℃孵育过夜;次日PBS洗3 min,加荧光标记的抗兔及抗鼠IgG二抗 (1:200),室温孵育2 h,DAPI染色30 min;防荧光粹灭剂封片,激光共聚焦显微镜观察。
1.6 统计学处理实验重复3次以上,使用Image J软件扫描条带灰度,采用GraphPad Prism 6.0软件统计分析并作图,数据用均数±标准差 (x± s) 表示,两组间比较用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 羊瘙痒因子139A感染小鼠终末期脑组织中α1-ACT的表达水平显著上调为探究朊病毒感染后脑组织中α1-ACT水平是否上调,分别选取3只羊瘙痒因子139A感染终末期小鼠和3只正常对照C57BL/6小鼠,利用蛋白免疫印迹方法检测小鼠脑组织匀浆中α1-ACT的表达变化。结果显示,与对照相比较,3只羊瘙痒因子139A感染终末期的小鼠脑组织中α1-ACT的表达水平明显上调,见图 1A。定量数据分析结果显示,139A感染小鼠终末期脑组织中α1-ACT的相对灰度值明显高于对照组,差异有统计学意义 (P=0.003),见图 1B。利用间接免疫荧光试验发现,139A感染终末期小鼠脑组织中α1-ACT表达量明显高于对照组,见图 1C、D(P=0.027)。

|
| 图 1 羊瘙痒因子139A感染小鼠终末期脑组织中α1-ACT的表达水平 Figure 1 Comparison of α1-ACT expression in brains of scrapie agent 139A-infected mice at end stage 注:A. α1-ACT特异性蛋白免疫印迹;B.灰度值量化分析;C. α1-ACT特异性免疫荧光实验;D.免疫荧光试验荧光值量化分析;E. α1-ACT特异性免疫组织化学实验。 |
| |
为进一步分析增加的α1-ACT在朊病毒感染脑组织中的分布情况,分别制备了3只139A感染终末期小鼠及3只正常对照C57BL/6小鼠脑组织切片,并对其进行α1-ACT特异性免疫组织化学染色,检测结果显示在139A感染小鼠脑组织的皮层、丘脑和小脑区域可见大量广泛的α1-ACT特异性棕色斑点,而对照组中α1-ACT特异性斑点数量则较少,颜色也较淡,见图 1E,提示在皮层、丘脑和小脑区域中α1-ACT显著增加。
2.2 羊瘙痒因子139A感染过程中α1-ACT动态变化特点为评估朊病毒感染过程中α1-ACT的动态变化特点,分别选取了139A颅内感染小鼠后第0、86、117、147和179天的脑组织并制备脑匀浆,利用蛋白免疫印迹的方法检测不同时间点α1-ACT的表达水平;研究发现在139A感染后的第117天开始α1-ACT的表达水平明显上升,直至终末期 (第179天受感染小鼠死亡) 达到最高值,见图 2。
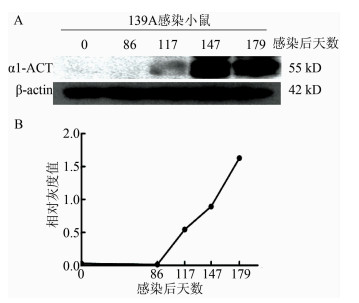
|
| 图 2 羊瘙痒因子139A感染小鼠脑组织不同时间点α1-ACT的表达水平 Figure 2 Dynamic analysis of α1-ACT expression in brains of scrapie agent 139A-infected mice 注:A. α1-ACT特异性蛋白免疫印迹;B. α1-ACT动态变化相对灰度值分析。 |
| |
α1-ACT作为一种丝氨酸蛋白酶抑制剂可作用于多种丝氨酸蛋白酶并使其活性丧失[8-10]。我们之前的研究发现,朊病毒感染动物脑组织中补体成分C3呈明显活化状态[14],为了探究α1-ACT表达增加与朊病毒感染之间的关系,制备了正常小鼠 (C57BL/6小鼠) 及羊瘙痒因子139A感染小鼠终末期脑组织切片,通过补体成分C3特异性间接免疫荧光试验发现在感染终末期小鼠脑组织切片中可见大量补体成分C3特异性红色荧光,而在对照组中则几乎无法看到红色荧光,见图 3A。数据分析显示感染终末期小鼠脑组织补体成分C3的光密度值较对照组明显增高,差异有统计学意义 (P=0.026),见图 3B。
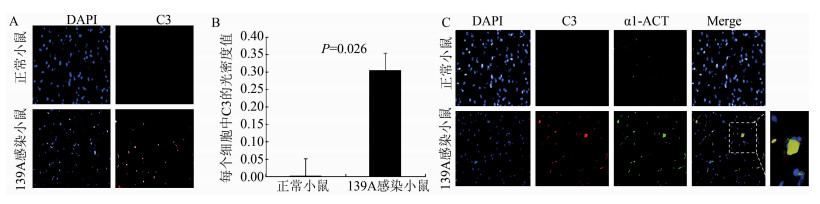
|
| 图 3 羊瘙痒因子139A感染小鼠终末期脑组织中α1-ACT与C3之间的潜在关系 Figure 3 Potential relationship between α1-ACT and C3 in brains of 139A-infected mice at end stage 注:A. C3特异性免疫荧光实验;B.免疫荧光实验荧光值量化分析;C. α1-ACT与C3特异性免疫荧光双染实验。 |
| |
为进一步探究补体成分C3和α1-ACT可能的潜在关系,我们利用补体成分C3和α1-ACT特异性抗体进行免疫荧光双染实验,利用荧光共聚焦显微镜观察发现在感染终末期小鼠脑组织中补体成分C3(红色) 和α1-ACT (绿色) 的表达量均明显增高。将两者重叠后发现大量α1-ACT与补体成分C3共定位的阳性细胞,见图 3C中的黄色细胞。
3 讨论本研究通过多种实验方法发现在羊瘙痒因子139A感染终末期小鼠脑组织中α1-ACT的表达水平明显增加,并且α1-ACT与补体系统成分C3存在共定位现象。已有研究发现在AD患者脑组织中的老年斑及星形胶质细胞周围发现大量增多的α1-ACT,甚至α1-ACT可以与毒性Aβ形成复合物[15]。有研究还发现α1-ACT不仅参与AD的致病过程还参与了其他神经退行性疾病的发生发展过程中[16-17]。研究数据显示,脑组织中α1-ACT增加可能是多种神经退行性疾病的共同特征。
基因芯片结果显示,α1-ACT的转录水平不仅在羊瘙痒因子感染小鼠模型脑组织中明显升高,在sCJD患者额枕皮质部也明显升高[12],提示朊病毒感染的不同种属动物脑组织中α1-ACT含量均明显升高。免疫组织化学实验证实,增加的α1-ACT主要分布在139A感染小鼠的皮层、丘脑和小脑,这些部位往往都存在严重的星形胶质细胞增生,这与之前研究结果相一致,即α1-ACT在中枢神经系统中主要由星形胶质细胞分泌[18],提示这些增加的α1-ACT主要由增殖的星形胶质细胞所分泌。
在朊病毒病患者[19]和朊病毒感染小鼠模型[20-21]中已发现多种促炎性因子的释放,如IL-1α、IL-1β、TNF-α和IL-6,其中IL-1、IL-6及TNF-α可以调控α1-ACT的表达[22-23]。如IL-1β可以促进人源星形胶质细胞U373-MG表达α1-ACT[24],同时也促进小鼠表达α1-ACT[25]。这些大量表达的α1-ACT会迅速地分泌到炎症部位,尽最大的能力抑制白细胞源蛋白酶活性,从而保护组织免受过强炎性反应的伤害[26]。因此推测朊病毒感染中α1-ACT含量的升高也可能是由IL-1α、IL-1β、TNF-α和IL-6等促炎性因子刺激而产生的。
我们近期研究发现,朊病毒感染过程存在大量补体成分的活化[14]。本研究通过间接免疫荧光实验也观察到了大量增加的补体成分C3。进一步通过荧光共聚焦显微镜观察发现α1-ACT与补体成分C3存在明显的共定位现象,提示朊病毒感染过程中补体成分C3明显活化可能与α1-ACT含量的增高具有相关性。而α1-ACT与C3是否存在直接的相互作用,α1-ACT含量增加是否影响补体级联反应以及α1-ACT在朊病毒病中具体发挥的作用,有待进一步的研究。
作者贡献:
徐小峰 ORCID:0000-0001-5498-4875
徐小峰:承担选题、试验、结果整理与数据分析并撰写论文
张仁庆、石强:参与部分试验和结果整理
马月、孙静:参与排除试验问题及结果分析
吕燕、黎建乐:参与部分试验方法及讨论
肖康:参与部分课题设计
杨晓东:参与部分结果分析
董小平:顶层设计、选定课题、提供研究思路
陈操:指导具体试验操作、解决试验困难、分析实验结果并帮助修改论文
| [1] | Alzualde A, Moreno F, Martínez-lage P, et al. Somatic mosaicism in a case of apparently sporadic Creutzfeldt-Jakob disease carrying a de novo D178N mutation in the PRNP gene[J]. Am J Med Genet B:Neuropsych Genet, 2010, 153B(7): 1283–1291. DOI:10.1002/ajmg.b.v153b:7 |
| [2] | Prusiner SB. Novel proteinaceous infectious particles cause scrapie[J]. Science, 1982, 216(4542): 136–144. DOI:10.1126/science.6801762 |
| [3] | Pan KM, Baldwin M, Nguyen J, et al. Conversion of alpha-helices into beta-sheets features in the formation of thescrapie prion proteins[J]. Proc Natl Acad Sci USA, 1993, 90(23): 10962–10966. DOI:10.1073/pnas.90.23.10962 |
| [4] | Huang ZW, Prusiner SB, Cohen FE. Scrapie prions:a three-dimensional model of an infectious fragment[J]. Fold Des, 1996, 1(1): 13–19. DOI:10.1016/S1359-0278(96)00007-7 |
| [5] | Walsh JG, Muruve DA, Power C. Inflammasomes in the CNS[J]. Nat Rev Neurosci, 2014, 15(2): 84–97. DOI:10.1038/nrn3638 |
| [6] | Colby DW, Prusiner SB. Prions[J]. Cold Spring Harbor Perspect Biol, 2011, 3(1): a006833. |
| [7] | Travis J, Salvesen GS. Human plasma proteinase inhibitors[J]. Ann Rev Biochem, 1983, 52: 655–709. DOI:10.1146/annurev.bi.52.070183.003255 |
| [8] | Horvath AJ, Irving JA, Rossjohn J, et al. The murine orthologue of human antichymotrypsin:a structural paradigm for clade A3 serpins[J]. J BiolChem, 2005, 280(52): 43168–43178. |
| [9] | Sipione S, Simmen KC, Lord SJ, et al. Identification of a novel human granzyme B inhibitor secreted by cultured sertoli cells[J]. J Immunol, 2006, 177(8): 5051–5058. DOI:10.4049/jimmunol.177.8.5051 |
| [10] | Gettins PGW. Serpin structure, mechanism, and function[J]. Chem Rev, 2002, 102(12): 4751–4804. DOI:10.1021/cr010170+ |
| [11] | Janciauskiene S, Wright HT. Inflammation, antichymotrypsin, and lipid metabolism:autogenic etiology of Alzheimer's disease[J]. Bio Essay, 1998, 20(12): 1039–1046. |
| [12] | Miele G, Seeger H, Marino D, et al. Urinary α1-antichymotrypsin:a biomarker of prion infection[J]. PLoS One, 2008, 3(12): e3870. DOI:10.1371/journal.pone.0003870 |
| [13] | Chen C, Xiao D, Zhou W, et al. Global protein differential expression profiling of cerebrospinal fluid samples pooled from Chinese sporadic CJD and non-CJD patients[J]. Mol Neurobiol, 2014, 49(1): 290–302. DOI:10.1007/s12035-013-8519-2 |
| [14] | Lyu Y, Chen C, Zhang BY, et al. Remarkable activation of the complement system and aberrant neuronal localization of the membrane attack complex in the brain tissues of scrapie-infected rodents[J]. Mol Neurobiol, 2015, 52(3): 1165–1179. DOI:10.1007/s12035-014-8915-2 |
| [15] | Nilsson LN, Bales KR, Dicarlo G, et al. Alpha-1-antichymotrypsin promotes beta-sheet amyloid plaque deposition in a transgenic mouse model of Alzheimer's disease[J]. J Neurosci, 2001, 21(5): 1444–1451. |
| [16] | Yamamoto M, Kondo I, Ogawa N, et al. Genetic association between susceptibility to Parkinson's disease and α1-antichymotrypsin polymorphism[J]. Brain Res, 1997, 759(1): 153–155. DOI:10.1016/S0006-8993(97)00330-2 |
| [17] | Furiya Y, Hirano M, Kurumatani N, et al. α-1-antichymotrypsin gene polymorphism and susceptibility to multiple system atrophy (MSA)[J]. Mol Brain Res, 2005, 138(2): 178–181. DOI:10.1016/j.molbrainres.2005.04.011 |
| [18] | Mucke L, Yu GQ, Mcconlogue L, et al. Astroglial expression of human α1-antichymotrypsin enhances alzheimer-like pathology in amyloid protein precursor transgenic mice[J]. Am J Pathol, 2000, 157(6): 2003–2010. DOI:10.1016/S0002-9440(10)64839-0 |
| [19] | Sharief MK, Green A, Dick JPR, et al. Heightened intrathecal release of proinflammatory cytokines in Creutzfeldt-Jakob disease[J]. Neurology, 1999, 52(6): 1289–1291. DOI:10.1212/WNL.52.6.1289 |
| [20] | Campbell IL, Eddleston M, Kemper P, et al. Activation of cerebral cytokine gene expression and its correlation with onset of reactive astrocyte and acute-phase response gene expression in scrapie[J]. J Virol, 1994, 68(4): 2383–2387. |
| [21] | Kordek R, Nerurkar VR, Liberski PP, et al. Heightened expression of tumor necrosis factor alpha, interleukin 1 alpha, and glial fibrillary acidic protein in experimental Creutzfeldt-Jakob disease in mice[J]. Proc Natl Acad Sci USA, 1996, 93(18): 9754–9758. DOI:10.1073/pnas.93.18.9754 |
| [22] | Cichy J, Potempa J, Chawla RK, et al. Stimulatory effect of inflammatory cytokines on alpha 1-antichymotrypsin expression in human lung-derived epithelial cells[J]. J ClinInvestigat, 1995, 95(6): 2729–2733. |
| [23] | Cichy J, Potempa J, Chawla RK, et al. Regulation of α1-antichymotrypsin synthesis in cells of epithelial origin[J]. FEBS Lett, 1995, 359(2/3): 262–266. |
| [24] | Gitter BD, Boggs LN, May PC, et al. Regulation of cytokine secretion and amyloid precursor protein processing by proinflammatory amyloid beta (Aβ)[J]. A New York Acad Sci, 2000, 917: 154–164. |
| [25] | Morihara T, Teter B, Yang FS, et al. Ibuprofen suppresses interleukin-1β induction of pro-amyloidogenic α1-antichymotrypsin to ameliorate β-amyloid (Aβ) pathology in Alzheimer's models[J]. Neuro psychopharmacology, 2005, 30(6): 1111–1120. DOI:10.1038/sj.npp.1300668 |
| [26] | Baker C, Belbin O, Kalsheker N, et al. SERPINA3(aka alpha-1-antichymotrypsin)[J]. Front Biosci, 2007, 12: 2821–2835. DOI:10.2741/2275 |
 2017, Vol. 32
2017, Vol. 32


