Influence of storage time of blood samples on detection of CD4+T lymphocyte
ZHANG Shu, BIAN Guo-lin, NI Hong-xia, GAO Hong, XU Guo-zhang
Ningbo Center for Disease Control and Prevention, Ningbo 315010, Zhejiang, China
Abstract
Objective To understand the influence of storage time on quantitative detection of CD4+T lymphocyte with whole blood samples. Methods Twelve whole blood samples were collected from HIV-1 infected persons and stored at 4-8℃. The absolute numbers of CD4+ were detected every 24 hours from day 1 to day 6 after sampling with flow cytometer, four color fluorescence monoclonal antibody reagent and COULTER EPICS XL. The results were analyzed with SPSS 13.0 software. Results Compared with the quantitative detection result of CD4+ on sample collection day, the average number of CD4+ declined by 14.583/μl 24 hours later, 22.083/μl 48 hours later, 49/μl 72 hours later, 53.417/μl 96 hours later and 88/μl 120 hours later. The difference on the detection results between the sample collection day and 24 hours later had no statistical significance (P=0.09), but the differences on other detection results had statistical significance (P<0.05). Conclusion The detection result of CD4+ in blood samples (stored at 4-8℃) is reliable if the detection is completed within 24 hours or no more than 48 hours. The longer the samples are stored, the more CD4+T lymphocyte decline
血样保存时间对CD4+T淋巴细胞检测的影响分析
张姝, 边国林, 倪红霞, 高红, 许国章
宁波市疾病预防控制中心, 浙江 宁波 315010
摘要
目的 了解保存不同时间对全血样品定量检测T淋巴细胞的影响情况。 方法 收集12份HIV感染者的抗凝全血,于4~8℃条件下保存,采用流式细胞仪、四色荧光抗体试剂和计数微球,在采血当日和采血后5 d每隔24 h定期检测CD4+T淋巴细胞绝对值,并用SPSS 13.0软件分析数据。 结果 与采血当日CD4+T淋巴细胞定量检测结果比较,采血后24、48、72、96、120 h的检测结果平均下降了14.583、22.083、49、53.417、88个/μl,其中采血后24 h的结果与采血当日比较差异无统计学意义(P=0.09),其他差异均有统计学意义(P<0.05)。 结论 在4~8℃保存条件下,进行T淋巴细胞定量检测的全血样品最好在采血后24 h内完成检测,检测结果较为可靠,最迟不要超过48 h,保存时间越长, CD4+T淋巴细胞值下降得越多。
内容大纲
-
1 材料与方法
2 结果
- 2.1 CD+4淋巴细胞绝对计数情况
- 2.2 血样保存不同时间的CD+4淋巴细胞检测值变化率
- 2.3 不同保存时间的检测值的统计分析
美国公共卫生署建议:HIV感染者应每隔3~6个月对CD+4T淋巴细胞水平进行监控 [2]。HIV感染者需要定期检测CD+4T淋巴细胞值,但是该项检测所需仪器和试剂昂贵且操作复杂,未能在医疗机构普遍开展,一般是集中到定点机构集中进行检测,待检的新鲜抗凝全血样品不可能在采后立即检测,而血样的CD+4T淋巴细胞值会随保存时间的延长而产生变化,因此,需要了解血样能存放的时间。探索在不影响检测结果前提下的血样保存最长时限,为准确检测CD+4T淋巴细胞提供参考标准,以保证结果的准确性和可靠性。
1 材料与方法
1.1 样本来源
HIV感染者定期由随访工作人员采集全血送到实验室进行CD+4淋巴细胞检测,随机选取了余姚市送检的12份HIV感染者的全血样本,这些感染者均经新加坡产的HIV确认试剂Genelabs HIV BLOT2.2确认为HIV阳性。
1.2 试剂与仪器
试剂采用贝克曼公司的四色荧光标记单克隆抗体CD4/CD8/CD3/CD45;绝对计数试剂为FLOWCOUNT;质控血为IMMUNOTROL;光路校准试剂为FLOWCHECK。自制ABC溶血液(A液:甲酸1.2 ml/L;B液:碳酸钠6.0 g/L、氯化钠14.5 g/L、硫酸钠31.3 g/L;C液:多聚甲醛10.0 g/L)。仪器使用美国贝克曼公司的COULTER EPICS XL型流式细胞仪和COULTER Q-PREP溶血仪。
1.3 方法
1.3.1 样本处理
采集外周静脉血5 ml,用EDTA抗凝,置普通冰箱4~8 ℃冷藏保存,在采血后5 d内不同时间进行检测。检测分别为采血后5(相当于采血后即时检测)、24、48、72、96、120 h。分别向试管中加入10 μl CD4/CD8/CD3/CD45四色荧光抗体和100 μl全血,混匀后室温避光保存20 min,在溶血仪上溶血后加入100 μl FLOWCOUNT荧光计数球,避光待检。质控取100 μl质控血IMMUNOTROL,其他步骤同上。
1.3.2 上机检测
用FLOWCHECK校准光路,使所有荧光信号的变异系数(CV)均小于2%。CD45淋巴细胞设门,计数5000个淋巴细胞后记录样本的CD+4淋巴细胞绝对计数。每次检测都用IMMUNOTROL质控血监测试验的重复性和准确性。
1.4 统计分析
应用SPSS 16软件包 中 GLM(一般线性模型)的Repeated Measures过程对不同保存时间CD+4T淋巴细胞检测值进行重复测量方差分析,通过球形检验(Mauchly’S Test of Sphericity)的结果判断重复测量数据之间是否存在相关性, P<0.05时使用Greenhouse-Geisser校正。并对不同时间点的测量数据与基线进行两两比较,统计各组检测数据之间的差异程度,P≤0.05时差异有统计学意义。
2 结果
2.1 CD+4淋巴细胞绝对计数情况
12份HIV感染者血样以1~12进行编号,在采血后分别进行6次CD+4淋巴细胞检测,检测时间为采血后5、24、48、72、96、120 h。同一病例6次检测结果均数分布在172~461个/μl之间不等,其中最低为 118个/μl,最高为530个/μl。各分组的具体检测数及均值见表1(CD+4淋巴细胞检测值单位为个/μl)。
表1 12份HIV感染者血样保存不同时间的CD+4淋巴细胞检测值
Table 1 CD+4 number in 12 HIV infected blood samples at different storage time
| 编号 | 5 h | 24 h | 48 h | 72 h | 96 h | 120 h | 均数 | 标准差 | 变异系数 |
| 1 | 237 | 206 | 219 | 219 | 209 | 203 | 216 | 12 | 5.8 |
| 2 | 221 | 236 | 236 | 215 | 200 | 195 | 217 | 17 | 8.0 |
| 3 | 530 | 474 | 482 | 437 | 461 | 383 | 461 | 49 | 10.6 |
| 4 | 290 | 324 | 272 | 250 | 220 | 224 | 263 | 40 | 15.3 |
| 5 | 343 | 322 | 320 | 286 | 286 | 276 | 306 | 27 | 8.7 |
| 6 | 351 | 324 | 308 | 278 | 277 | 267 | 301 | 33 | 10.9 |
| 7 | 471 | 444 | 399 | 384 | 371 | 304 | 396 | 59 | 14.8 |
| 8 | 224 | 240 | 233 | 211 | 214 | 187 | 218 | 19 | 8.6 |
| 9 | 200 | 191 | 186 | 186 | 150 | 118 | 172 | 31 | 18.3 |
| 10 | 462 | 424 | 423 | 374 | 362 | 311 | 393 | 54 | 13.8 |
| 11 | 333 | 345 | 330 | 311 | 296 | 245 | 310 | 36 | 11.7 |
| 12 | 457 | 414 | 446 | 380 | 432 | 350 | 413 | 41 | 9.9 |
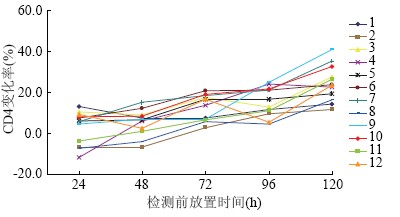
2.2 血样保存不同时间的CD+4淋巴细胞检测值变化率
把采血后5 h的CD+4淋巴细胞检测值作为即时检测值,将后面5次的检测值分别与其进行比较,算出血样保存不同时间检测值的变化率。该次检测值变化率计算公式为(采血后5 h检测值-该次检测值)/采血后5 h检测值。从图1可以看出,淋巴细胞检测值变化率随着保存时间的增加而增大。在冷藏保存条件下,血样保存24 h后检测值变化率基本在10%以内,而保存5 d即120 h后,检测值变化率基本在20%以上,最高的高达41%。
图1 保存不同时间的CD+4淋巴细胞检测值变化率
Figure 1 Change rate of CD+4 number at different storage time
2.3 不同保存时间的检测值的统计分析
经统计分析,各组时间的CD+4T淋巴细胞检测值间差异有统计学意义(F=28.593,P=0.000)。将采血后24、48、72、96、120 h的CD+4T淋巴细胞定量检测结果分别与采血当日值比较,其中采血后24 h的结果与采血当日值比较差异无统计学意义(P=0.099), 其他时间检测值较采血当日值的差异均有统计学意义(P<0.05),见表2。采血后24、48、72、96、120 h的检测结果平均下降了14.583、22.083、49、53.417、88个/μl。
表2 不同保存时间的检测值的统计分析
Table 2 Statistical analysis of detection result at different storage time
| 参数 | 24 h | 48 h | 72 h | 96 h | 120 h |
| 5 h | |||||
| F | 3.265 | 9.446 | 25.424 | 37.797 | 41.911 |
| P | 0.098 | 0.011 | 0.000 | 0.000 | 0.000 |
3 讨论
T淋巴细胞是机体免疫系统功能最重要的一群淋巴细胞,主要由CD+4和CD+8两群细胞组成。CD+4为辅助T淋巴细胞,是HIV感染的最主要靶细胞,其数量和功能的降低是HIV感染引起人体免疫功能缺陷的主要原因。外周血中CD+4 T淋巴细胞的绝对值对于HIV感染状况,疾病分期,预测其机会性感染的可能性和评价治疗效果具有极其重要的作用 。
因此CD+4T淋巴细胞计数是作为直接测定免疫功能的方法,也是反映HIV感染者免疫系统损害状况最明确的指标[5]。《国家免费艾滋病抗病毒药物治疗手册(第2版)》的治疗标准依据也是CD+4T淋巴细胞值。因此CD+4T淋巴细胞检测数据的准确性和可靠性对HIV感染者和对其的管理都非常重要。在现实中,由于检测所需仪器和试剂昂贵且操作复杂等条件限制,病例血样不可能在采集后立即检测,往往都要保存一段时间后统一批量检测,那么保存多长时间不影响检测值是关键。
卢秀杰等[6]认为同一样本放置8~96 h检测的数据差异<20%,为可接受范围。而本次研究结果认为血样采集后在冷藏条件下,最好在24 h内上机检测,检测结果与采血后立即检测值相同(差异无统计学意义),若受条件限制,最晚也不要超过48 h,否则,检测结果与真实值有偏差。WHO 1997年发行了CD+4淋巴细胞检测规范,要求在室温条件下检测CD+4T淋巴细胞数时,要在48 h之内完成[7]。肖瑶等[8]研究结果提示抗凝全血存放4 ℃也是检测不能超过48 h。以上资料数据与本次研究结果相符。通过这次研究,探索了血样保存的时限,为准确检测CD+4T淋巴细胞提供了参考依据。但本次研究由于检测病例数较少(有12例),在代表性上有一定局限性,应在以后的研究中扩大样本量再做进一步探索。
参考文献
[1] Carre N, Boufassa F,Bubert JB,et al.Predictive value of viral load and other markers for progression to clinical AIDS after CD4 cell count falls below 200/microl.SEROCO & HEMOCO Study Group[J].Int J Epidemiol,1998,27(5):897-903.
[2] CDC. 1995 revised guidelines for prophylaxis against Pneumocystis carinii pneumonia for children infected with or perinatally exposed to human immunodeficiency virus[J].MMWR,1995,44(No.RR-4):1-11.
[3] Fuchs M,Stadler BM,Malinverni R,et al.Relationship between T-subsets and clinical aspects of HIV associated disease[J].Schweiz Med Wochenschr,1991,121(3):57-66.
[4] Ehmann WC,Eyster SE. Relationship of CD4 lymphocyte counts to survial in a cohort of hemophiliacs infected with HIV.Multicenter Hemophilia Cohort Study[J].J Acquir Immune Defic Syndr,1994:1095-1098.
[5] Gugnani H, Fisher MC, Paliwal-Johsi A, et al. Role of cannomys badius as a natural animal host of penicillium marneffei in India[J].J Clin Microlbiol,2004,42(11):5070-5075.
[6] Lu XJ, Guo XL, Yang X. Influence of storage time of blood samples on CD4+T lymphocyte quantitative detection [J]. Chinese Journal of Health Laboratory Technology,2008,18 (7):1370-1371. (in Chinese) 卢秀杰,郭晓黎,杨旭.血样采集后放置不同时间对CD4+T淋巴细胞计数的影响[J].中国卫生检验杂志,2008,18(7):1370-1371.
[7] Nicholson JKA,Jones BM,Cross D,et al.Comparison of T and B cell analysis on fresh and aged blood[J].J Immunol Methods,1984,73:29-40.
[8] Xiao Y, Zhang GY, Pei LJ, et al. Influence of storage temperature and time on detection of CD4+, CD8+ in peripheral blood of HIV infected persons [J]. Chinese Journal of Experimental and Clinical Virology,2004,18 (2):129-131.(in Chinese) 肖瑶,张桂云,裴丽健,等.存放温度及时间对于HIV/AIDS患者外周血CD4+、CD8+细胞测定结果的影响[J].中华实验和临床病毒学杂志,2004,18(2):129-131.
[2] CDC. 1995 revised guidelines for prophylaxis against Pneumocystis carinii pneumonia for children infected with or perinatally exposed to human immunodeficiency virus[J].MMWR,1995,44(No.RR-4):1-11.
[3] Fuchs M,Stadler BM,Malinverni R,et al.Relationship between T-subsets and clinical aspects of HIV associated disease[J].Schweiz Med Wochenschr,1991,121(3):57-66.
[4] Ehmann WC,Eyster SE. Relationship of CD4 lymphocyte counts to survial in a cohort of hemophiliacs infected with HIV.Multicenter Hemophilia Cohort Study[J].J Acquir Immune Defic Syndr,1994:1095-1098.
[5] Gugnani H, Fisher MC, Paliwal-Johsi A, et al. Role of cannomys badius as a natural animal host of penicillium marneffei in India[J].J Clin Microlbiol,2004,42(11):5070-5075.
[6] Lu XJ, Guo XL, Yang X. Influence of storage time of blood samples on CD4+T lymphocyte quantitative detection [J]. Chinese Journal of Health Laboratory Technology,2008,18 (7):1370-1371. (in Chinese) 卢秀杰,郭晓黎,杨旭.血样采集后放置不同时间对CD4+T淋巴细胞计数的影响[J].中国卫生检验杂志,2008,18(7):1370-1371.
[7] Nicholson JKA,Jones BM,Cross D,et al.Comparison of T and B cell analysis on fresh and aged blood[J].J Immunol Methods,1984,73:29-40.
[8] Xiao Y, Zhang GY, Pei LJ, et al. Influence of storage temperature and time on detection of CD4+, CD8+ in peripheral blood of HIV infected persons [J]. Chinese Journal of Experimental and Clinical Virology,2004,18 (2):129-131.(in Chinese) 肖瑶,张桂云,裴丽健,等.存放温度及时间对于HIV/AIDS患者外周血CD4+、CD8+细胞测定结果的影响[J].中华实验和临床病毒学杂志,2004,18(2):129-131.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 张姝 | |
| 边国林 | |
| 倪红霞 | |
| 高红 | |
| 许国章 | |
| PubMed | |
| Article by ZHANG Shu | |
| Article by BIAN Guo-lin | |
| Article by NI Hong-xia | |
| Article by GAO Hong | |
| Article by XU Guo-zhang | |