Etiological diagnosis of the first case of brucellosis in Tongxiang
ZHANG Hong-fang1, WANG Heng2, YAN Zhuo-lin1, YANG Li-qun1, QIAN Hua1, SHEN Mei-qing1, LIU Jian1
Tongxiang City Center for Disease Control and Prevention, Tongxiang 314500, Zhejiang, China
Abstract
Objective To understand the etiological characteristics of brucellosis and provide evidence for the diagnosis, treatment and control of brucellosis. Methods Blood samples collected from suspected brucellosis cases in Tongxiang to conduct rose-bengal plate agglutination test (RBPT) and standard tube agglutination test (SAT).The blood samples were taken from the positive persons to conduct bacterium enrichment by using biphasic blood culture bottles and further identification of the specie/type was conducted by using BCSP31-PCR and AMOS-PCR. Results One brucellosis case infected with Brucella melitensis biovar 3 was detected, the serum SAT result was 1:3200 (++). Epidemiological investigation and standard treatment was carried out for the patient. Conclusion The case was infected with Brucella melitensis biovar 3. It is suggested to conduct blood culture for the patient suffered from long time fever with unknown origin for the early detection and treatment of brucellosis.
浙江省桐乡市首例布鲁氏菌病原学诊断病例调查
张红芳1, 王衡2, 严卓琳1, 杨利群1, 钱华1, 沈美清1, 刘建1
1. 桐乡市疾病预防控制中心,浙江 桐乡314500;
2. 浙江省布鲁氏菌病防治中心
2. 浙江省布鲁氏菌病防治中心
摘要
目的 分离和鉴定布鲁氏菌,提高对布鲁氏菌病(布病)的认识,为病例的诊断和治疗提供依据。 方法 采集浙江省桐乡市疑似布病患者血液标本,进行虎红平板凝集试验(rose-bengal plate agglutination test,RBPT)和试管凝集试验(standard tube agglutination test,SAT),血清学阳性者采血接种双相血培养瓶增菌培养,获得纯培养者进一步采用布鲁氏菌属特异性PCR(BCSP31-PCR)和布鲁氏菌种型特异性PCR(AMOS-PCR)进行属和种/型鉴定。对患者进行个案流行病学调查和规范治疗。 结果 患者血清SAT为1:3200(++),从血液中分离出羊种布鲁氏菌3型。患者用利福平、多西环素等联合6周治疗后痊愈。 结论 该病例为羊种布鲁氏菌实验室确诊病例,建议临床上对长期不明原因发热者应及时进行血培养,早发现并规范治疗。
内容大纲
-
1 材料与方法
- 1.1 调查方法
- 1.2 材料
- 1.3 血清学检测
- 1.4 细菌分离培养与传统生物分型鉴定
- 1.5 布鲁氏菌PCR属、种/型鉴定
- 1.5.1 DNA提取
- 1.5.2 BCSP31-PCR法鉴定布鲁氏菌属
- 1.5.3 AMOS-PCR法鉴定布鲁氏菌种/型
- 2.1 基本情况
- 2.2 布病血清学检测结果
- 2.3 布鲁氏菌分离与传统生物分型鉴定结果
- 2.4 布鲁氏菌属PCR鉴定结果
- 2.5 布鲁氏菌种/型AMOS-PCRPCR鉴定结果
- 2.6 流行病学调查情况
- 2.7 治疗与转归
1 材料与方法
1.1 调查方法桐乡市级医疗单位对有发热、出汗、关节痛等症状,并与牛、羊等牲畜或畜产品接触的从业人员,采血分离血清做虎红平板凝集试验(rose-bengal plate agglutination test,RBPT)、试管凝集试验(standard tube agglutination test,SAT),阳性者再进行血培养分离布鲁氏菌。同时开展流行病学调查,并填写《布病流行病学个案调查表》。
1.2 材料
双相血培养瓶购自生物梅里埃公司。虎红凝集抗原、试管凝集试验抗原、对照血清、噬菌体、单项特异(A、M、R)血清(均在有效期内使用),均由中国疾病预防控制中心(CDC)传染病预防控制所提供。
1.3 血清学检测
采集患者静脉血5 ml,分离血清。采用RBPT和SAT 进行布病血清学检测,并采用阳性血清对照。
1.4 细菌分离培养与传统生物分型鉴定
在抗布病治疗前,无菌采集患者血液标本5 ml,直接注入双相血培养瓶中,37 ℃培养进一步鉴定[2]。
1.5 布鲁氏菌PCR属、种/型鉴定
1.5.1 DNA提取
对TX2012-1分离株挑取菌落接种于布鲁氏菌琼脂平板培养48 h后采用BioFlux 细菌基因组DNA提取试剂盒,按照说明书操作提取细菌核酸。
1.5.2 BCSP31-PCR法鉴定布鲁氏菌属
引物:B4:5′-TGG CTC GGT TGC CAA TAT CAA-3′;B5:5′-CGC GCT TGC CTT TCA GGT CTG-3′,B4和B5扩增片段大小为223 bp。反应体系:25 μl:10×Buffer(Mg2+ 1.5 mol/L)2.5 μl;dNTP(2.5 mmol/L)2 μl;Taq DNA聚合酶(2.5 U/μl) 0.8 μl;primer B4、B5(10 pmol/μl)各0.5 μl;DNA 1 μl。扩增程序:95 ℃预变性 5 min;95 ℃ 1 min,62 ℃1 min,72 ℃ 1 min;共40个循环,最后72 ℃延伸5 min。然后琼脂糖凝胶电泳,染色成像。具体参照文献[3]进行。
1.5.3 AMOS-PCR法鉴定布鲁氏菌种/型
引物:A:5′-GAC GAA CGG AAT TTT TCC AAT CCC-3′;M:5′-AAA TCG CGT CCT TGC TGG TCT GA-3′;O:5′-CGG GTT CTG GCA CCA TCG TCG-3′;S:5′-GCG CGG TTT TCT GAA GGT TCA GG-3′;及共同引物IS711:5′-TGC CGA TCA CTT AAG GGC CTT CAT- 3′,扩增片段大小依次为498、731、285、961 bp;反应体系:25 μl:加入10×buffer(Mg2+1.5 mol/L)2.5 μl;dNTP(2.5 mmol/L)2 μl;Taq DNA聚合酶(2.5 U/L) 0.8 μl;primer IS711(10 pmol/μl)1 μl;primerA、M、O、S (10 pmol/μl)各0.4 μl; DNA 1 μl。扩增程序:95 ℃预变性5 min; 95 ℃,1 min,60 ℃ 1 min,72 ℃ 1 min;共40个循环,最后72 ℃延伸5 min。然后琼脂糖凝胶电泳,染色成像。引物均由上海生物工程公司合成。具体方法参照文献 进行。
2 结果
2.1 基本情况 患者,女性,49岁,桐乡市本地人。于2012年6月初出现发热,最高达39.5 ℃、午后加重。夜间盗汗严重,全身及被褥湿透,有肌肉酸痛、腰痛,翻身活动障碍等症状。以“风湿热、发热待查”收入桐乡市某医院,入院血常规:白细胞4.9×109/L,B超示肝脾肿大。青霉素等抗菌治疗,未见明显好转。
2.2 布病血清学检测结果
RBPT呈强阳性, SAT效价 1 ∶ 3200 + +。
2.3 布鲁氏菌分离与传统生物分型鉴定结果
培养至第8天,双相血培养瓶琼脂斜面长出针尖大、半透明、露滴状菌落, 对疑似菌落涂片革兰染色,发现 有弱着色的细小革兰阴性球杆菌,呈细短小杆菌状; H2S-;单项特异性血清血清凝集A+、M+、R-;噬菌体裂解试验:Tb-、Tb(104RTD)-、BK2+、WB-。鉴定为羊种布鲁氏菌生物3型。
2.4 布鲁氏菌属PCR鉴定结果
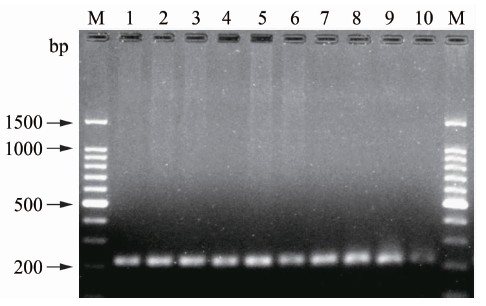
TX2012-1菌株核酸与浙江省羊种布鲁氏菌3型历史菌株ZJ2011-1~7和牛种布鲁氏菌、犬种布鲁氏菌核酸经BCSP31-PCR扩增, 产物经1.8%琼脂糖电泳检测, 结果10株分离菌株均出现分子质量大小为223 bp的特异条带, 结果见图1。
图1 BCSP31-PCR扩增结果
Figure 1 Amplification result of BCSP31-PCR 注:M:Marker;1~7:ZJ2011-1~ZJ2011-7; 8:TX2012-1; 9:牛种布鲁氏菌; 10:犬种布鲁氏菌。
2.5 布鲁氏菌种/型AMOS-PCRPCR鉴定结果
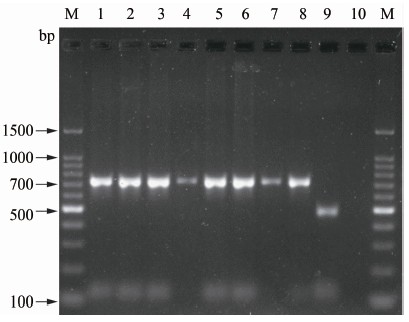
AMOS-PCR 对TX2012-1等10株菌核酸进行检测, 产物经1.8%琼脂糖电泳检测, 结果TX2012-1分离菌株与历史菌株ZJ2011-1~7共8株菌均出现分子量大小为731 bp的特异条带, 牛种布鲁氏菌出现498 bp的特异条带,犬种菌未检出特异性条带,结果见图2。
图2 AMOS-PCR扩增结果
Figure 2 Amplification result of AMOS-PCR 注:M:Marker; 1~7:ZJ2011-1~ZJ2011-7; 8:TX2012-1; 9:牛种布鲁氏菌; 10:犬种布鲁氏菌。
2.6 流行病学调查情况
桐乡市位于浙江省北部,近年来随着经济的发展和人们饮食结构的变化,全市兴建了5家简易的羊交易屠宰市场,而且羊的种类除本地湖羊外,也大量引进外地肉山羊。病例所在的羊交易屠宰市场,多有从北方引进肉山羊进行交易,或从外地购入羊羔和胎盘进行出售等情况,而且交易的外地羊未经过有效检疫,从业人员存在布病患病风险。患者从事羊交易和宰杀工作近20年,每年平均交易和宰杀羊600头左右。以前以宰杀本地湖羊羔为主,但近两年宰杀和交易一些来自山东省、河北省等地引进的羊,也有流产死羊羔等情况。在宰杀和交易过程中未采取穿戴橡胶手套等防护措施。屠宰和交易现场环境脏乱,场所和工具未做消毒处理。
2.7 治疗与转归
患者经用利福平、多西环素等联合6周治疗后,血细菌培养转阴,布病症状、体征消失,临床治愈。
3 讨论
布病流行于世界各地,我国多见于内蒙古、东北、西北等牧区。近年流行区域南移,南方各省均不同程度发现有人、畜布病感染,全国布病疫情呈快速上升趋势[6]。
桐乡市作为布病的非疫区,历史上无人、畜布病记载。但近年来随着经济的发展和人们饮食结构的变化,羊交易市场的羊只不仅交易量增加,而且羊的种类除本地湖羊外,也大量引进北方各省的肉山羊、羊羔和胎盘进行交易出售。由于肉山羊交易周转过程时间短,无法进行有效的检疫,致使病羊输入情况时有发生,造成与肉山羊、羊羔和胎盘密切接触的从业人员感染布鲁氏菌而发病。
由于布病血清抗体与其他疾病有交叉凝集现象,存在假阳性情况,布鲁氏菌的分离则是布病最可靠的实验室诊断依据。此次分离的菌株经鉴定为羊种布鲁氏菌。AMOS-PCR 鉴定与传统方法结果符合。本实验中TX2012-1和ZJ2011-1~7共8株菌经AMOS-PCR检测结果为羊种布鲁氏菌, 与传统方法检测结果完全一致。此次分离的羊种3型布鲁氏菌,也是我国目前主要引起病情的优势病原菌[7] 。
本病例主要从事羊羔的交易和宰杀工作,近年来由于本地湖羊养殖量下降和市场需求增加,宰杀一些来自牧区的羊羔,其中也有流产或死羊羔等情况。在宰杀过程中未采取防护措施,作业场所和工具未做消毒处理,可能通过直接接触而感染。 因此,在我国南方既往无布病疫情地区也应进一步加大对外来牲畜检疫的力度,做好重点职业人群的监测。加强对重点行业、重点人群布病防治知识的健康教育。在临床诊治过程中,对一些与动物有密切接触史的发热患者应重视布病的血清学诊断和布鲁氏菌的血培养检查,尽早发现并规范治疗。
PCR鉴定布鲁氏菌多有报道,与布鲁氏菌的经典鉴定方法结果很吻合。由于布鲁氏菌是高致病性病原微生物,实验中有气溶胶感染风险,如果采用提取核酸鉴定会大大减少危险操作,建议在布鲁氏菌的鉴定方法中设为标准实验方法。
( 志谢: 本文承蒙中国疾病预防控制中心传染病预防控制所崔步云研究员指导,表示感谢!)
参考文献
[1] Zhao YL,Wang DL, Gang SL. 2005-2006 Brucellosis national monitoring report[J]. Chinese Journal of control of Endemic disease,2008,23(1):38-40.(in Chinese) 赵永利,王大力,冮森林.2005-2006年布氏菌病全国监测报告[J].中国地方病防治杂志,2008,23(1):38-40.
[2] Disease Prevention and Control Bureau of the Ministry of Health. Brucellosis Control Handbook[M].Beijing: People's Health Publishing House,2008.(in Chinese) 卫生部疾病预防控制局.布鲁氏菌病防治手册[M].北京:人民卫生出版社,2008.
[3] Li LY,Qiu HY,et al. Shang DQ. A study on the PCR about primers of 31 KDa,protein gene for Brucellosis[J]. Chinese Journal of Control of Endemic Disease,2000,15(4):196-198.(in Chinese) 李兰玉,邱海燕,尚德秋. 牛种布鲁氏菌31 KDa蛋白基因引物的PCR试验 [J]. 中国地方病防治杂志,2000,15(4):196-198.
[4] Jiang H,Cui BY,Zhao HY, et al. Use of AMOS-PCR assay for the species identification of Brucellosis[J].Chinese Journal of Zoonoses,2009,25(2):107-109.(in Chinese) 姜海,崔步云,赵鸿雁,等. AMOS-PCR 对布鲁氏菌种型鉴定的应用[J]. 中国人兽共患病学报,2009,25(2):107-109.
[5] Matope G, Bhebhe E, Muma JB, et al. Characterization of some Brucella species from Zimbabwe by biochemical profiling and AMOS-PCR [J]. BMC Res Notes,2009,22(2):261.
[6] Wang DL,Li TF, Li Y. Key national provinces (regions) brucellosis outbreak investigation report[J].Chinese Journal of Control of Endemic Disease,2011,26(3):182-184.(in Chinese) 王大力,李铁锋,李晔.全国重点省(区)布鲁杆菌病疫情调研报告[J].中国地方病防治杂志,2011,26(3):182-184.
[7] Cui BY. Monitoring and control of the epidemic situation of brucellosis in China[J].Disease Surveillance,2007,22(10):649-651.(in Chinese) 崔步云.中国布鲁氏菌病疫情监测与控制[J].疾病监测,2007,22(10):649-651.
[2] Disease Prevention and Control Bureau of the Ministry of Health. Brucellosis Control Handbook[M].Beijing: People's Health Publishing House,2008.(in Chinese) 卫生部疾病预防控制局.布鲁氏菌病防治手册[M].北京:人民卫生出版社,2008.
[3] Li LY,Qiu HY,et al. Shang DQ. A study on the PCR about primers of 31 KDa,protein gene for Brucellosis[J]. Chinese Journal of Control of Endemic Disease,2000,15(4):196-198.(in Chinese) 李兰玉,邱海燕,尚德秋. 牛种布鲁氏菌31 KDa蛋白基因引物的PCR试验 [J]. 中国地方病防治杂志,2000,15(4):196-198.
[4] Jiang H,Cui BY,Zhao HY, et al. Use of AMOS-PCR assay for the species identification of Brucellosis[J].Chinese Journal of Zoonoses,2009,25(2):107-109.(in Chinese) 姜海,崔步云,赵鸿雁,等. AMOS-PCR 对布鲁氏菌种型鉴定的应用[J]. 中国人兽共患病学报,2009,25(2):107-109.
[5] Matope G, Bhebhe E, Muma JB, et al. Characterization of some Brucella species from Zimbabwe by biochemical profiling and AMOS-PCR [J]. BMC Res Notes,2009,22(2):261.
[6] Wang DL,Li TF, Li Y. Key national provinces (regions) brucellosis outbreak investigation report[J].Chinese Journal of Control of Endemic Disease,2011,26(3):182-184.(in Chinese) 王大力,李铁锋,李晔.全国重点省(区)布鲁杆菌病疫情调研报告[J].中国地方病防治杂志,2011,26(3):182-184.
[7] Cui BY. Monitoring and control of the epidemic situation of brucellosis in China[J].Disease Surveillance,2007,22(10):649-651.(in Chinese) 崔步云.中国布鲁氏菌病疫情监测与控制[J].疾病监测,2007,22(10):649-651.