Establishment of multiplex real-time PCR assay to detect AIDS-associated Mycoplasmas
WANG Yan-dong, HE Li-hua, ZHANG Jian-zhong, ZHAO Fei
State Key Laboratory for Communicable Disease Control and Prevention, Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
Abstract
Objective To establish a rapid, sensitive and specific multiplex real-time PCR assay for the detection of AIDS-associated Mycoplasmas. Methods Three sets of primers and probes were designed based on the specific sequence of the ftsZ gene (M. penetrans and M. fermentans) and the rpoB gene (M. pirum) and the Multiplex real-time PCR assay was established. Eight other Mycoplasmas and 14 pathogens were used to evaluate the specificity of the assay. The sensitivity of the assay was evaluated and compared with conventional PCR assay by using standard concentration positive plasmids. Results No specific amplifications were presented by using 22 other pathogens. The sensitivity of this Multiplex real-time PCR assay was about 10 times higher than that of conventional PCR for M. penetrans and M. fermentans, and 100 times higher than M. pirum. Conclusion This Multiplex real-time PCR assay was sensitive and specific, which could be used for the detection of AIDS-associated mycoplasmas and might be used in the clinical detection.
艾滋病相关支原体多重实时荧光聚合酶链反应检测方法的初步建立
王艳冬, 何利华, 张建中, 赵飞
中国疾病预防控制中心传染病预防控制所, 传染病预防控制国家重点实验室, 北京 102206
摘要
目的 建立一种快速、灵敏和特异的艾滋病相关支原体(穿透支原体、发酵支原体和梨支原体)多重实时荧光聚合酶链反应(Multiplex real-time PCR)检测技术。 方法 使用Beacon Designer 7.0软件在穿透支原体和发酵支原体的ftsZ基因以及梨支原体的rpoB基因保守区域设计多重引物及荧光探针,建立并优化艾滋病相关支原体Multiplex real-time PCR检测体系。分别使用3种支原体阳性质粒标准品评价体系的灵敏度,使用8种其他支原体、14种常见致病菌和人类基因组核酸评价该体系的特异度,并与普通聚合酶链反应(PCR)检测方法进行比较。 结果 该Multiplex real-time PCR方法对穿透支原体和发酵支原体检测灵敏度为103拷贝,约为普通PCR的10倍,对梨支原体检测灵敏度为102拷贝,约为普通PCR 100倍。该体系对8种其他支原体、14种常见致病菌和人类基因组均不能扩增。 结论 本研究建立的Multiplex real-time PCR方法可同时快速、准确的检测穿透支原体、发酵支原体和梨支原体。有望用于临床标本检测,完善对艾滋病相关支原体的检测能力。
内容大纲
-
1 材料与方法
- 1.1 材料
- 1.2 方法
- 1.2.1 引物与探针
- 1.2.2 细菌基因组DNA的提取
- 1.2.3 质粒标准品的构建
- 1.2.4 Multiplex real-time PCR反应体系及条件
- 1.2.5 特异度和灵敏度评价
- 1.2.6 与普通PCR检测方法比较
- 2.1 阳性质粒构建
- 2.2 Multiplex real-time PCR体系扩增特异度评价
- 2.3 Multiplex real-time PCR体系扩增灵敏度评价
- 2.4 Multiplex real-time PCR与普通PCR检测方法比较
由于艾滋病相关支原体的生长速度缓慢,分离培养困难,临床上不使用分离培养作为常规检测手段,且国内外目前尚无成熟的艾滋病相关支原体血清学检测技术,因此,目前国内对于艾滋病相关支原体检测手段主要使用国外早期报道的聚合酶链反应(polymerase chain reaction,PCR)和巢式-聚合酶链反应(nested polymerase chain reaction,nPCR) 。尽管nPCR灵敏度优于PCR,但其操作过程很容易造成环境污染引起假阳性扩增,故使用较少。此外,无论是普通PCR还是nPCR,其单一检测体系对于3种支原体分别检测耗时过长。鉴于普通PCR与nPCR检测方法的不足,多种病原菌目前都已建立了快速、灵敏、特异的实时荧光定量-聚合酶链反应(real-time fluorescence quantitative-Polymerase Chain Reaction,FQ-PCR)方法 ,很多相关的病原菌更是建立了多重聚合酶链反应(Multiplex real-time Polymerase Chain Reaction,Multiplex real-time PCR)方法[7],极大地提高检测效率。目前国内尚无艾滋病相关支原体Multiplex real-time PCR检测方法的报道。本研究拟建立一种快速、灵敏和特异的艾滋病相关支原体Multiplex real-time检测方法,完善艾滋病相关支原体的检测能力,为临床感染检测提供新的技术支持。
1 材料与方法
1.1 材料 1.1.1 菌株来源
本实验所用标准菌株穿透支原体ATCC55252,发酵支原体ATCC19989,梨支原体 ATCC25960,生殖支原体ATCC33530,人型支原体ATCC23114,解脲脲原体ATCC27618,肺炎支原体ATCC29342,唾液支原体ATCC23064,口腔支原体ATCC23714,咽喉支原体ATCC25293,猪鼻支原体ATCC17981均购自美国组织培养库(ATCC);金黄色葡萄球菌,无乳链球菌B群,C族链球菌,A族链球菌,草绿色链球菌,脑膜炎球菌A、B、C和Z群,鲍曼不动杆菌,流感嗜血杆菌,结核枝杆菌,肺炎克雷伯菌,肺炎链球菌和人类基因组分离自中国疾病预防控制中心传染病预防控制所。
1.1.2 试剂与仪器设备
Prime STARTM HS DNA Polymerase、pMD18-T载体和小量质粒提取试剂盒购自大连宝生物工程有限公司。Platinum Taq DNA polymerase和Platinum qPCR SuperMix-UDG购自Invitrogen。PCR Nucleotide mix和Nuclease-free water购自Promega。实时荧光定量PCR仪C1000 Thermal Cycler和凝胶自动成像系统为BIO RAD公司产品。
1.2 方法
1.2.1 引物与探针
利用GenBank的Blast工具对穿透支原体、发酵支原体和梨支原体的基因序列进行分析,分别选择ftsZ(穿透支原体和发酵支原体)和rpoB(梨支原体)基因保守区域使用Beacon Designer 7.0软件设计多重引物和探针,见表1。引物和探针均由上海辉睿生物公司合成。
表1 艾滋病相关支原体多重荧光PCR引物和探针
Table 1 Primers and probes used in Multiplex real-time PCR to detect AIDS-associated Mycoplasmas
| 引物名称 | 序列(5′~3′) | 长度(bp) | GC含量(%) | Tm值(℃) |
| M.penetrans-FP | ACG TGA GTT AAC CAT GTA | 18 | 38.9 | 43.5 |
| M.penetrans-RP | GGT TCG TCT TCT ATC TAA TAG | 21 | 38.1 | 48.5 |
| M.penetrans-P | FAM-TTA CCA GCA CCA CCA ATA CCA ATA AT-BHQ1 | 26 | 38.5 | 54.8 |
| M.fermentans-FP | TGC TGT TTC AAT GTC ATC | 18 | 38.9 | 43.5 |
| M.fermentans-RP | AGA CCG AGC TAT TAA AGC | 18 | 44.4 | 45.8 |
| M.fermentans-P | HEX-TTG ATG ATG CTT TAA TGA CTC CAC TTT-BHQ1 | 27 | 33.3 | 53.7 |
| M.pirum-FP | CGT GAT TTC TTT AAT ACT CAT C | 22 | 31.8 | 47.4 |
| M.pirum-RP | CAC GAA TAT CCA AGT TAG G | 19 | 42.1 | 46.8 |
| M.pirum-P | ROX-CCA GGT CCC ATT GCT GAA ATT CT-BHQ2 | 23 | 47.8 | 55.3 |
1.2.2 细菌基因组DNA的提取
细菌基因组DNA的提取使用QIAGEN公司的QIAamp DNA Mini Kit试剂盒,按照说明书进行操作,分装,-20 ℃保存备用。
1.2.3 质粒标准品的构建
使用Primer Premier 5.0软件分别在穿透支原体,发酵支原体和梨支原体相应目的基因(ftsZ、ftsZ和rpoB)上设计扩增引物:
Mpe-A: 5′-CCC GGA TCC TTG GTT CGT CTT CTA TCT AAT AGA GA-3′和Mpe-S:5′-CCC CTC GAG TTA TTT ATT TCT TCT AAA AAT TCT ATC AA-3′; Mfe-A: 5′-CCC GGA TCC ATG GAC TTA AAT GCT GAA GAT TTG GAA-3′和Mfe-S:5′-CCC CTC GAG TTA ATG ATT TTC ATC AAA GAA ATT TGG C-3′; Mpi-A: 5′-CCC GGA TCC GTG AAC ATC ACG AAT ATC CAA G-3′和Mpi-S:5′-CCC CTC GAG TTA ATT AAT GAA CTT TTA TAT AGC AGA A-3′,扩增产物大小分别为1431、1149和354 bp;分别连接到pMD18-T载体;转化E.coli DH5α感受态细胞;菌落PCR筛选阳性克隆子,最终测序确认;提取质粒,根据质粒的分子质量将质粒样品浓度换算为拷贝数浓度:每微升样品中检测基因的拷贝数=浓度(ng/μl)×6.02×1023×10-9/(660×重组质粒碱基数),其中重组质粒碱基数=pMD18-T载体碱基数+目的基因碱基数。
1.2.4 Multiplex real-time PCR反应体系及条件
12.5 μl Platinum qPCR SuperMix-UDG,2.0 μl MgCl2, 0.25 μl Platinum Taq DNA polymerase; 1 μl PCR Nucleotide mix;0.5 μl M.penetrans-FP(25 μmol/L);0.5 μl M.penetrans-RP(25 μmol/L);0.2 μl M.penetrans-P(25 μmol/L);0.8 μl M.fermentans-FP(25 μmol/L);0.8 μl M.fermentans-RP(25 μmol/L);0.4 μl M.fermentans-P(25 μmol/L);0.3 μl M.pirum-FP(25 μmol/L);0.3 μl M.pirum-RP(25 μmol/L);0.1 μl M.pirum-P(25 μmol/L);0.35 μl Nuclease-free water;5 μl模板。体系混匀后使用C1000 Thermal Cycler(BIO RAD)荧光PCR仪扩增检测。反应条件:95 ℃ 2 min,然后95 ℃ 15 s,59 ℃ 15 s,共40个循环。
1.2.5 特异度和灵敏度评价
使用生殖支原体,人型支原体,解脲脲原体,肺炎支原体,唾液支原体,口腔支原体,咽喉支原体,猪鼻支原体,金黄色葡萄球菌,无乳链球菌,C族链球菌,A族链球菌,草绿色链球菌,脑膜炎球菌A、B、C和Z群,鲍曼不动杆菌,流感嗜血杆菌,结核分枝杆菌,肺炎克雷伯菌,肺炎链球菌以及人类基因组核酸进行体系特异度评价。使用上述构建的浓度梯度10~108拷贝的穿透支原体、发酵支原体和梨支原体阳性质粒标准品进行体系灵敏度评价。特异度和灵敏度试验均重复3次。
1.2.6 与普通PCR检测方法比较
使用10~108拷贝的穿透支原体、发酵支原体和梨支原体阳性质粒标准品对普通PCR与该方法进行检测能力比较。普通PCR反应体系:5 μl 5×Primer STAR buffer;2 μl dNTP;上下游引物各0.5 μl;0.25 μl Prime STARTM HS DNA Polymerase;11.75 μl Nuclease-free water;5 μl DNA模板。反应条件:94 ℃ 5 min,然后94 ℃ 10 s,55 ℃ 15 s,72 ℃ 1 min,共30个循环。使用1.5%琼脂糖凝胶电泳查看PCR扩增结果。
2 结果
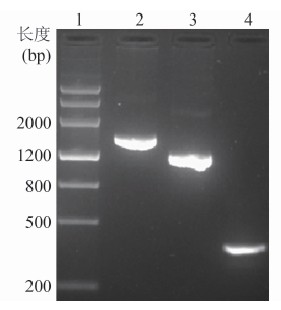
2.1 阳性质粒构建 PCR扩增后琼脂糖凝胶电泳显示,得到片段大小与预期结果相符(分别为1431、1149和354 bp),见图1。菌落PCR筛选阳性克隆子最终测序确认后提取质粒,根据质粒的分子质量将质粒样品浓度换算为拷贝数浓度后再使用Nuclease-free water将3种阳性质粒依次稀释成2.0~2.0×107拷贝/μl,共8个浓度梯度的标准品。
图1 艾滋病相关支原体目的基因PCR扩增凝胶电泳产物
Figure 1 Electropherogram of PCR products of AIDS-associated Mycoplasmas 注:1.DNA Marker; 2~4.分别为穿透支原体、发酵支原体、梨支原体阳性克隆片段PCR产物。
2.2 Multiplex real-time PCR体系扩增特异度评价
该体系对8种其他支原体及14种泌尿生殖道常见病原菌扩增结果均为阴性,人类基因组核酸的扩增结果也为阴性,检测特异度为100%。
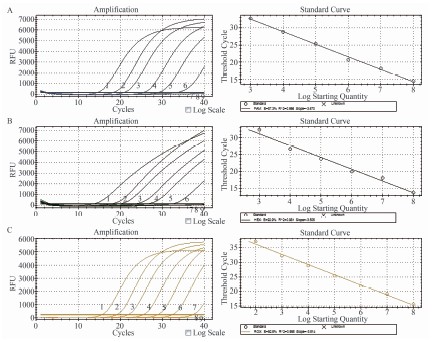
2.3 Multiplex real-time PCR体系扩增灵敏度评价
使用浓度2.0~2.0×107拷贝/μl的穿透支原体、发酵支原体和梨支原体核酸质粒标准品各5 μl进行多重荧光PCR扩增,单通道荧光信号显示:本方法对穿透支原体检测限为1.0×103拷贝,相关系数为0.996,扩增效率为87.3%(图2A);对穿透支原体检测限为1.0×103拷贝,相关系数为0.961,扩增效率为92.9%(图2B);对穿透支原体检测限为1.0×102拷贝,相关系数为0.995,扩增效率为92.6%(图2C)。
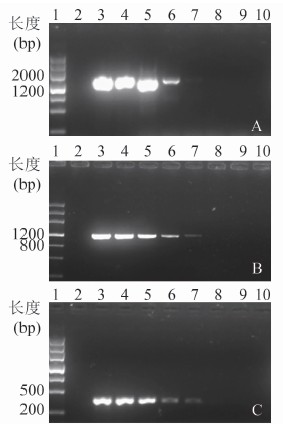
2.4 Multiplex real-time PCR与普通PCR检测方法比较
普通PCR方法对穿透支原体、发酵支原体和梨支原体的检测限均为1.0×104拷贝,见图3。本研究多重荧光PCR检测体系对穿透支原体和发酵支原体检测灵敏度比普通PCR高约10倍,对梨支原体检测灵敏度比普通PCR高约100倍。
3 讨论
穿透支原体、发酵支原体和梨支原体是20世纪80年代后新发现的支原体,这3种支原体在艾滋病病毒感染和艾滋病发病过程中 起辅助因子或促进
因
图2 Multiplex real-time PCR对10~108拷贝的穿透支原体(A)、发酵支原体(B)和梨支原体(C)阳性质粒标准品检测结果
Figure 2 Detection results of Multiplex real-time PCR for 10-108 copies positive standard plasmid 注:1~8分别为108、107、106、105、104、103、102、10拷贝阳性质粒; 9.空白对照
图3 普通PCR对10~108拷贝的穿透支原体(A)、发酵支原体(B)和梨支原体(C)阳性质粒标准品检测结果
Figure 3 Detection results of conventional PCR for 10-108 copies positive standard plasmid 注:1.DNA Marker; 2.空白对照;3~10分别为108、107、106、105、104、103、102、10拷贝阳性质粒 子的作用,均从感染者和患者体内分离成功[8]。上述3种支原体营养要求苛刻,分离培养困难,不能作为临床常规诊断方法。由于缺乏商品化的血清学诊断试剂盒,常规 PCR检测耗时长,灵敏度低,因此,国内目前临床艾滋病相关支原体诊断技术落后,造成部分携带艾滋病相关支原体的患者不能及时有效诊断和治疗,增大了机会感染,严重威胁艾滋病患者生命。急需建立一种快速、灵敏的检测技术指导临床及相关检测部门。
本研究建立的Multiplex real-time PCR检测方法最大的优点就是可在一个反应内同时检测3种艾滋病相关支原体,相对于传统的单个PCR检测技术,其工作量减少2/3以上;此外,由于real-time PCR为快速实时检测技术,无需制备琼脂糖凝胶、PCR电泳和成像观察,节约了1 h左右的检测时间,有效避免了加样过程中电泳产物可能造成的环境污染[9]。因此,该方法非常适合临床或者相关检测机构大量标本的快速检测。该体系对于穿透支原体、发酵支原体和梨支原体的检测能力也存在一定差异,分别为103、103和102拷贝,相对于一般报道real-time PCR的10~102拷贝检测限 来说有些偏低。这是因为Multiplex real-time PCR体系中多对探针和引物之间不可避免的相互干扰造成的检测灵敏度一定程度降低,此外体系的扩增效率也因此略有降低,其中穿透支原体的扩增效率87.3%,略低于单重real-time PCR 90%~105%的理想的扩增效率范围。尽管如此,该体系仍然比普通的PCR检测技术在灵敏度上高1~2个数量级。灵敏度的提升可有效防止漏检,提高检测阳性率。
本研究利用质粒标准品和艾滋病相关支原体病原菌基因组DNA模板,较为全面的探讨了Multiplex real-time PCR和普通PCR检测体系灵敏度和特异度,检测灵敏度明显高于普通PCR检测体系,且工作量小,节省时间。目前国内尚无艾滋病相关支原体的Multiplex real-time PCR检测技术的报道,该方法在进一步临床验证后,有望在艾滋病防控及预防继发性机会感染工作中推广使用。
参考文献
[1] Montagnier L, Blanchard A.Mycoplasmas as cofactors in infection due to the human immunodeficiency virus[J]. Clin Infect Dis, 1993, 17 Suppl 1:S309-315.
[2] Lo SC, Hayes MM, Wang RY, et al. Newly discovered mycoplasma isolated from patients infected with HIV[J].Lancet, 1991, 338:1415-1418.
[3] Mi ZH, Zhao JW, Qin L. Cultivation and detection of AIDSassociated mycoplasmas from gonorrhea patients[J]. Chinese Journal of Zoonoses, 2003, 19(3):79-81.(in Chinese)糜祖煌, 赵季文, 秦玲.淋病患者AIDS相关支原体的分离培养与核酸检测[J].中国人兽共患病杂志, 2003, 19(3):79-81.
[4] Jia CM, Shi SJ, Yang HT, et al. Separate 2 strains of mycoplasmas from AIDS patient and HIV infections[J]. Chinese Journal of Zoonoses, 2003, 19(6):77-79.(in Chinese)贾成梅, 施素洁, 羊海涛, 等.从艾滋病患者和HIV感染者中分离2株支原体[J].中国人兽共患病杂志, 2003, 19(6):77-79.
[5] Jentschke M, Soergel P, Lange V, et al. Evaluation of a new multiplexx realtime polymerase chain reaction assay for the detection of human papillomavirus infections in a referral population[J].Int J Gynecol Cancer, 2012, 22(6):1050-1056.
[6] SchabereiterGurtner C, Hirschl AM, Dragosics B, et al. Novel realtime PCR assay for detection of Helicobacter pylori infection and simultaneous clarithromycin susceptibility testing of stool and biopsy specimens[J].J Clin Microbiol, 2004, 42(10):4512-4518.
[7] Yu XF, Pan JC, Meng DM, et al. Multiplex realtime PCR assay to detect Salmonella, Shigella and diarrheogenic E. coli[J]. Chinese Journal of Preventive Medicine, 2007, 41(6):461-465.(in Chinese)于新芬, 潘劲草, 孟冬梅, 等.多重实时PCR检测沙门菌、志贺菌和致泻性大肠埃希菌[J].中华预防医学杂志, 2007, 41(6):461-465.
[8] Montagnier L, Blanchard A. Mycoplasmas as cofactors in infection due to the human immunodeficiency virus[J].Clin Infect Dis, 1993, 17:5309.
[9] Bischoff C, Luthy J, Altwegg M, et al. Rapid detection of diarrheagenic E.coli by realtime PCR[J]. Microbiol Methods, 2005, 61:335-341.
[10] Winchell JM, Thurman KA, Mitchell SL, et al. Evaluation of three realtime PCR assays for detection of Mycoplasma pneumoniae in an outbreak investigation[J].J Clin Microbiol, 2008, 46(9):3116-3118.
[2] Lo SC, Hayes MM, Wang RY, et al. Newly discovered mycoplasma isolated from patients infected with HIV[J].Lancet, 1991, 338:1415-1418.
[3] Mi ZH, Zhao JW, Qin L. Cultivation and detection of AIDSassociated mycoplasmas from gonorrhea patients[J]. Chinese Journal of Zoonoses, 2003, 19(3):79-81.(in Chinese)糜祖煌, 赵季文, 秦玲.淋病患者AIDS相关支原体的分离培养与核酸检测[J].中国人兽共患病杂志, 2003, 19(3):79-81.
[4] Jia CM, Shi SJ, Yang HT, et al. Separate 2 strains of mycoplasmas from AIDS patient and HIV infections[J]. Chinese Journal of Zoonoses, 2003, 19(6):77-79.(in Chinese)贾成梅, 施素洁, 羊海涛, 等.从艾滋病患者和HIV感染者中分离2株支原体[J].中国人兽共患病杂志, 2003, 19(6):77-79.
[5] Jentschke M, Soergel P, Lange V, et al. Evaluation of a new multiplexx realtime polymerase chain reaction assay for the detection of human papillomavirus infections in a referral population[J].Int J Gynecol Cancer, 2012, 22(6):1050-1056.
[6] SchabereiterGurtner C, Hirschl AM, Dragosics B, et al. Novel realtime PCR assay for detection of Helicobacter pylori infection and simultaneous clarithromycin susceptibility testing of stool and biopsy specimens[J].J Clin Microbiol, 2004, 42(10):4512-4518.
[7] Yu XF, Pan JC, Meng DM, et al. Multiplex realtime PCR assay to detect Salmonella, Shigella and diarrheogenic E. coli[J]. Chinese Journal of Preventive Medicine, 2007, 41(6):461-465.(in Chinese)于新芬, 潘劲草, 孟冬梅, 等.多重实时PCR检测沙门菌、志贺菌和致泻性大肠埃希菌[J].中华预防医学杂志, 2007, 41(6):461-465.
[8] Montagnier L, Blanchard A. Mycoplasmas as cofactors in infection due to the human immunodeficiency virus[J].Clin Infect Dis, 1993, 17:5309.
[9] Bischoff C, Luthy J, Altwegg M, et al. Rapid detection of diarrheagenic E.coli by realtime PCR[J]. Microbiol Methods, 2005, 61:335-341.
[10] Winchell JM, Thurman KA, Mitchell SL, et al. Evaluation of three realtime PCR assays for detection of Mycoplasma pneumoniae in an outbreak investigation[J].J Clin Microbiol, 2008, 46(9):3116-3118.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 王艳冬 | |
| 何利华 | |
| 张建中 | |
| 赵飞 | |
| PubMed | |
| Article by WANG Yan-dong | |
| Article by HE Li-hua | |
| Article by ZHANG Jian-zhong | |
| Article by ZHAO Fei | |