A real-time PCR assay for detection of Mycoplasma pneumoniae
MENG Fan-liang, HE Li-hua, GU Yi-xin, ZHANG Jian-zhong, ZHAO Fei
State Key Laboratory for Communicable Diseases Prevention and Control, Institute for Communicable Disease Prevention and Control, Chinese Center for Disease Control and Prevention, Beijing 102206, China
Abstract
Objective To established a simple, rapid real-time PCR assay to detect Mycoplasma pneumoniae in clinical specimens. Methods By analyzing the p1 gene sequence of M. pneumoniae isolates, an optimized real-time PCR assay was designed. The specificity and sensitivity of this assay were evaluated and compared with conventional PCR assay using clinical specimens. Results The detection limit of the real-time PCR assay was about 10 cfu. The sensitivity and specificity of the assay were high. This real-time PCR assay was superior to conventional PCR in clinical specimen detection. Conclusion The real-time PCR assay is suitable for the detection of M. pneumoniae in clinical specimens.
实时荧光定量-聚合酶链反应方法检测肺炎支原体
孟凡亮, 何利华, 顾一心, 张建中, 赵飞
中国疾病预防控制中心传染病预防控制所, 传染病预防控制国家重点实验室, 北京 102206
摘要
目的 建立一种快速、灵敏、特异的肺炎支原体实时荧光定量-聚合酶链反应(real-time PCR)检测方法,以期用于临床肺炎支原体感染检测。 方法 通过测序分析和序列比对,选取肺炎支原体p1基因中保守区域设计特异性引物和荧光探针,建立和完善此real-time PCR检测方法,并进行扩增效率、灵敏度及特异度评价。与已报道的肺炎支原体常规聚合酶链反应(PCR)方法进行150份临床标本检测能力比较。 结果 建立的real-time PCR方法对肺炎支原体的检测限约为10 cfu。使用该方法对9株肺炎支原体ATCC标准株和30株临床分离株核酸扩增均为阳性;对10种其他支原体、13种常见呼吸道病原菌染色体及人类染色体扩增结果均为阴性。同时,临床标本的检测结果显示该方法检测灵敏度优于常规PCR。 结论 本研究建立的real-time PCR方法可快速、灵敏、特异地检测标本中肺炎支原体核酸,可适用于临床肺炎支原体诊断。
内容大纲
-
1 材料与方法
- 1.1 菌株
- 1.2 主要试剂和仪器
- 1.3 引物与探针
- 1.4 real-time PCR检测体系与扩增条件
- 1.5 real-time PCR体系灵敏度及特异度检测
- 1.6 real-time PCR体系检测效率及检测限测定
- 1.7 real-time PCR体系与常规PCR方法对临床标本检测
肺炎支原体快速检测方法主要为血清学抗体检测和核酸检测5,国内临床主要使用各种商品化的血清学抗体试剂盒进行肺炎支原体检测。由于肺炎支原体抗体检测灵敏度和特异度较差,致使国内临床对于肺炎支原体感染检测能力有限,因此建立并推广一种快速灵敏的肺炎支原体检测技术有重要意义。随着核酸检测技术日益普及,成本不断降低,其凭借快速、特异、灵敏的优点,逐渐替代分离培养及血清学检测等传统技术应用于多种病原菌的临床检测[6],并取得良好成效。近些年,国内肺炎支原体临床检测也逐渐使用核酸技术替代血清学方法,但依然多采用常规聚合酶链反应(常规PCR)技术,其检测灵敏度相对低,易污染,无法进一步满足临床肺炎支原体快速准确的检测要求。本研究拟建立一种快速、灵敏、特异的肺炎支原体 实时荧光定量-聚合酶链反应(real-time fluorescence quantitative-polymerase chain reaction,real-time PCR)检测方法,并进行临床标本验证,为国内肺炎支原体临床感染检测提供新的技术支持。
1 材料与方法
1.1 菌株 肺炎支原体ATCC29342、ATCC29343、ATCC39505、ATCC15531、ATCC29085、ATCC15377、ATCC15492、ATCC29894、ATCC15293,生殖支原体ATCC33530,人型支原体ATCC23114,解脲脲原体ATCC27618,穿透支原体ATCC55252,梨支原体ATCC25960,发酵支原体ATCC19989,唾液支原体ATCC23064,口腔支原体ATCC23714,咽喉支原体ATCC25293,猪鼻支原体ATCC17981,鲍曼不动杆菌ATCC17978,A族链球菌ATCC700294,金黄葡萄球菌ATCC29213,均购自美国ATCC菌种保存库并由中国疾病预防控制中心传染病预防控制所(传染病所)诊断室保存;流感嗜血杆菌,结核分枝杆菌,脑膜炎双球菌,嗜肺军团菌,肺炎克雷伯菌,大肠埃希菌,铜绿假单胞菌,草绿色链球菌,无乳链球菌和C族链球菌,均为传染病所其他科室惠赠,所有菌株均使用QIAamp DNA Mini Kit(QIAGEN 51306) 试剂盒提取核酸。
1.2 主要试剂和仪器
Nucleotide mix和Nuclease-free water为Promega公司产品;Platinum Taq DNA polymerase和Platinum quantitative PCR SuperMix-UDG为Invitrogen公司产品; Ex Taq Kit 为TaKaRa公司产品;real-time PCR仪C1000 Thermal Cycler和凝胶自动成像系统为Bio-Rad公司仪器。
1.3 引物与探针
通过比对国内60株肺炎支原体临床分离株与NCBI数据库已报道的国外肺炎支原体p1基因序列,针对p1基因保守区域使用Beacon Designer 7.0软件设计特异性扩增引物Mp-F(5′-TTA CCT TAG GAC TTG CCA TTG GA-3′)和Mp-R(5′-CGC AAA CCC AGC CTT CAA-3′)及TaqMan荧光探针Mp-P 。引物和探针由上海辉睿生物公司合成。
1.4 real-time PCR检测体系与扩增条件
25 μl 检测体系包含:0.25 μl Platinum Taq DNA polymerase(Invitrogen C10966-034),12.5 μl Platinum quantitative PCR SuperMix-UDG(Invitrogen C11730-025),1.0 μl MgCl2(50 mmol/L),0.5 μl上游引物Mp-F(25 μmol/L),0.5 μl下游引物Mp-R (25 μmol/L),0.2 μl探针Mp-P(25 μmol/L),1.5 μl PCR nucleotide mix(Promega C1141),5 μl DNA模板,用Nuclease-free water(Promega P1193)补至25 μl。混合体系使用BIO-RAD C1000 Thermal Cycler real-time PCR仪进行扩增。扩增条件为:95 ℃ 3 min;然后95 ℃ 15 s,57 ℃ 30 s,40个循环。
1.5 real-time PCR体系灵敏度及特异度检测
对已优化的体系使用9株肺炎支原体ATCC标准株(详见1.1菌株清单)和30株临床分离株核酸验证其检测灵敏度;同时使用10种其他支原体标准菌株核酸,13种呼吸道常见致病菌核酸及人类染色体(详见1.1菌株清单)进行体系特异度验证。
1.6 real-time PCR体系检测效率及检测限测定
real-time PCR扩增效率(E)为每个循环扩增模板的百分比,计算公式为:E=(10-1/斜率-1)×100%。检测限为方法能检测到的最低分析物浓度,是检测方法的重要性能指标之一。本研究使用含0.81 fg/μl~8.1 ng/μl的肺炎支原体核酸对优化后体系进行标准曲线建立,评价该方法的检测效率及检测限。
1.7 real-time PCR体系与常规PCR方法对临床标本检测
分别使用该real-time PCR方法与已报道的常规PCR方法[8]对50份肺炎支原体阳性临床咽拭子标本(阳性标本为肺炎支原体培养阳性标本)核酸和100份肺炎支原体阴性临床咽拭子标本(阴性标本为肺炎支原体培养阴性且使用已报道的real-time PCR方法[9]检测结果也为阴性的标本)核酸进行检测。常规PCR扩增引物为MP5-1(5′-GAA GCT TAT GGT ACA GGT TGG-3′)和 MP5-2:(5′-ATT ACC ATC CTT GTT GTA AGG-3′)。常规PCR体系:10×ExTaq buffer 2.5 μl,dNTP Mix 2.0 μl,Ex Taq 0.2 μl,引物MP5-1/2(10 mmol/L)各0.5 μl,模板5 μl,用Nuclease-free water补至25 μl。反应条件:94 ℃预变性5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,共35个循环。扩增产物经2.0%琼脂糖电泳后观察。
2 结果
2.1 real-time PCR体系的灵敏度和特异度 使用该方法对9株ATCC标准株和30株临床分离株共计39株肺炎支原体核酸检测结果均为阳性,因此在使用肺炎支原体纯菌模板情况下体系的检测灵敏度为100%。用该体系对10种其他支原体(人型支原体、解脲脲原体、穿透支原体、梨支原体、发酵支原体、生殖支原体、唾液支原体、口腔支原体、咽喉支原体、猪鼻支原体),13种常见呼吸道病原菌(鲍曼不动杆菌、A族链球菌、金黄葡萄球菌、流感嗜血杆菌、结核分枝杆菌、脑膜炎双球菌、嗜肺军团菌、肺炎克雷伯菌、大肠埃希菌、铜绿假单胞菌、草绿色链球菌、无乳链球菌、C族链球菌)及人类染色体进行扩增,结果均为阴性,检测特异度为100%。
2.2 real-time PCR体系的扩增效率与检测限评价
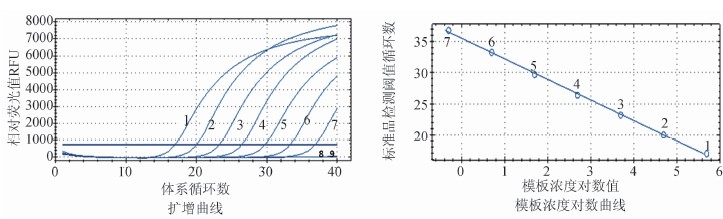
使用含0.81 fg/μl~8.1 ng/μl的肺炎支原体核酸扩增获得标准曲线及对数曲线(图1),斜率为-3.306,R2=0.999,经公式计算该体系扩增效率E=100.7%。该方法使用5 μl模板进行检测,标准品中的肺炎支原体核酸量实际为4.05 fg~40.5 ng,经过换算约为1~107cfu的肺炎支原体(1 cfu肺炎支原体菌株对应的核酸量约为2.7 fg~5.3 fg核酸)。该方法对肺炎支原体核酸最低检测限约为10 cfu(对应核酸量为40.5 fg),其2次重复的检测Ct(cycle threshold)值分别为36.68和36.65,故将此real-time PCR方法结果判定Ct值定位37,Ct值大于37的标本为阴性,小于37的标本为阳性结果。
2.3 real-time PCR与常规PCR方法对50份临床标本检测比较
50份肺炎支原体阳性临床标本核酸,使用该real-time PCR方法检测阳性率为98%(49/50),使用常规PCR方法检测阳性率为62%(31/50),见表1,经配对χ2检验,两种方法差异有统计学意义(P<0.01,χ2=16.06)。两种方法对100份肺炎支原体阴性临床标本核酸检测结果均为阴性,未发现假阳性结果。
图1 肺炎支原体标准浓度梯度核酸real-time PCR体系
Figure 1 Standard curve (left) and log standard curve (right) of real-time PCR assay of M. pneumoniae 注: 1~8分别为107、106、105、104、103、102、101、1 cfu;9.空白对照。
表1 real-time PCR与常规PCR方法对50份肺炎支原体阳性临床标本检测结果比较(1)
Table 1 Detection results of 50 M. pneumoniae positive clinical specimens by real-time PCR assay and conventional PCR assay
| 标本编号 | real-time PCR | 常规PCR | 标本编号 | real-time PCR | 常规PCR | 标本编号 | real-time PCR | 常规PCR | 标本编号 | real-time PCR | 常规PCR |
| 1 | 19.55 | P | 14 | 30.74 | P | 26 | 34.66 | P | 39 | 36.22 | N |
| 2 | 22.90 | P | 15 | 33.08 | P | 27 | 34.98 | P | 40 | 36.26 | N |
| 3 | 24.32 | P | 16 | 33.23 | P | 28 | 35.21 | N | 41 | 36.62 | N |
| 4 | 27.05 | P | 17 | 33.42 | P | 29 | 35.39 | P | 42 | 36.67 | N |
| 5 | 27.22 | P | 18 | 33.52 | P | 30 | 35.44 | P | 43 | 36.68 | N |
| 6 | 27.23 | P | 19 | 33.55 | P | 31 | 35.46 | N | 44 | 36.71 | N |
| 7 | 27.88 | P | 20 | 33.91 | P | 32 | 35.51 | N | 45 | 36.00 | N |
| 8 | 28.01 | P | 21 | 33.93 | P | 33 | 35.75 | P | 46 | 36.03 | N |
| 9 | 28.19 | P | 22 | 34.01 | P | 34 | 35.92 | P | 47 | 36.08 | N |
| 10 | 28.22 | P | 23 | 34.01 | N | 35 | 35.99 | N | 48 | 36.33 | N |
| 11 | 29.73 | P | 24 | 34.02 | P | 36 | 36.29 | P | 49 | 36.36 | N |
| 12 | 29.77 | P | 25 | 34.56 | P | 37 | 35.47 | N | 50 | N | N |
| 13 | 29.78 | P | 38 | 36.10 | N |
3 讨论
目前国内临床肺炎支原体诊断技术相对落后,现有的技术难以对就诊者做出及时快速诊断。本研究为解决上述问题建立了一种快速灵敏的肺炎支原体real-time PCR检测方法。扩增效率[10]是评价real-time PCR方法重复性和体系稳定性的重要的指标,其范围应在95%~105%之间。扩增效率过低可能是引物及探针设计不当,或者反应条件未合理优化;过高可能是稀释样品加样等人为失误,或者有非特异性扩增引起。real-time PCR方法中R2值显示实验数据满足衰减的线性程度,本研究建立的方法其R2=0.999,数据线性程度非常好,依此计算的体系扩增效率为100.7%,显示出良好的检测能力和稳定性。本研究使用39株肺炎支原体菌株模板和24种非肺炎支原体模板验证了该方法灵敏度和特异度在检测纯菌核酸时均达到100%,且检测限仅为10 cfu,检测能力很强。使用50份临床标本进行方法比较验证时,该方法的检测率为98%(49/50),而常规PCR仅为62%(31/50),经统计学分析,两者阳性检测率差异有统计学意义,real-time PCR该方法对临床标本的检测能力优于普通PCR。从表1数据中发现,real-time PCR检测阳性且Ct>35的22份标本使用常规PCR检测阳性率仅为22.7%(5/22),表明该real-time PCR对于检测携带低拷贝数肺炎支原体的临床标本更具有优势。经100份阴性临床标本验证,两种方法肺炎支原体检测的特异性均为100%(100/100),说明这两种针对肺炎支原体特异性基因片段进行检测的PCR技术具有良好的检测特异度,适合临床检测要求。
由于临床标本一般带菌量较少,且成分复杂,含有影响PCR检测的不确定成分,实际检测过程中会产生假阴性结果,这就需要检测方法要具备检测灵敏度高和抗干扰能力强这两个特点。本研究中,该real-time PCR方法仅有1例阳性标本未能检测,后续试验证明该标本分离到的肺炎支原体菌株经培养后提取的核酸使用本方法可以有效检测,说明本例临床标本中存在某些抑制PCR反应扩增的未知物质,造成检 测假阴性结果,这就是各种 检测方法 在检测临床标本时的检测灵敏度要低于检测纯培养菌株核酸的重要原因。本研究中real-time PCR方法检测临床标本的灵敏度达到98%,具有很好的临床标本检测能力,且相对常规PCR方法,提高了检测灵敏度,缩短了检测时间,减少了电泳过程可能带来的污染。适合临床上大量呼吸道感染标本的快速检测,有望成为临床上肺炎支原体感染快速检测技术。
参考文献
[1] Hammerschlag MR. Mycoplasma pneumoniae infections[J]. Curr OpinInfect Dis,2001,14:181-186.
[2] Waites KB, Talkington DF. Mycoplasma pneumoniae and its role as a human pathogen[J]. Clin Microbiol Rev,2004,17:697-728.
[3] Sanchez-Vargas FM, Gomez-Duarte OG. Mycoplasma pneumoniae-an emerging extra-pulmonary pathogen[J]. Clin Microbiol Infect,2008,14:105-117.
[4] Beersma MF, Dirven K, Van Dam AP, et al. Evaluation of 12 commercial tests and the complement fixation test for Mycoplasma pneumoniae specific immunoglobulin G(IgG) and IgM antibodies, with PCR used as the "gold standard"[J]. J Clin Microbiol,2005,43:2277-2285.
[5] Loens K, Ursi D, Goossens H, et al. Molecular diagnosis of Mycoplasma pneumoniae respiratory tract infections[J]. J Clin Microbiol,2003,41:4915-4923.
[6] Belda S, Saez J, Santibáñez M, et al. Quantification of Helicobacter pylori in gastric mucosa by real-time polymerase chain reaction:comparison with traditional diagnostic methods[J]. Diagn Microbiol Infect Dis,2012,74(3):248-252.
[7] Phelps NB, Patnayak DP, Jiang Y, et al. The use of a one-step real-time reverse transcription polymerase chain reaction(rRT-PCR) for the surveillance of viral hemorrhagic septicemia virus(VHSV) in Minnesota[J]. J Aquat Anim Health,2012,24(4):238-243.
[8] Bernet C,Garret M,Barbeyrac B,et al. Detection of Mycoplasma pneumoniae by Using the polymerase chain reaction[J]. J Clin Microbiol,1989,27:2492-2496.
[9] Zhao F, Cao B, He LH,et al. Evaluation of a new real-time PCR assay for detection of Mycoplasma pneumoniae in clinical specimens[J]. Biomed Environ Sci,2012,25(1):77-81.
[10] Peccoud J,Jacob C. Theoretical uncertainty of measurements using quantitative polymerase chain reaction[J]. Biophysical J,1996,71:101-108.
[2] Waites KB, Talkington DF. Mycoplasma pneumoniae and its role as a human pathogen[J]. Clin Microbiol Rev,2004,17:697-728.
[3] Sanchez-Vargas FM, Gomez-Duarte OG. Mycoplasma pneumoniae-an emerging extra-pulmonary pathogen[J]. Clin Microbiol Infect,2008,14:105-117.
[4] Beersma MF, Dirven K, Van Dam AP, et al. Evaluation of 12 commercial tests and the complement fixation test for Mycoplasma pneumoniae specific immunoglobulin G(IgG) and IgM antibodies, with PCR used as the "gold standard"[J]. J Clin Microbiol,2005,43:2277-2285.
[5] Loens K, Ursi D, Goossens H, et al. Molecular diagnosis of Mycoplasma pneumoniae respiratory tract infections[J]. J Clin Microbiol,2003,41:4915-4923.
[6] Belda S, Saez J, Santibáñez M, et al. Quantification of Helicobacter pylori in gastric mucosa by real-time polymerase chain reaction:comparison with traditional diagnostic methods[J]. Diagn Microbiol Infect Dis,2012,74(3):248-252.
[7] Phelps NB, Patnayak DP, Jiang Y, et al. The use of a one-step real-time reverse transcription polymerase chain reaction(rRT-PCR) for the surveillance of viral hemorrhagic septicemia virus(VHSV) in Minnesota[J]. J Aquat Anim Health,2012,24(4):238-243.
[8] Bernet C,Garret M,Barbeyrac B,et al. Detection of Mycoplasma pneumoniae by Using the polymerase chain reaction[J]. J Clin Microbiol,1989,27:2492-2496.
[9] Zhao F, Cao B, He LH,et al. Evaluation of a new real-time PCR assay for detection of Mycoplasma pneumoniae in clinical specimens[J]. Biomed Environ Sci,2012,25(1):77-81.
[10] Peccoud J,Jacob C. Theoretical uncertainty of measurements using quantitative polymerase chain reaction[J]. Biophysical J,1996,71:101-108.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 孟凡亮 | |
| 何利华 | |
| 顾一心 | |
| 张建中 | |
| 赵飞 | |
| PubMed | |
| Article by MENG Fan-liang | |
| Article by HE Li-hua | |
| Article by GU Yi-xin | |
| Article by ZHANG Jian-zhong | |
| Article by ZHAO Fei | |