Drug susceptibility of Campylobacter jejuni isolated in China
GU Yi-xin, HE Li-hua, LIU Hong-ying, LIU Xia-yang, TAO Xiao-xia, ZHANG Jian-zhong, ZHANG Mao-jun
State Key Laboratory for Communicable Diseases Prevention and Control, Institute for Communicable Disease prevention and control, Chinese Center for Disease Control and Prevention, Beijing 102206, China
Abstract
Objective To understand the drug susceptibility of Campylobacter jejuni isolated in China in recent 10 more years. Methods The minimum inhibitory concentrations(MICs) of 10 antibiotics in 6 categories to 116 C. jejuni strains isolated in China since 1995 were detected with agar dilution method recommended by WHO Global Foodborne Infections Network. Results The overall resistant rate of the C. jejuni strains to metronidazole was highest(97.4%). All the tested strains were sensitive to erythromycin. More than 6% of the strains isolated after 2010 showed multidrug resistance to 8 antibiotics. Conclusion The C. jejuni strains isolated from diarrhea patients still had high sensitivity to erythromycin, gentamicin and streptomycin, but high resistance to metronidazole, nalidixic acid, tetracycline, ciprofloxacin, levofloxacin and ampicillin
空肠弯曲菌耐药谱特征分析
顾一心, 何利华, 刘红莹, 刘夏阳, 陶晓霞, 张建中, 张茂俊
中国疾病预防控制中心传染病预防控制所, 传染病预防控制国家重点实验室, 北京 102206
摘要
目的 分析十几年间我国空肠弯曲菌临床分离株对10种抗生素耐药谱特征,了解我国空肠弯曲菌耐药的变迁趋势。 方法 采用世界卫生组织(WHO)全球食源性病原菌感染网络(GFN)推荐的弯曲菌琼脂稀释法,测定1995年至今分离的116株空肠弯曲菌对6类10种抗生素的最小抑菌浓度(MIC)。 结果 经对实验结果整体分析,甲硝唑的总体耐药率最高为97.4%(113/116),四环素为82.8%(96/116),环丙沙星为80.2%(93/116),萘啶酸为79.3%(92/116),左氧氟沙星和氨苄西林耐药率相同,为40.5%(47/116),氯霉素为18.1%(21/116),庆大霉素为8.6%(10/116),链霉素为4.3%(5/116),最低为红霉素0(0/116)。随着时间的推进,萘啶酸、环丙沙星、左氧氟沙星和氨苄西林的MIC有明显增高趋势;四环素、红霉素、庆大霉素、氯霉素和甲硝唑的MIC值变化不明显;链霉素的MIC值变化有下降的趋势。6.1%的菌株出现了8种抗生素多重耐药的结果,且菌株均出现在2010年后。经统计学分析,萘啶酸、环丙沙星、链霉素、庆大霉素、氯霉素和氨苄西林6种抗生素在2001年前、2001-2005年、2006-2010年和2010年后4个时间段中耐药率差异有统计学意义。 结论 空肠弯曲菌对红霉素、庆大霉素以及链霉素3种抗生素依旧保持了较高的敏感性,对萘啶酸、环丙沙星、左氧氟沙星、四环素、甲硝唑以及氨苄西林6种抗生素产生了较大程度的耐药。
内容大纲
-
1 材料与方法
- 1.1 试验菌株
- 1.2 主要试剂与仪器
- 1.3 细菌的培养
- 1.4 空肠弯曲菌DNA模板制备
- 1.5 多重PCR检测和鉴定
- 1.6 琼脂稀释法药物敏感实验
- 2.1 空肠弯曲菌多重PCR鉴定结果
- 2.2 菌株耐药率以及MIC变化
- 2.3 空肠弯曲菌多重耐药特征
在自然界中,空肠弯曲菌广泛存在于各种温血动物体内,其中鸡是带菌率最高的动物[2],构成空肠弯曲菌的体外储存宿主。人和畜之间耐药菌株的传播,临床抗生素的不合理使用以及食物链中抗生素的摄取都不同程度的造成了其耐药性增加,加重了临床治疗的难度和疾病负担。本实验通过对不同时期分离得到的116株空肠弯曲菌进行抗生素敏感性的检测实验,分析近十几年我国空肠弯曲菌的耐药谱变化特征,为空肠弯曲菌感染的有效防治提供理论依据。
1 材料与方法
1.1 试验菌株 质控菌株Campylobacter jejuni(ATCC 33560),Staphylococcus aureus(ATCC29213)购自美国菌株保存中心(ATCC)。实验所用的10株为2001年前分离菌株,其中7株为1995年河北GBS患者来源,其余3株同年同地区家禽来源。2001-2005年分离菌株均来源于2003年北京地区腹泻患者,共35株。2006-2010年分离菌株为22株,其中9株来源于2006年河南地区腹泻患者,9株来源于2007年河南地区腹泻患者,其余4株来源于2009年上海地区腹泻患者。2010年后分离得到的49株菌株均来自于2010年上海腹泻患者。
1.2 主要试剂与仪器
Karmali(CAMPYLOBACTER AGAR BASE) 琼脂以及MH(MUELLER-HINTON AGAR)琼脂均购自OXOID公司。萘啶酸(Nalidixic acid,NA)、环丙沙星(Ciprofloxacin,CI),红霉素(Erythromycin,EM)、链霉素(Streptomycin,SM)、庆大霉素(Gentamycin,GM)、氨苄西林(Ampicillin,AM)、氯霉素(Chloramphenicol,CL)、四环素(Tetracycline,TC)、左氧氟沙星(Levofloxacin,LE)和甲硝唑(Metronidazole,MZ)均购自美国SIGMA公司。分离培养所用选择性抗生素为OXOID SR0205E(Modified Karmali Selective Supplement)。脱纤维羊血购自北京兰博瑞生物制品有限公司。Gelred染料为BIOTIUM公司进口分装。2×Easy TaqSuper Mix购自北京全式金生物公司。聚合酶链反应(Polymerase Chain Reaction,PCR)扩增引物,由北京生工生物技术有限公司合成。三气培养箱Nu-4950E,OLYMPUS显微镜,OM 3GN90K 打点仪。
1.3 细菌的培养
取10 μl样品划线接种于含有选择性抗生素
的karmali平板上,37 ℃微需氧条件下培养48 h。挑取符合空肠弯曲菌典型微白、针尖状单菌落仍接种于上述平板上,增菌。保存菌种。
1.4 空肠弯曲菌DNA模板制备
接种环蘸取少量细菌,悬于100 μl无核酸纯水中,95 ℃加热20 min, 8000 r/min离心5 min, 吸取上清作为PCR检测模板备用。
1.5 多重PCR检测和鉴定
采用《现场细菌学》提供的2对空肠弯曲菌鉴定引物16F/R以及MapA-F/R进行116株空肠弯曲菌临床分离株PCR扩增鉴定。扩增条件:95 ℃预变性5 min,94 ℃ 1 min,58 ℃ 1 min,72 ℃ 1 min,35个循环后72 ℃延伸5 min。配制1.5%琼脂
糖凝胶,取2 μl PCR产物加样,120 V电压电泳40 min,凝胶成像系统分析结果。
1.6 琼脂稀释法药物敏感实验
应用全球食源性感染网络(WHO global foodborne infections network,GFN)推荐的弯曲菌的琼脂稀释法[3]。具体方法将上述10种抗生素按照要求配成原液(5120 g/ml),再采用倍比稀释的方法将抗生素稀释成2560~1.25 μg/ml 12个浓度梯度。将MH培养基高压灭菌,水浴冷却至50 ℃,后加入脱纤维羊血(终浓度为5%)。在直径90 mm的平皿中加入2.5 ml倍比稀释好的抗生素工作液,后加入22.5 ml MH血培养基,充分混匀后,冷却。从低浓度至高浓度配制成各个浓度梯度的平板。将菌液调到0.5个麦氏单位,使用打点仪,将菌液于15 min内接种于平皿上。置于37 ℃微需氧环境中,48 h后读取结果。细菌不生长的抗生素浓度则为其最小抑菌浓度(minimum inhibitory concentration, MIC)。
2 结果
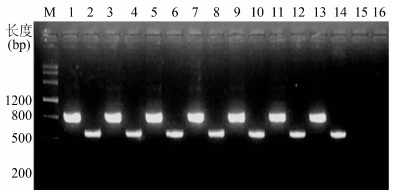
2.1 空肠弯曲菌多重PCR鉴定结果 使用《现场细菌学》提供的16 F/R以及MapA-F/R空肠弯曲菌特异性引物对临床分离到的116株菌株扩增结果均为阳性,说明试验选用的所有116株菌株均为空肠弯曲菌。图1为其中6株弯曲菌分离株以及标准菌株PCR扩增鉴定的凝胶电泳图。
图1 空肠弯曲菌16S rRNA及MapA基因PCR扩增引物电泳图
Figure 1 PCR identification of C.jejuni targeted on 16S rRNA and MapA genes 注:M:M
arker; 1. ATCC 33560 16S rRNA 扩增产物; 2.ATCC 33560 MapA 扩增产物; 3.样品1 16S rRNA 扩增产物; 4.样品1 MapA 扩增产物; 5.样品2 16S rRNA 扩增产物; 6.样品2 MapA 扩增产物; 15,16.阴性对照。
2.2 菌株耐药率以及MIC变化
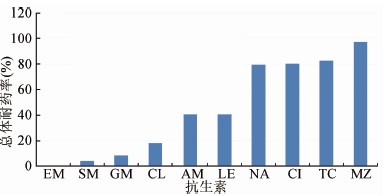
本文采用GFN所推荐的耐药判断标准,即:萘啶酸、环丙沙星、左氧氟沙星、四环素、链霉素、庆大霉素、氯霉素、氨苄西林的MIC≥16 μg/ml为耐药;红霉素的MIC≥8 μg/ml为耐药;甲硝唑的MIC≥1 μg/ml为耐药。应用上述的判断标准,不同时间段的分离株对于各种抗生素的耐药性有不同程度的差别,见图2。其中属于硝基咪唑类抗生素的甲硝唑的耐药率基本维持在较高的水平,而所有菌株均表现为对大环内酯类抗生素红霉素的敏感。此外,在4个时间段中,细菌对于10种抗生素的耐药率的变化也有较大程度的差别,见图3。菌株的MIC变化趋势也不尽相同(表1)。对于喹诺酮类3种抗生素,随着时间的推进,MIC值表现为逐步增加的趋势。氨基糖苷类抗生素链霉素表现出MIC值趋于变小的趋势,而庆大霉素以及氯霉素的变化不明显。属于β-内酰胺类抗生素类中的青霉素的增加趋势则很明显。四环素、红霉素以及甲硝唑的MIC值变化趋势均不明显。使用χ2分析,萘啶酸、环丙沙星、链霉素、庆大霉素、氯霉素和氨苄西林6种抗生素在4个时间段中的耐药率差异有统计学意义(P<0.05)。
表1 116株空肠弯曲菌对10种抗生素不同时间段MIC值变化情况
Table 1 Time specific MICs of 10 antibiotics to 116 C.jejuni strains
| MIC范围(μg/ml) | 分离时间(1) | 萘啶酸 | 环丙沙星 | 左氧氟沙星 | 四环素 | 链霉素 | |||||||||
| 耐药株 | 耐效率(%) | 耐药株 | 耐效率(%) | 耐药株 | 耐效率(%) | 耐药株 | 耐效率(%) | 耐药株 | 耐效率(%) | ||||||
| <0.25 | A | 0 | 0.0 | 5 | 50.0 | 5 | 50.0 | 3 | 30.0 | 0 | 0.0 | ||||
| B | 0 | 0.0 | 5 | 14.3 | 6 | 17.1 | 3 | 8.6 | 0 | 0.0 | |||||
| C | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | 2 | 9.1 | 0 | 0.0 | |||||
| D | 0 | 0.0 | 2 | 4.1 | 2 | 4.1 | 2 | 4.1 | 0 | 0.0 | |||||
| 0.25~1 | A | 0 | 0.0 | 2 | 20.0 | 2 | 20.0 | 1 | 10.0 | 0 | 0.0 | ||||
| B | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | 1 | 2.9 | 3 | 8.6 | |||||
| C | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | 1 | 4.5 | 1 | 4.5 | |||||
| D | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | 3 | 6.1 | 16 | 32.7 | |||||
| 1~8 | A | 5 | 50.0 | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | 7 | 70.0 | ||||
| B | 4 | 11.4 | 0 | 0.0 | 9 | 25.7 | 2 | 5.7 | 25 | 71.4 | |||||
| C | 0 | 0.0 | 0 | 0.0 | 1 | 4.5 | 0 | 0.0 | 21 | 95.5 | |||||
| D | 0 | 0.0 | 0 | 0.0 | 6 | 12.2 | 1 | 2.0 | 33 | 67.3 | |||||
| 8~16 | A | 2 | 20.0 | 0 | 0.0 | 1 | 10.0 | 0 | 0.0 | 1 | 10.0 | ||||
| B | 1 | 2.9 | 4 | 11.4 | 2 | 5.7 | 0 | 0.0 | 4 | 11.4 | |||||
| C | 0 | 0.0 | 4 | 18.2 | 13 | 59.1 | 0 | 0.0 | 0 | 0.0 | |||||
| D | 1 | 1.9 | 3 | 6.1 | 21 | 42.9 | 1 | 2.0 | 0 | 0.0 | |||||
| ≥16 | A | 3 | 30.0 | 3 | 30.0 | 2 | 20.0 | 6 | 60.0 | 2 | 20.0 | ||||
| B | 30 | 85.7 | 26 | 74.3 | 7 | 20.0 | 29 | 82.9 | 3 | 8.6 | |||||
| C | 22 | 100.0 | 18 | 81.8 | 8 | 36.4 | 19 | 86.4 | 0 | 0.0 | |||||
| D | 48 | 98.1 | 44 | 89.8 | 20 | 40.8 | 42 | 85.8 | 0 | 0.0 | |||||
| MIC范围(μg/ml) | 分离时间(1) | 庆大霉素 | 氯霉素 | 氨苄西林 | 红霉素 | 甲硝唑 | |||||||||
| 耐药株 | 耐效率(%) | 耐药株 | 耐效率(%) | 耐药株 | 耐效率(%) | 耐药株 | 耐效率(%) | 耐药株 | 耐效率(%) | ||||||
| <0.25 | A | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | ||||
| B | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | |||||
| C | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | |||||
| D | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | 2 | 4.1 | 2 | 4.1 | |||||
| 0.25~1 | A | 1 | 10.0 | 4 | 40.0 | 0 | 0.0 | 4 | 40.0 | 4 | 40.0 | ||||
| B | 6 | 17.1 | 0 | 0.0 | 0 | 0.0 | 6 | 17.1 | 6 | 17.1 | |||||
| C | 11 | 50.0 | 1 | 4.5 | 0 | 0.0 | 2 | 9.1 | 2 | 9.1 | |||||
| D | 34 | 69.4 | 3 | 6.1 | 2 | 4.1 | 12 | 24.5 | 12 | 24.5 | |||||
| 1~8 | A | 7 | 70.0 | 6 | 60.0 | 2 | 20.0 | 6 | 60.0 | 6 | 60.0 | ||||
| B | 26 | 74.3 | 33 | 94.3 | 8 | 22.9 | 29 | 82.9 | 29 | 82.9 | |||||
| C | 10 | 45.5 | 15 | 68.2 | 9 | 40.9 | 20 | 90.9 | 20 | 90.9 | |||||
| D | 10 | 10.0 | 22 | 44.9 | 9 | 18.4 | 35 | 71.4 | 35 | 71.4 | |||||
| 8~16 | A | 0 | 0.0 | 0 | 0.0 | 5 | 50.0 | ||||||||
| B | 1 | 2.9 | 2 | 5.7 | 20 | 57.1 | |||||||||
| C | 0 | 0.0 | 1 | 4.5 | 0 | 0.0 | |||||||||
| D | 1 | 2.0 | 8 | 16.3 | 12 | 24.5 | |||||||||
| ≥16 | A | 2 | 20.0 | 0 | 0.0 | 3 | 30.0 | ||||||||
| B | 2 | 5.7 | 0 | 0.0 | 7 | 20.0 | |||||||||
| C | 1 | 4.5 | 5 | 22.8 | 13 | 59.1 | |||||||||
| D | 4 | 8.2 | 16 | 32.7 | 26 | 53.0 | |||||||||
图2 10种抗生素的总体耐药率
Figure 2 Overall drug resistant rates to 10 antibiotics
图3 10种抗生素不同时期耐药率变化趋势
Figure 3 Change trend of drug resistance rates to 10 antibiotics
2.3 空肠弯曲菌多重耐药特征
试验结果发现2001年前分离的菌株以单重抗生素耐药最多(40%),2001-2010年间的菌株以4种抗生素耐药最为常见(28.6%和40.9%),2010年后分离的菌株6种抗生素耐药的比例最高(24.5%),并且出现了以往为发现的多达8种抗生素耐药现象,见表2。
表2 116株空肠弯曲菌多重耐药谱变化趋势
Table 2 Multidrug resistance of 116 C.jejuni strains
| 菌株分离时间段(1) | 1R | 2R | 3R | 4R | 5R | 6R | 7R | 8R | |||||||||||||||
| 菌株数 | 构成比(%) | 菌株数 | 构成比(%) | 菌株数 | 构成比(%) | 菌株数 | 构成比(%) | 菌株数 | 构成比(%) | 菌株数 | 构成比(%) | 菌株数 | 构成比(%) | 菌株数 | 构成比(%) | ||||||||
| A | 4 | 4/10 | 1 | 1/10 | 2 | 2/10 | 0 | 0.0 | 1 | 1/10 | 0 | 0.0 | 2 | 2/10 | 0 | 0.0 | |||||||
| B | 4 | 11.4 | 1 | 2.9 | 4 | 11.4 | 10 | 28.6 | 8 | 22.9 | 6 | 17.1 | 2 | 5.7 | 0 | 0.0 | |||||||
| C | 0 | 0.0 | 0 | 0.0 | 3 | 13.6 | 9 | 40.9 | 4 | 18.2 | 1 | 4.6 | 5 | 22.7 | 0 | 0.0 | |||||||
| D | 0 | 0.0 | 2 | 4.1 | 6 | 12.2 | 11 | 22.5 | 10 | 20.4 | 12 | 24.5 | 5 | 10.2 | 3 | 6.1 | |||||||
1R~8R分别代表1~8种抗生素耐药。
3 讨论
虽然空肠弯曲菌感染导致的腹泻属于自限性疾病,但是对于免疫力低下以及症状较严重的患者,抗生素的使用是有效且必须的。在抗生素规范使用的法规制定以前,我国一直以来存在临床抗生素的不规范使用并且在禽畜养殖过程中抗生素的添加也造成病原菌耐药率的增加。由于空肠弯曲菌分离培养相对困难,加之其药敏检测试验过程复杂,目前国内有关空肠弯曲菌的耐药数据缺乏。本研究对我国10年过程中分离菌株进行了10种抗生素的体外药敏试验,为我国人源空肠弯曲菌的耐药性研究提供了一定的基础数据。
本研究对116株空肠弯曲菌进行了10种临床以及动物饲料中添加的抗生素的药敏实验,结果表明,空肠弯曲菌对萘啶酸、左氧氟沙星、氯霉素、氨苄西林的耐药率呈现逐年增加的趋势,其中萘啶酸和左氧氟沙星目前已达到100%耐药的程度。萘啶酸、环丙沙星以及左氧氟沙星属于氟喹诺酮类抗生素,20世纪90年代,喹诺酮类抗生素被广泛应用于动物饲料添加,造成其耐药大量增加。本实验结果表明,2001年之前,萘啶酸对空肠弯曲菌还有一定的抑制作用,但随着时间的推进,耐药菌株大量增加。环丙沙星的耐药情况也类似,即使是敏感菌株,其MIC值也在随着时间的靠近慢慢增加,与文献[4]中结果相吻合。四环素也曾被作为动物饲料的生长促进剂而大量投放。加拿大报道腹泻患者分离空肠弯曲菌对四环素的耐药从1985年的19.1%增加为2007年的44% 。国内文献中报道过四环素的耐药为73.12%[4]。本研究发现,我国菌株对四环素一直维持着很高的耐药率,可能与我国四环素类抗生素早期的广泛使用有关。
国内对于人源空肠弯曲菌对链霉素的耐药性研究不多,1990年曾有文献报道过人源空肠弯曲菌对链霉素的耐药率为20%[8]。本研究试验数据表明,链霉素是对空肠弯曲菌敏感药物,2005年以后分离的菌株均为链霉素敏感菌株,由于链霉素的毒性较强,因此临床上该药物使用有着严格的适应症,而这种抗生素的规范使用尤其对于腹泻患者的规范使用或许是目前我国空肠弯曲菌仍对其敏感的主要原因。红霉素作为大环内酯类抗生素的主要代表药物,从20世纪70年代就被广泛应用于肠道感染的治疗,同时成为空肠弯曲菌治疗的首选用药。本研究结果表明,空肠弯曲菌对其高度敏感,且MIC值变化不大。因此,红霉素依旧可以作为今后国内临床空肠弯曲菌感染治疗的首选用药。
总之,本研究结果显示随着时间的推进,空肠弯曲菌耐药率较高,多重耐药现象严重,因此对于空肠弯曲菌耐药谱的检测及监测对于我国空肠弯曲菌感染的防控具有重要意义。
参考文献
[1] Ho TW, Mishu B, Li CY, et al. Guillain-Barre syndrome in northern China Relationship to Campylobacter jejuni infection and antiglycolipid antibodies [J].Brain,1995,118(3):597-605.
[2] Smith MV,Muldoon PJ.Campylobacter fetus subspecies jejuni(Vibrio fetus)fron commercially processed poultry[J].Applied Microbiology,1974,27(5):995-996.
[3] Zhang MJ, Gu YX. Molecular typing and antimicrobia susceptibility profiles of Campylobacter jejuni isolates from north China[J].Med Microbiol,2010,59(Pt 10):1171-1177.
[4] Xu HY,Huang JL,Bao GY.Prevalence and antimicrobial suscepti- bility of Campylobacter spp. in diarrhea patients in Yangzhou[J]. Chinese Journal of Zoonoses,2008,24(1):58-62.(in Chinese) 许海燕,黄金林,包广宇.扬州市区腹泻人群空肠弯曲菌和结肠弯曲菌流行状况及耐药性分析[J]. 中国人兽共患病学报,2008,24(1):58-62.
[5] Wardak S, Szych J, Zasada AA, et al. Antibiotic resistance of Campylobacter jejuni and Campylobacter coli clinical isolates from Poland [J]. Antimicrob Agents Chemother,2007,51(3):1123-1125.
[6] Papavasileiou E, Voyatzi A, Papavasileiou K, et al. Antimicrobial susceptibilities of Campylobacter jejuni isolates from hospitalized children in Athens, Greece, collected during 2004-2005[J]. Eur J Epidemiol,2007,22(1):77-78.
[7] Levesque S, Frost E, Michaud S. Comparison of antimicrobial resistance of Campylobacter jejuni isolated from humans, chickens, raw milk, and environmental water in Quebec [J].J Food Prot,2007,70(3):729-735.
[8] Lu L, Yu QF. Survey of drug susceptibility of Campylobacter jejuni isolated from different sources to 20 antibiotics [J]. Chinese Journal of Zoonoses,1990,6(3):45-46.(in Chinese) 卢玲, 郁庆福.不同来源的空肠弯曲菌对20 种抗生素敏感性调查[J]. 中国人兽共患病杂志, 1990, 6(3):45-46.
[2] Smith MV,Muldoon PJ.Campylobacter fetus subspecies jejuni(Vibrio fetus)fron commercially processed poultry[J].Applied Microbiology,1974,27(5):995-996.
[3] Zhang MJ, Gu YX. Molecular typing and antimicrobia susceptibility profiles of Campylobacter jejuni isolates from north China[J].Med Microbiol,2010,59(Pt 10):1171-1177.
[4] Xu HY,Huang JL,Bao GY.Prevalence and antimicrobial suscepti- bility of Campylobacter spp. in diarrhea patients in Yangzhou[J]. Chinese Journal of Zoonoses,2008,24(1):58-62.(in Chinese) 许海燕,黄金林,包广宇.扬州市区腹泻人群空肠弯曲菌和结肠弯曲菌流行状况及耐药性分析[J]. 中国人兽共患病学报,2008,24(1):58-62.
[5] Wardak S, Szych J, Zasada AA, et al. Antibiotic resistance of Campylobacter jejuni and Campylobacter coli clinical isolates from Poland [J]. Antimicrob Agents Chemother,2007,51(3):1123-1125.
[6] Papavasileiou E, Voyatzi A, Papavasileiou K, et al. Antimicrobial susceptibilities of Campylobacter jejuni isolates from hospitalized children in Athens, Greece, collected during 2004-2005[J]. Eur J Epidemiol,2007,22(1):77-78.
[7] Levesque S, Frost E, Michaud S. Comparison of antimicrobial resistance of Campylobacter jejuni isolated from humans, chickens, raw milk, and environmental water in Quebec [J].J Food Prot,2007,70(3):729-735.
[8] Lu L, Yu QF. Survey of drug susceptibility of Campylobacter jejuni isolated from different sources to 20 antibiotics [J]. Chinese Journal of Zoonoses,1990,6(3):45-46.(in Chinese) 卢玲, 郁庆福.不同来源的空肠弯曲菌对20 种抗生素敏感性调查[J]. 中国人兽共患病杂志, 1990, 6(3):45-46.