PFGE analysis of a food poisoning event caused by multi-serotype Vibrio parahemolyticus
SHANG Xiao-chun, ZHOU Xiao-hong, SHUAI Hui-qun, ZHAO Xue-qin, ZHANG Rui
Xiacheng District Center for Disease Control and Prevention, Hangzhou, Hangzhou 310003, Zhejiang, China
Abstract
Objective To understand the infection source of a food poisoning event by using pulsed-field gel electrophoresis (PFGE) to detect three serotypes of Vibrio parahemolyticus isolates to know their homology and virulence factors. Methods According to WS 271-2007 and other standards, the isolation, biochemical and serological identification, KP test, drug susceptibility test and virulence gene detection of Vibrio parahemolyticus strains were conducted and PFGE molecular typing was conducted. Results Vibrio parahemolyticus strains were isolated from 17 samples, which belonged to three serotypes. Serotype O3:K6 was predominant, accounting for 70.59%. The serotypes O2:K3 and O2:K28 had different proportions. Six genotypes were detected by PFGE molecular typing, based on 100% similarity. Genotype XC12001 was predominant, accounting for 58.82%, while genotypes XC12002-XC12006 had different proportions. Cluster analysis showed that XC12001 and XC12002,XC12004 and XC12005 had close genetic relationship. The susceptibility test results of 17 strains of Vibrio parahemolyticus were similar. The ampicillin and amoxicillin resistance rates of all strains were 100%. Ten strains of Vibrio parahemolyticus O3:K6 carried tdh virulence genes, while the test results of tdh, trh1 and trh2 gens of other Vibrio parahemolyticus strains were all negative. Conclusion This food poisoning event was caused by co-infections of different clonal Vibrio parahemolyticus, with serotype O3:K6 being predominant. PFGE can be used in the source tracing and molecular epidemiological study of food poisoning.
Keywords:
Vibrio parahemolyticus
serotype
susceptibility test
virulence gene
pulsed-field gel electrophoresis
一起多血清型副溶血性弧菌引起的食物中毒脉冲场凝胶电泳分析
商晓春, 周晓红, 帅慧群, 赵雪琴, 张睿
杭州市下城区疾病预防控制中心, 浙江 杭州 310003
摘要
目的 对一起食物中毒检出的3种血清型副溶血性弧菌(Vibrio parahaemolyticus,VP),采用脉冲场凝胶电泳(PFGE)进行同源性分析,以明确其传染源。 方法 参照 WS 271-2007等标准,进行副溶血性弧菌分离、生化和血清学鉴定、KP试验、药敏试验、毒力基因检测、PFGE分子分型,利用BioNumerics 软件对PFGE 分型图谱进行聚类分析。 结果 17份样品均检出副溶血性弧菌,血清型可分3个型别,以O3:K6为优势血清型,占70.59%,O2:K3和 O2:K28 两血清型所占比例不一。PFGE分子分型,按100%相似度可分6个基因型别,XC12001型为优势型别,占58.82%, XC12002~XC12006型所占比例不一,聚类分析显示XC12001和XC12002型、XC12004和XC12005型相似度较高。17株副溶血性弧菌药敏结果基本一致,对氨苄西林和阿莫西林耐药率高达100%。10株O3:K6型副溶血性弧菌只携带tdh毒力基因,其余菌株tdh、trh1、trh2毒力基因全部阴性。 结论 此起食物中毒是以O3:K6血清型为主的不同克隆群副溶血性弧菌混合感染所致,PFGE可有效应用于食物中毒溯源分析及分子流行病学研究。
内容大纲
1 材料与方法
1.1 材料 1.1.1 样本来源
患者粪便或肛拭样品12份,食堂留存食品5份,分别为尖椒牛柳、盐水明虾、三色山药、锦绣虾仁、肉丝刀豆。
1.1.2 试剂及培养基
SC增菌液、GN增菌液、碱性胨水、3%氯化钠碱性蛋白胨水、肠道菌增菌液、7.5%氯化钠肉汤、SS琼脂、XLD琼脂、MAC琼脂、4号琼脂、EMB琼脂、Baird-Parker琼脂、营养琼脂、TCBS琼脂、弧菌显色培养基、M-H 琼脂、3%氯化钠TSI琼脂、3%NaCl胰胨大豆琼脂、抗生素药敏纸片等均由青岛海博微生物试剂有限公司生产,我妻氏平板和嗜盐试验培养基由下城区CDC实验室配制。API20E生化实验条由法国生物梅里埃公司提供,副溶血性弧菌诊断血清购自日本生研株式会社DENKA。内切酶Xba Ⅰ 150 U (TaKaRa),Not Ⅰ 150 U(TaKaRa),琼脂糖SeaKem Gold Agarose(Cambraex Big Science Rockland Inc.USA),蛋白酶K (Merck, Gemany),SDS (AMRESCO USA)。以上所有试剂和培养基均经质量鉴定合格,有效期内使用。
1.1.3 主要仪器
ABI 7500 Real-time PCR System,USA;脉冲场凝胶电泳仪及其配套设备 CHEF Mapper,Bio-Rad USA;凝胶成像系统 Gel Doc2000, Bio-Rad USA;水浴摇床Julabo SW22,德国Julabo公司;浊度仪Densimat,BioMerieux France;BioNumerics 6.6分析软件,Applied Maths USA。
1.2 实验方法
1.2.1 菌株分离
按照 WS 271 2007、GB 4789.10 2010、GB 4789.5 2012等标准要求,进行沙门菌、致泻大肠埃希菌、霍乱弧菌、副溶血性弧菌、金黄色葡萄球菌、志贺菌检验。所有样品采用直接分离及增菌后分离同步进行的方法, 各自选择相应的培养基,置36 ℃或42 ℃培养16~24 h后挑取可疑菌落染色镜检, 纯培养后进行相应鉴定试验。
1.2.2 耐盐试验和生化试验
可疑菌落分纯后接种0%、3%、6%、8%、10% 氯化钠胨水和API20E生化实验条,置36 ℃培养,16~24 h 观察结果。
1.2.3 血清凝集试验
取单个菌落接种于3% NaCl胰胨大豆琼脂斜面, 36 ℃培养24 h, 进行K 抗原凝集后, 再用3% NaCl溶液冲洗斜面上的培养物, 经121 ℃灭菌1 h,然后4000 r/min 离心15 min, 弃上清液, 沉淀物用3% NaCl溶液洗3次, 每次4000 r/min离心15 min,挑取少许离心浓缩沉淀物做O 抗原凝集试验,同时做生理盐水对照。
1.2.4 神奈川现象试验
将纯化菌株点种我妻氏平板,36 ℃培养16~24 h观察溶血情况。
1.2.5 药敏试验
选用复方新诺明、阿米卡星、氨苄西林、环丙沙星、头孢噻吩、庆大霉素、诺氟沙星、头孢噻肟、妥布霉素、阿莫西林共10种抗生素药敏纸片,按照世界卫生组织(WHO)推荐的改良Kirby-Bauer 纸片法进行操作,结果判断采用美国临床和实验室标准化研究所(CLSI) 抗菌药物敏感性试验执行标准[1]。质控菌株金黄色葡萄球菌ATCC25923、大肠埃希菌ATCC25922 和铜绿假单胞菌ATCC27853,购自中国药品生物制品检定所,由下城区CDC菌种库保存。
1.2.6 毒力基因检测
1.2.6.1 核酸提取
刮取VP纯培养物少许,放入含有1 ml生理盐水的EP管内,振荡混匀后12 000 r/min离心1 min,去上清液,再加入1 ml生理盐水按上法操作共3次,去上清液后,加入1 ml双蒸水混匀后,置100 ℃恒温金属浴热裂解10 min, 待冷却后12 000 r/min离心1 min,取上清液为DNA模板备用。
1.2.6.2 引物和探针
毒力基因tdh、trh1和trh2 引物和探针序列按文献[2]设计,由大连宝生物公司合成;AQ4037 号菌株(trh1+) 、AT4 号菌株(trh2+)由杭州市CDC提供,tdh+菌株为下城区CDC分离,均由下城区CDC菌种库保存。
1.2.6.3 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction)
反应体系为TaKaRa生物技术公司的EX Taq 酶套(DRR001A),使用 ABI 7500 real-time PCR System 按下列条件参数进行检测:95 ℃ 3 min 预变性后,以94 ℃ 15 s,58 ℃ 45 s,扩增45个循环,于58 ℃分别测定荧光信号,trh1和trh2用FAM通道, tdh用JOE通道。
1.2.7 PFGE 检测及结果分析
1.2.7.1 胶块制备
用灭菌棉签刮取营养琼脂上新鲜菌落至CSB 中,浊度仪测浊度至4.2 McF。取400 μl该菌液加入20 μl蛋白酶K溶液,与含1%SDS 熔化的1% Seakem Gold 混合后注模,制成琼脂糖包埋胶块。
1.2.7.2 细胞的裂解
在螺口盖管中,加入5 μl蛋白酶K和细胞裂解液(CLB)混合液,再放入已制备好的全基因组DNA 胶块,54 ℃水浴摇床孵育1.5~2 h。
1.2.7.3 胶块的洗涤
弃去CLB, 先后用加50 ℃预热纯水和TE,摇床中反复洗涤6次,置TE中浸泡,4 ℃冰箱保存备用。
1.2.7.4 酶切
将洗好的胶块取出, 切成约2 mm 宽的胶, 置于1.5 ml的离心管中, 每管中加入200 μl 酶缓冲液平衡15 min, 吸出缓冲液, 加入酶切反应体系, 酶切2 h 以上。
1.2.7.5 上样和电泳
将酶切后样品胶块于置胶模具上,缓缓注入1% Seakem Gold胶, 冷却后在Bio-Rad CHEF Mapper 系统上进行脉冲场电泳。电泳条件:电压6 V/cm, 电场夹角120°,脉冲参数2.16~63.8 s,电泳温度14 ℃,电泳缓冲液0.5×TBE,电泳时间为20~22 h。使用沙门菌H9812 为标准相对分子质量。
1.2.7.6 染色
电泳结束后, 将凝胶放入1 ∶ 10 000的gelred染液中染色30 min,再放入去离子水中,脱色120 min。
1.2.7.7 读胶
用GelDoc2000凝胶成像仪读胶成像, 转换成TIEF图像保存。
1.2.7.8 数据分析
BioNumerics 6.6 数据库软件对 PFGE 带型之间的同源性电泳图谱进行处理,使用UPGMA方法进行聚类分析,采用Dice系数来衡量,条带位置的差异容许度选择1.5%,优化值选择1.5%,绘制出各菌株间的同源性关系图谱。出现一个不同条带即判为不同的型别,按照PulseNet China 推荐的命名方式,对每种不同的带型进行命名。
2 结果
2.1 分离培养结果 17份样本经增菌后接种弧菌科显色平板,每一样本分别在显色平板随机挑取2个可疑V菌落进行鉴定,结果均为副溶血性弧菌。其余致病菌(沙门菌、志贺菌、霍乱弧菌、致泻大肠埃希菌、金黄色葡萄球菌)均未检出。
2.2 形态培养特性
从17份样本中检出的VP在弧菌科显色平板上的菌落均为紫色、较大、不透明,在3%氯化钠三糖铁斜面上呈现斜面红色、底层黄色、无气体、不产硫化氢。
2.3 菌体形态及动力
涂片染色为革兰阴性无芽胞球杆菌、杆菌。压滴样本观察该菌运动活泼。
2.4 生化反应特征
每一样本均从弧菌科显色平板上随机挑取2个可疑菌落,经3%氯化钠TSI琼脂初步鉴定符合VP的菌株, 全部采用API20E 生化实验条进行生化试验,鉴定结果为副溶血性弧菌(id=99.9%,T=0.86),编码均为4146107。具体生化试验结果: 氧化酶、赖氨酸、鸟氨酸、吲哚、明胶、葡萄糖、甘露醇、苦杏仁苷、阿拉伯糖试验阳性; ONPG、精氨酸、柠檬酸钠、硫化氢、脲素、色氨酸、V-P、肌醇、山梨醇、鼠李糖、蔗糖、密二糖试验阴性。耐盐试验为3%、6%、8%氯化钠胰胨水生长良好, 0%、10%氯化钠胰胨水中不生长。
2.5 血清学试验结果
17株疑似VP,经血清学鉴定可分3个血清型,分别是O3 ∶ K6 型12株,占70.59%,O2 ∶ K3 型3株,占17.65%,O2 ∶ K28型2株,占11.76%。12位VP感染者,除1位为O2 ∶ K3血清型外,其余均为O3 ∶ K6血清型;5份剩余食物,分属3种血清型,依次为O2 ∶ K3血清型2株,O2 ∶ K28血清型2株和O3 ∶ K6血清1株。具体血清型别分布及神奈川现象试验(Kanagawa phenomenon test, KP)结果见表1。
2.6 毒力基因检测结果
采用荧光定量PCR 方法,对17株VP进行耐热直接溶血素基因(tdh) 和耐热直接溶血素相关溶血素基因(trh1和trh2)检测,结果17 株VP,trh1 和trh2 毒力基因均为阴性,其中10株VP含有tdh 毒力基因,携带率为58.82%,其余7株tdh均阴性。毒力基因检测结果见表1。
表1 17株副溶血性弧菌血清型、KP试验、毒力基因及PFGE分型结果
Table 1 Results of serotyping, Kanagawa phenomenon test, virulence gene detection and PFGE typing of 17 Vibrio parahaemolyticus strains
| 编号 | 菌株来源 | 菌株血清型 | KP试验 | 毒力基因 | PFGE带型 | ||
| tdh | trh1 | trh2 | |||||
| 1 | 粪便 | O2 ∶ K3 | + | - | - | - | XC12004 |
| 2 | 粪便 | O3 ∶ K6 | + | - | - | - | XC12002 |
| 3 | 粪便 | O3 ∶ K6 | + | + | - | - | XC12001 |
| 4 | 粪便 | O3 ∶ K6 | + | + | - | - | XC12001 |
| 5 | 粪便 | O3 ∶ K6 | + | + | - | - | XC12001 |
| 6 | 粪便 | O3 ∶ K6 | + | + | - | - | XC12001 |
| 7 | 肉丝刀豆 | O2 ∶ K28 | - | - | - | - | XC12003 |
| 8 | 盐水明虾 | O2 ∶ K3 | + | - | - | - | XC12004 |
| 9 | 尖椒牛柳 | O3 ∶ K6 | + | - | - | - | XC12002 |
| 10 | 三色山药 | O2 ∶ K3 | + | - | - | - | XC12005 |
| 11 | 锦绣虾仁 | O2 ∶ K28 | - | - | - | - | XC12006 |
| 12 | 粪便 | O3 ∶ K6 | + | + | - | - | XC12001 |
| 13 | 粪便 | O3 ∶ K6 | + | + | - | - | XC12001 |
| 14 | 粪便 | O3 ∶ K6 | + | + | - | - | XC12001 |
| 15 | 粪便 | O3 ∶ K6 | + | + | - | - | XC12001 |
| 16 | 粪便 | O3 ∶ K6 | + | + | - | - | XC12001 |
| 17 | 粪便 | O3 ∶ K6 | + | + | - | - | XC12001 |
2.7 药敏试验结果
选用10 种抗生素进行药敏试验,17株VP药敏结果基本一致,对氨苄西林和阿莫西林耐药率为100%;对头孢噻吩和阿米卡星耐药率依次为94.12% 和5.88%;庆大霉素和诺氟沙星敏感率为100%,复方新诺明、环丙沙星和头孢噻肟3种抗生素敏感率均为94.12%,妥布霉素敏感率64.71%,见表2。
表2 17株副溶血性弧菌药敏试验结果
Table 2 Drug susceptibility of 17 Vibrio parahaemolyticus strains
| 抗生素 | 耐药 | 中介 | 敏感 | |||||
| 株数 | 耐药率/% | 株数 | 耐药率/% | 株数 | 耐药率/% | |||
| 复方新诺明(SXT) | 0 | 0.00 | 1 | 5.88 | 16 | 94.12 | ||
| 阿米卡星(AK) | 1 | 5.88 | 15 | 88.24 | 1 | 5.88 | ||
| 氨苄西林(AMP) | 17 | 100.00 | 0 | 0.00 | 0 | 0.00 | ||
| 环丙沙星(CIP) | 0 | 0.00 | 1 | 5.88 | 16 | 94.12 | ||
| 头孢噻吩(KF) | 16 | 94.12 | 1 | 5.88 | 0 | 0.00 | ||
| 庆大霉素(GEN) | 0 | 0.00 | 0 | 0.00 | 17 | 100.00 | ||
| 诺氟沙星(NOR) | 0 | 0.00 | 0 | 0.00 | 17 | 100.00 | ||
| 头孢噻肟(CTX) | 0 | 0.00 | 1 | 5.88 | 16 | 94.12 | ||
| 妥布霉素(TOB) | 0 | 0.00 | 6 | 35.29 | 11 | 64.71 | ||
| 阿莫西林(AML) | 17 | 100.00 | 0 | 0.00 | 0 | 0.00 | ||
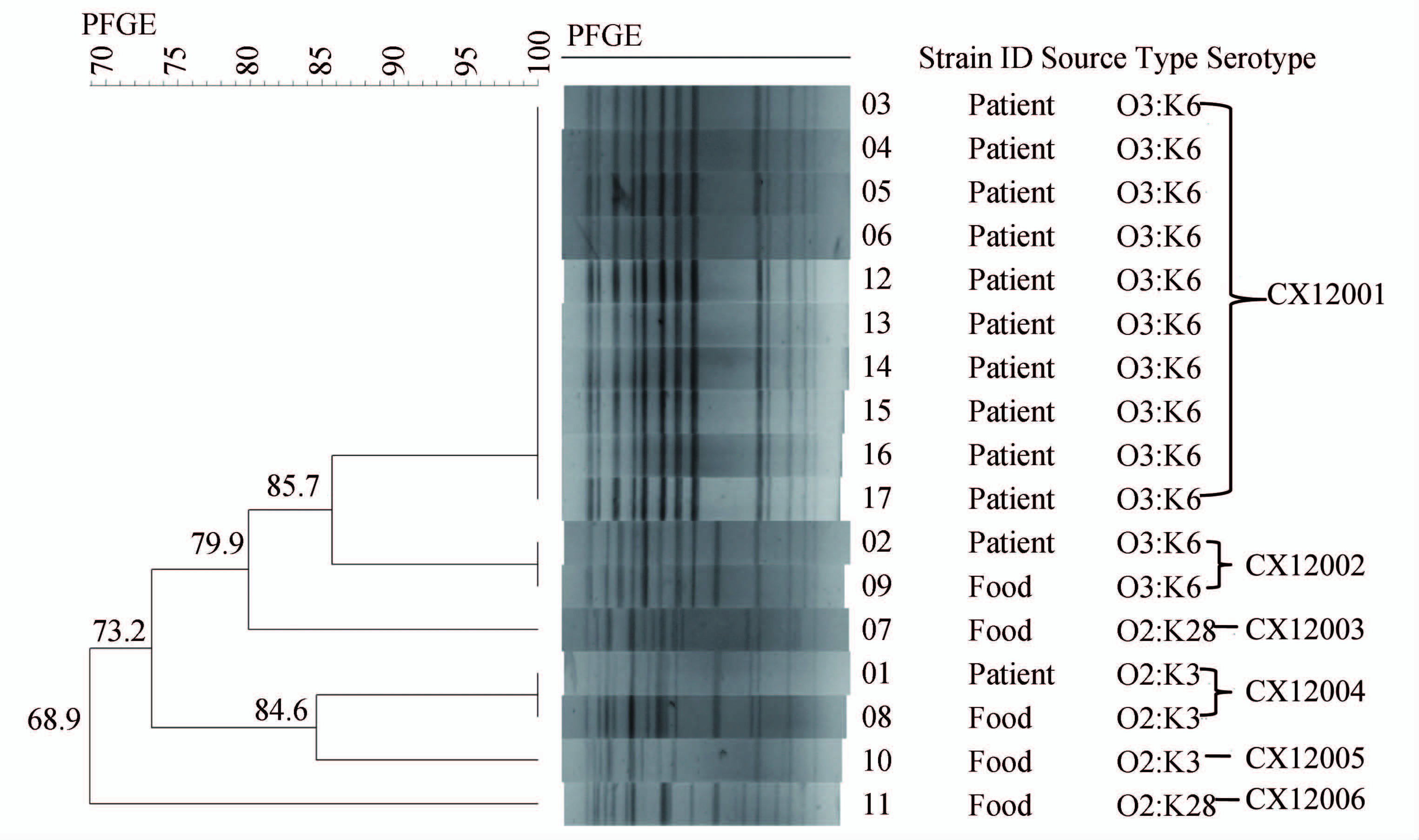
2.8 PFGE分型结果
(1) 17株VP DNA全基因组经过限制性内切酶XbaⅠ酶切后,进行PFGE,DNA片段可得较好分离,分型率100%。每株菌约产生13~18清晰电泳条带,酶切片段分子质量在20.5~1135 kb之间。
(2) 运用BioNumerics 6.6 数据库软件对 PFGE 带型之间的同源性电泳图谱进行处理,采用UPGMA方法进行聚类分析,17株VP条带相似度在68.9%~100%之间。按照100%相似度可将菌株酶切图谱分6种PFGE带型。其中XC12001型10株,为主要优势型别,占总株数58.82%;XC12002型和XC12004型各2株,各占总株数11.76%;XC12003、XC12005 、XC12006三型各1株,各占总株数5.88%,17株VP PFGE聚类分析见图1。菌株来源、血清型、PFGE型别之间关系存在如下特点:①12株O3 ∶ K6 血清型菌株,分属XC12001和XC12002两种带型。其中XC12001型10株,均分离自患者标本;XC12002型2株,患者和食品标本各1株。XC12001和XC12002带型间相似度为85.7%。②3株O2 ∶ K3血清型菌株,分属XC12004和XC12005两种带型。其中XC12004型2株,分离自患者和食品标本各1株;XC12005型1株,分离自食品样本。XC12004和XC12005带型间相似度为84.5%。③2株O2 ∶ K28血清型菌株,分属XC12003和XC12006两种带型,均分离自食品,XC12003和XC12006带型相似度低,为各自独立的克隆株。
图1 17株副溶血弧菌PFGE聚类分析图
Figure 1 PFGE cluster of 17 Vibrio parahaemolyticus strains
3 讨论
通过菌株血清型、毒力基因、KP试验、PFGE、菌株来源五方面综合分析可见,XC12001和XC12002带型内的12株O3 ∶ K6型菌株,XC12004和XC12005带型内的3株O2 ∶ K3型菌株,呈现同一血清型组内都分离到病例源和食品源标本,且组内菌株tdh和trh毒力基因、KF试验结果一致。PFGE呈现XC12001和XC12002带型间,XC12004和XC12005带型间,都只有1~3个条带的差别,XC12001和XC12002型相似度为85.7%, XC12004和XC12005型相似度84.6%(近似85%),提示组内菌株间具有高度同源性,可能来自同一污染源。2株O2 ∶ K28型菌株,分属XC12003和XC12006带型,仅从食品中分离到,同一血清型菌株间tdh和trh毒力基因、KF试验结果完全一致,但PFGE带型间无相关性,为各自独立克隆株。从毒力基因tdh与PFGE 分型的关系来看,具有tdh毒力基因型的菌株都在同一XC12001型聚类群中,表现为10株tdh阳性trh阴性的菌株,全部为O3 ∶ K6 血清型,且都分离自患者,患者中tdh 基因携带率达到90.91%,显示tdh 基因与菌株的致病性有高度的相关性。
根据Tenover 等[3]提出了有关菌株同源性的判别标准, 按其电泳条带差异分为:无差异,说明为相同菌株;有1~3 条带的差异,说明菌株间有相近关系,且只有单基因的改变;4~6 条带的差异,说明菌株间可能有相近关系, 表示出有2个独立基因的差异;如菌株间有6 条带或更多条带差异, 说明有3个或更多基因的变化, 被视为无相关性。由于细菌的高变异性, 判断是否是同一菌株时允许一定的变异存在,Talon等 [4]在解释PFGE 结果时提出将具有85%以上相同条带的菌株认为是相同的菌株, 50%以上的条带不相同菌株被认为流行病学不相关。据此理论我们推断本次食物中毒是以O3 ∶ K6和O2 ∶ K3两种血清型为主的不同克隆群VP混合感染所致。被O3 ∶ K6型VP污染的尖椒牛柳、被O2 ∶ K3型VP污染的盐水明虾与三色山药,是引起本次食物中毒的主要食物。虽然O2 ∶ K28型VP没有相应的病例出现,仅从2份菜肴中检出,但足以证明该食堂厨房用具已被多种血清型副溶血性弧菌污染。食堂厨房用具生熟未严格分开,公用餐具无明显的生熟区分标志,食品储藏保管不当等食品安全管理上的疏漏,是造成副溶血性弧菌迅速繁殖与多重污染的根本原因。
将此次分离的12株O3 ∶ K6血清型VP的PFGE图谱与本区近年发生的2起食物中毒中分离的22株O3 ∶ K6血清型VP的PFGE图谱比较[5],2008年一起食物中毒分离的11株O3 ∶ K6菌株PFGEF分3个带型,其中6株与本次优势带型XC12001完全一致,4株与XC12001带型仅1个条带差异,1株与XC12001带型2个条带差异; 2011年一起食物中毒 分离的11株O3 ∶ K6菌株PFGEF分型仅有1个带型,与本次优势带型XC12001完全一致。而此次食物中毒XC12002带型未在近年2起食物中毒中出现。比较的34株O3 ∶ K6血清型VP共分5种带型,相互间相似度为85.5%~100%,提示这些菌株在分子水平具有紧密相关和高度同源。本起食物中毒分离的O2 ∶ K28和O2 ∶ K3两个血清型VP,在本区近些年人源和食品源VP中很少检出,未进行PFGE分子分型;同时收索本地区往年人源和食品源VP,也未有这两种血清型VP的PFGE分子分型报道,故无法进行比对溯源分析。
耐药试验显示,17株VP的药敏结果基本一致,结果与文献报道基本一致[6]。由于滥用抗菌药物以及细菌间耐药基因的传递等原因,细菌耐药性检测越来越受到重视,密切关注副溶血性弧菌对抗菌药物的耐药状况,以指导临床合理使用抗菌药物将成为我们关注的重点。
参考文献
[1] Clinical and Laboratory Standardize Institute(CISI) Antimicrobial Susceptibility Testing Standards M2-M9 and M7-A7. 2007-08-20. http://www.clsi org.
[2] Zhang W, Pan JC,Meng DM, et al. Development of multiplex rea-l time PCR for detection of Toxigenic Vibrio cholerae and Virbio parahaemolyticus[J]. Microbiology,2007,34(5):950-954.(in Chinese) 张蔚, 潘劲草,孟冬梅,等.多重实时PCR 检测产毒素性霍乱弧菌和副溶血弧菌[J]. 微生物学通报,2007,34(5):950-954.
[3] Tenover FC,Arbeit RD, Goering RV, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis criteria for bacterial strain typing[J].J Clin Microbiol,1995,33:2233-2239.
[4] Talon D,cailleaux V, Thouverez M, et al. Discriminatory power and usefulness of pulsed-field gel electrophoresis in epidemiological studies of pseudomonas aeruginosa[J].J Hop Infection,1996,32:135-145.
[5] Zhao XQ,Shang XC,Zhang R. PFGE technology for study on homology of Vibrio parahaemolyticus strains in a food poisoning event[J]. Chinese Journal of Health Laboratory Technology,2012,22(10):2388-2390.(in Chinese) 赵雪琴,商晓春,张睿.PFGE 技术对一起副溶血性弧菌引起食物中毒的同源性研究[J].中国卫生检验杂志,2012,22(10):2388-2390.
[6] Wen QW,Ju CY,Zeng XS, et al. Study on PFGE molecular typing and antimicrobial resistance of Vibrio parahaemolyticus[J]. Journal of Preventive Medicine Information,2009,25(3):190-193.(in Chinese) 温群文,鞠长燕,曾小思,等. 副溶血性弧菌食物中毒的分子分型及耐药性分析[J].预防医学情报学杂志,2009,25(3):190-193.
[2] Zhang W, Pan JC,Meng DM, et al. Development of multiplex rea-l time PCR for detection of Toxigenic Vibrio cholerae and Virbio parahaemolyticus[J]. Microbiology,2007,34(5):950-954.(in Chinese) 张蔚, 潘劲草,孟冬梅,等.多重实时PCR 检测产毒素性霍乱弧菌和副溶血弧菌[J]. 微生物学通报,2007,34(5):950-954.
[3] Tenover FC,Arbeit RD, Goering RV, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis criteria for bacterial strain typing[J].J Clin Microbiol,1995,33:2233-2239.
[4] Talon D,cailleaux V, Thouverez M, et al. Discriminatory power and usefulness of pulsed-field gel electrophoresis in epidemiological studies of pseudomonas aeruginosa[J].J Hop Infection,1996,32:135-145.
[5] Zhao XQ,Shang XC,Zhang R. PFGE technology for study on homology of Vibrio parahaemolyticus strains in a food poisoning event[J]. Chinese Journal of Health Laboratory Technology,2012,22(10):2388-2390.(in Chinese) 赵雪琴,商晓春,张睿.PFGE 技术对一起副溶血性弧菌引起食物中毒的同源性研究[J].中国卫生检验杂志,2012,22(10):2388-2390.
[6] Wen QW,Ju CY,Zeng XS, et al. Study on PFGE molecular typing and antimicrobial resistance of Vibrio parahaemolyticus[J]. Journal of Preventive Medicine Information,2009,25(3):190-193.(in Chinese) 温群文,鞠长燕,曾小思,等. 副溶血性弧菌食物中毒的分子分型及耐药性分析[J].预防医学情报学杂志,2009,25(3):190-193.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 商晓春 | |
| 周晓红 | |
| 帅慧群 | |
| 赵雪琴 | |
| 张睿 | |
| PubMed | |
| Article by SHANG Xiao-chun | |
| Article by ZHOU Xiao-hong | |
| Article by SHUAI Hui-qun | |
| Article by ZHAO Xue-qin | |
| Article by ZHANG Rui | |