-
1 材料与方法
- 1.1 标本来源
- 1.2 麻疹、风疹IgM抗体测定
- 1.3 麻疹病毒分离
- 1.4 核糖核酸(RNA)提取及测序
- 1.5 序列分析
- 2.1 血清IgM检测
- 2.2 麻疹病毒分离和鉴定
- 2.3 分离毒株基因型的确定
麻疹是由副黏病毒科麻疹病毒属的麻疹病毒引起的一种高传染性的急性发热出疹性疾病,严重危害儿童健康。目前已发现麻疹病毒共有24个基因型,曾经在或正在人类中循环[1],不同的麻疹病毒基因型往往在一定时期局限在或多或少的地理区域内流行 [2]。将本地分离到的麻疹病毒与在全球各地流行的麻疹毒株基因型别进行对比,是判断本地发现的麻疹病例为本土病例还是输入性病例的重要依据。
北京市流行的优势本土毒株与全国一致,为 H1基因型。除1994年北京分离1株输入性H2基因型麻疹病毒外[3],北京市还未报道分离出其他基因型输入性麻疹病例。随着国际交往频繁,及麻疹监测工作的深入展开,北京作为中国首都,发生境外输入性麻疹病例的机会将会不断增多。北京市朝阳区疾病预防控制中心(CDC)于2013年3月10日接到1例麻疹疑似病例报告,患者来自印度尼西亚,来北京第12天发病,结合流行病学信息与实验室检测结果,最终证实为输入性D9基因型麻疹病例,该基因型麻疹病例为北京市首次出现,现将结果报告如下。
1 材料与方法1.1 标本来源
标本来源于1名25岁印度尼西亚籍女留学生。该患者2013年2月27日入境来北京,第12天出现麻疹症状。在患者出疹第1天采集静脉血3 ml,第2天采集咽拭子和尿液30 ml。血液、咽拭子、尿液标本的采集和处理方法参照《全国麻疹监测方案》。血液标本于常温下1500 r/min离心20 min,分离血清。咽拭子保存在2 ml麻疹病毒标本运输液(含2%牛血清和终浓度含青霉素1000 U/ml、链霉素1000 μg/ml、制霉菌素25 U/ml的细胞培养液)中。尿液标本采集后,4 ℃ 1500 r/min离心10 min,弃上清,用2 ml麻疹病毒标本运输液重新悬浮沉淀。上述处理后的标本-80 ℃保存备用。
1.2 麻疹、风疹IgM抗体测定使用德国维润赛润研发有限公司的麻疹和风疹IgM检测试剂盒,实验步骤参考其使用说明书,进行统一标准的酶联免疫吸附试验(ELISA)检测。
1.3 麻疹病毒分离取-80 ℃的咽拭子和尿液标本冻融1~2次。接种0.5 ml在已长成单层Vero/ SLAM细胞瓶中,标记好样本编号和接种日期。37 ℃吸附1.5~2 h,倒掉吸附的液体,加维持液5 ml,每天观察细胞病变(CPE)。50%~75%细胞呈现CPE时收获,以备传代、鉴定。培养5 d,如没有出现CPE,盲传第2代,仍无CPE则判为阴性。
1.4 核糖核酸(RNA)提取及测序使用QIAGEN公司的QIAamp Viral RNA Mini Kit,提取细胞培养液中的病毒RNA,具体方法参照说明书。
反转录-聚合酶链反应(RT-PCR):使用invitrogen SuperScriptTMⅢ First-Strand Synthesis for RT-PCR Kit, 在反转录酶作用下,用随机引物于PCR仪上合成互补脱氧核糖核酸(cDNA)。具体方法参照说明书。 参照美国CDC引物[4],上游引物为60(序列为5′-GCT ATG CCA TGG GAG TAG GAG TGG-3′),下游引物为63(序列为5′-CCT CGG CCT CTC GCA CCT AGT-3′)。
60和63引物分别位于N基因起始编码1109~1132和1765~1785处,用于扩增N基因羧基末端的676个核苷酸(bp)片段。用PCR试剂盒进行PCR扩增,首先高温启动94 ℃ 5 min,然后进行30个循环的扩增:94 ℃ 30 s,50 ℃ 30 s,72 ℃ 1 min。最后72 ℃ 10 min。循环结束后,取PCR扩增的产物用QIAGEN毛细管电泳仪检测。将长度为676 bp的PCR产物送于上海生工生物技术有限公司进行测序。
1.5 序列分析应用BioEdit、clustalx、Mega 4.0 软件对分离的野毒株N基因末端450 bp序列与24个基因型的32株参考株进行亲缘关系分析,构建基因亲缘关系树,进行遗传距离及核苷酸同源性分析。 参考株基因序列信息来自中国CDC病毒病预防控制所麻疹参比实验室。
2 结果2.1 血清IgM检测
血清ELISA检测结果显示,麻疹IgM抗体阳性,风疹IgM抗体阴性,确诊该病例为麻疹病例。
2.2 麻疹病毒分离和鉴定将咽拭子和尿液标本液接种到Vero/SLAM 细胞,接种5天后,尿液标本发生细胞融合病变,分离到麻疹病毒。接种7天后咽拭子标本没有细胞病变产生,盲传第二代,7天后仍然没有细胞病变。
尿液标本分离到麻疹病毒的PCR产物经毛细管电泳仪分析,在676 bp处有一明显阳性带。将分离到的北京麻疹病毒命名为:BJCY13026-2。
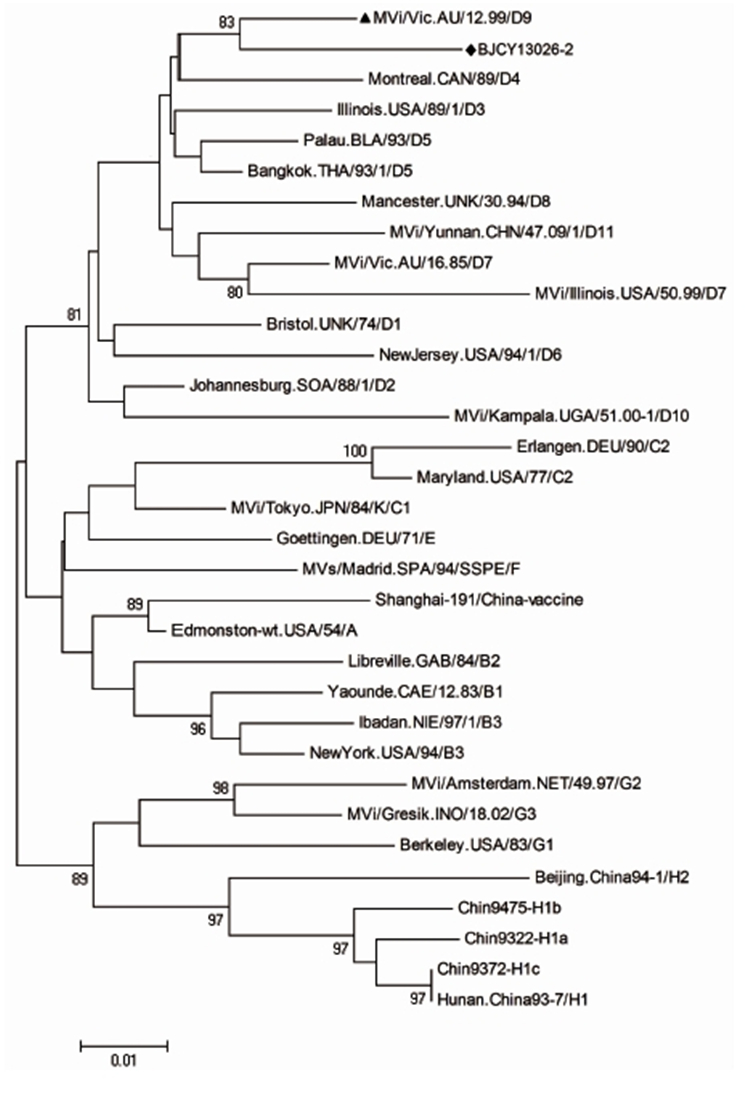
2.3 分离毒株基因型的确定利用Bioedit和Mega 4.0 软件,将所获得的麻疹病毒分离株BJCY13026-2编码N蛋白羧基末端450碱基序列与WHO 基因库中24个基因型的32株参考株的对应序列做基因亲缘性关系分析。结果见图1。
结果显示该毒株和世界卫生组织D9基因型代表株Victoria.AUS(维多利亚.澳大利亚)12.99在基因亲缘性关系树上同属一个分支,其可信度为83。核苷酸同源性为95.8%,氨基酸同源性为96%;和其他23个基因型代表株的核苷酸和氨基酸同源性分别在88.1%~95.6%和90.7%~96.7%。中国大陆目前所使用的麻疹疫苗株沪191相比对,其核苷酸和氨基酸同源性分别为91.1%和90.0%;和中国目前流行的麻疹病毒绝对优势本土基因型H1a基因型代表株相比对,其核苷酸和氨基酸同源性分别为89.4%和91.3%。
注:◆为北京市分离株; ▲为WHO D9基因型参考株;基于编码N蛋白羧基末端450个核苷酸序列。
图1 北京市分离株BJCY13026-2和WHO 24个麻疹基因型参考株亲缘关系树
Figure 1 Phylogenetic tree of BJCY13026-2 and 24 WHO genotype reference strains 3 讨论
本次发现的输入性麻疹病例由麻疹病毒D9基因型引起,为本市首次监测到的D9基因型麻疹病毒。
自从1993年我国有麻疹病毒实验室监测数据一来,H1基因型麻疹病毒一直是我国本土流行的麻疹病毒,分为H1a、H1b、H1c三个基因亚型。其中H1c基因亚型的流行自1995年已经消失; H1b基因亚型的传播于2006年被阻断;目前 H1a基因亚型为中国麻疹病毒本土流行的优势亚型[3]。
2009年起中国部分省(市)相继监测到D11、D4、D9基因型麻疹病毒引起的输入性麻疹病例[5-7]。 D9基因型麻疹病毒是在澳大利亚输入性病例中由Chibo等[8]首先发现。之后泰国、印度尼西亚、东帝汶、缅甸、日本等国家相继出现D9基因型麻疹病毒引起的暴发和流行[9-10]。本次北京的输入性D9基因型麻疹病例经流行病学调查显示来源于印度尼西亚。
越来越多输入性病例的发现表明我国以实验室为基础的麻疹监测工作已经深入展开,同时也说明随着麻疹消除工作的不断开展,麻疹的本土病例将逐渐减少,输入性病例则相对增加。在这种转变的过程中,以实验室为基础的麻疹监测工作将发挥越来越重要的作用。
[2] Mulders MN, Truong AT, Muller CP. Monitoring of measles elimination using molecular epidemiology[J]. Vaccine, 2001, 21(19):2245-2249.
[3] Zhang Y, Ji YX, Zhu Z, et al. Circulating pattern analysis for endemic measles viruses in mainland of China[J]. Chinese Journal of Vaccines and Immunization, 2009, 15(2):97-103.(in Chinese) 张燕, 姬奕昕, 朱贞, 等.中国流行的麻疹病毒基因型和亚型趋势分析[J].中国疫苗和免疫, 2009, 15(2):97-103.
[4] Rota PA.RNA extraction and reverse transcription-polymerase chain reaction(RT-PCR). Standard protocols for molecular epidemiology measles section, CDC, 2002, Available from:http://www.cdc.gov/
[5] Zhang Y, Ding ZR, Wang HL, et al. New measles virus genotypes associated with outbreak, China[J].Emerg Infect Dis, 2010, 16(6):943-947.
[6] Wang HL, Zheng L, Wang JT, et al. The first imported measles case associated with genotype D4 measles virus in China[J]. Chinese Journal of Virology, 2010, 26(2):103-108.(in Chinese) 王慧玲, 郑蕾, 王骥涛, 等.中国境内首次发现输入性D4基因型麻疹病例[J].病毒学报, 2010, 26(2):103-108.
[7] Zhang Y, He JL, Sun L, et al. D9 measles virus was first isolated from an imported measles case in Sichuan province of China[J]. Chinese Journal of Vaccines and Immunization, 2009, 15(4):304-309.(in Chinese) 张燕, 何吉兰, 孙莉, 等.我国首例输人性D9基因型麻疹病毒的分离和鉴定[J].中国疫苗和免疫, 2009, 15(4):304-309.
[8] Chibo D, Riddell M, Catton M, et al. Studies of measles viruses circulating in Australia between 1999 and 2001 reveals a new genotype[J].Virus Res, 2003, 91(2):213-221.
[9] Rota PA, Brown K, Mankertz A, et al. Global distribution of measles genotypes and measles molecular epidemiology[J].J Infect Dis, 2011, 204 Suppl 1:S514-523.
[10] Mizuta K, Abiko S, Murata T. A outbreak of measles virus infection due to genotype D9 at a junior high school in Yamagata, Japan in 2004[J]. Japanese J Infectious, 2005, 58(2):98-100.