-
1 材料与方法
- 1.1 研究对象
- 1.2 抗病毒治疗和随访
- 1.3 检测方法
- 1.3.1 标本采集、仪器与试剂
- 1.3.2 CD+4T淋巴细胞绝对计数
- 1.3.3 PD-1/PD-L1检测
- 1.3.4 病毒载量检测
- 1.4 统计学分析
- 2.1 AIDS患者抗病毒前后外周血PD-1、PD-L1的表达水平
- 2.2 不同CD+4T细胞基数患者外周PD-1、PD-L1的表达水平
- 2.3 治疗前后PD-1、PD-L1细胞的表达水平与CD+4T细胞数目、HIV RNA的相关性分析
人类免疫缺陷病毒(human immunodeficiency virus, HIV;艾滋病病毒)特异性T细胞在控制HIV病毒感染和病毒复制中起着重要作用,它可通过细胞毒性作用直接杀伤病毒感染的细胞,并可分泌一些细胞因子,阻断病毒进入靶细胞[1],但由于其细胞在HIV感染者体内存在许多的功能缺陷,从而严重影响了HIV特异性T细胞的活性。程序性死亡因子-1及其配体是近年来研究发现的最具代表的负性共刺激信号通路之一,其高表达与T细胞免疫缺陷密切相关,是导致T淋巴细胞功能耗竭的重要机制之一[2][3]。目前高效抗反转录病毒疗法(highly active antiretroviral treatment, HAART)是国内外公认获得性免疫缺陷综合征(acquired immunodeficiency syndrome, AIDS,艾滋病)的有效治疗手段,最大限度地,降低血浆病毒载量,促进患者体内免疫功能的恢复和重建。国内外研究显示程序性死亡因子(programmed death-1,PD-1)和配体(programmed cell death 1 ligand l,PD-L1)信号通路影响机体的抗HIV免疫应答,但其在抗病毒免疫中所起的生物学效应尚不清楚。本研究通过观察45例AIDS患者HAAPRT治疗不同时期外周血中外周血PD-1/PD-L1表达水平的变化,初步研究HAART治疗过程中PD-1/PD-L1负性抑制途径的表达特点。
1 材料与方法1.1 研究对象
45例AIDS患者来源于2010 2012年绍兴市第六人民医院或绍兴市疾病预防控制中心(CDC)就诊者,其中男性31例,女性14 例;年龄为18~64岁,平均为(39.17±10.64)岁。所有感染者均经浙江省或绍兴市CDC免疫印迹试验确证HIV-1抗体阳性,并在入组前均未进行过抗病毒治疗,入选的 所有感染者均在全面了解本研究方案的基础上签署知情同意书。研究方案经本院医学伦理委员会批准。21例正常对照组均为该院健康体检者,其中男性14例,女性7例,年龄20~55岁,平均(36.47±12.32)岁,二组间性别、年龄差异均无统计学意义(P>0.05)。
1.2 抗病毒治疗和随访入组患者均给予HARRT治疗:齐多夫定(AZT)300 mg+拉米夫定(3TC)300 mg(qd)+奈韦拉平(NVP)200 mg(bid)/依非韦仑(EFV)600 mg(qd),并跟踪随访24周。
1.3 检测方法1.3.1 标本采集、仪器与试剂
流式细胞仪购置美国Beckman Coulter公司,型号为EPICS XL4-MCL型,试剂为CD4-异硫氰酸荧光素(FITC)/CD8-藻红蛋白标记(PE)/CD3-藻红蛋白花青苷(Percp)三色荧光抗体、CD4-FITC、溶血剂等购自美国Becton Dicknson公司,PE标志的B7-H1、PD-1及同型对照管购自美国eBioscience公司;病毒载量检测仪器为美国Roche 公司的Light Cycler 480实时荧光PCR仪,试剂购于深圳匹基生物工程公司;血常规检测仪为Beckman GEN.S五分类血液分析仪。抽取HAART治疗前及治疗24周时患者及健康对照者的标本,用EDTA抗凝负压真空采血管采集外周静脉血,在6 h内进行试验。
1.3.2 CD+4T淋巴细胞绝对计数取10 μl CD4-FITC/CD8-PE/CD3-Percp单克隆抗体加入流式上样试管中,然后加入50 μl全血,振荡混匀,室温避光10 min,溶血,于室温放置10 min后上流式细胞仪检测得CD+4T细胞的百分率,其得到的百分率通过外周淋巴细胞数计算绝对值。
1.3.3 PD-1/PD-L1检测取3支专用流式试管,分别加入抗人CD4-FITC抗体10 μl和Mouse IgG 1-PE同型质控2.5 μl、抗人CD4-FITC抗体10 μl和抗PD-1-PE抗体2.5 μl、抗CD4-FITC抗体10 μl和抗人B7-H1-PE抗体2.5 μl,然后每管各加入全血50 μl,混匀,避光15 min后加入1 ml溶血剂,室温放置10 min,1500 r/min离心,5 min弃上清,再分别加入1 ml生理盐水,混匀,1500 r/min离心5 min后弃上清液,最后加入500 μl生理盐水重悬细胞,上流式细胞仪检测。采用FS-SS参数分析基础上对全血外周单个核细胞(PBMC)设门,设定CD4阳性细胞门,检测CD+4T细胞上B7-H1/PD-1的表达水平,并扣除同型对照的非特异性本底值。
1.3.4 病毒载量检测用美国Roche 公司的Light Cycler 480实时荧光PCR仪定量检测感染者血浆中HIV-1 RNA含量,试剂为深圳匹基生物工程公司,严格按照操作说明进行。
1.4 统计学分析所有资料采用SPSS 17.0软件分析,结果以均值±标准差表示,组间比较采用独立样本t检验。使用Spearman rank进行相关性分析。统计概率采用双侧检验,P<0.05时为差异有统计学意义。
2 结果2.1 AIDS患者抗病毒前后外周血PD-1、PD-L1的表达水平
AIDS患者治疗前CD+4T细胞数显著低于健康对照组(t=8.19,P=0.000),PD-1和PD-L1表达频率显著高于健康组(t分别为6.31和4.27,P=0.000)。AIDS患者抗病毒治疗24周时与治疗前相比,CD+4T细胞数、PD-1表达水平和病毒载量差异均有统计学意义(t=3.54、3.77和4.15,P=0.001,0.000和0.000);PD-L1表达水平治疗低于治疗前,但差异无统计学意义(t=1.78,P=0.056),结果见表1。
表1 AIDS患者治疗前后外周血CD+4T数、PD-1、 PD-L1的表达水平和病毒载量Table 1 CD+4 cells, PD-1, PD-L1 and viral load levels in AIDS patients before HAART and 24 weeks later
| 组别 | CD+4(cell/μl) | PD-1/% | PD-L1/% | HIV RNA/log(copies/ml) |
| 健康对照组 | 857±272 | 0.47±0.14 | 0.19±0.09 | / |
| 治疗前 | 182±76 | 1.16±0.26 | 0.63±0.14 | 5.37±0.43 |
| 治疗24周 | 352±107 | 0.76±0.14 | 0.52±0.06 | 3.18±0.38 |
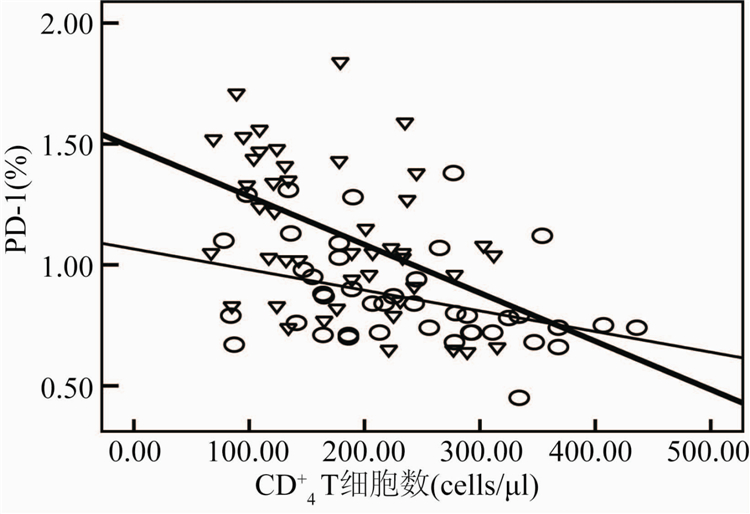
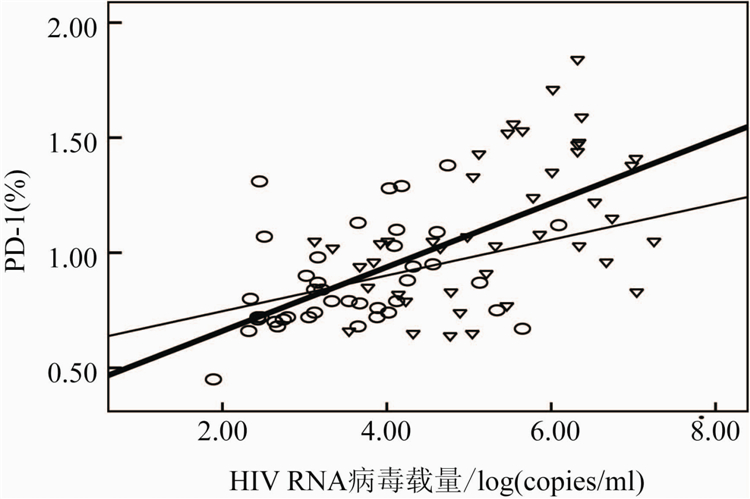
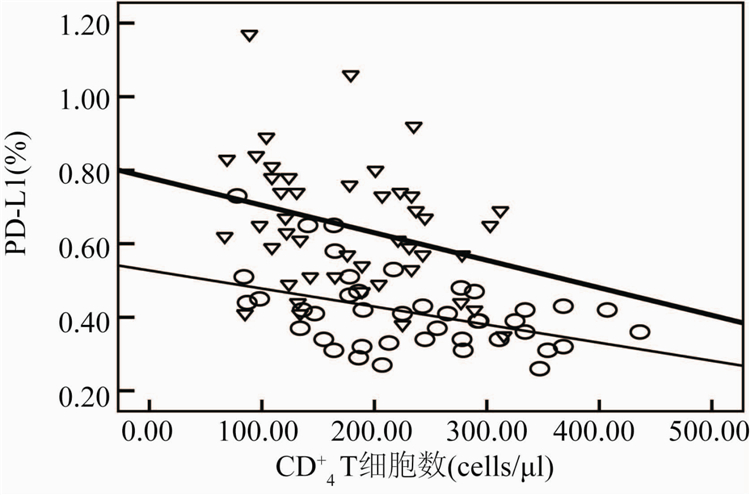
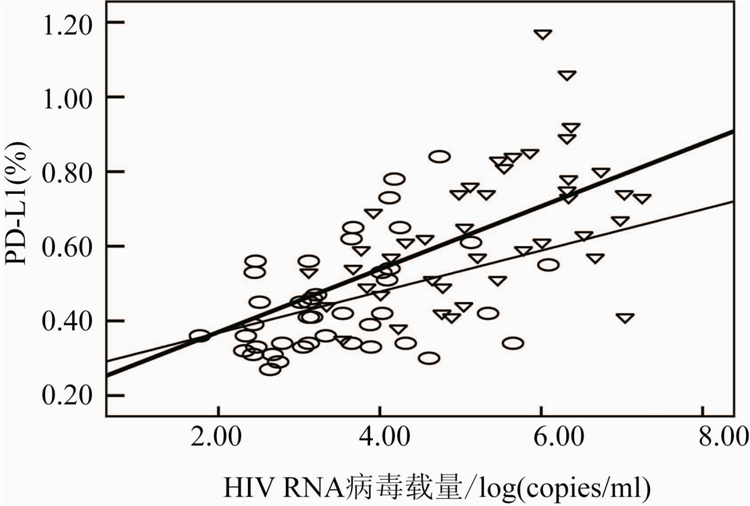
根据AIDS患者治疗前外周血CD+4T细胞数目,将受试者分为三组,第一组患者:1 cells/μl 从表2可见, PD-1/PD-L1表达水平在治疗前后均随着CD+4T细胞数目的增加而下降。治疗前后200 cells/μl 治疗前与治疗后CD+4T细胞数与PD-1表达百分率呈显著负相关(r=-0.434,-0.317,P=0.009和0.031),与病毒载量呈显著正相关(r分别为0.499和0.319,P分别为0.0049和0.032)。PD-L1表达频率在治疗前与治疗后与CD+4T细胞数呈显著负相关
(r=-0.454和-0.314,P=0.002和0.012),与病毒载量在治疗前后呈显著正相关(r=0.513和0.428,P=0.000和0.004)。结果见图1~4。
程序性死亡因子-1和程序性死亡因子配体l是近来发现的CD28分子家族的新成员,常在活化的淋巴细胞呈现高水平表达,研究发现T淋巴细胞PD-1高表达与其细胞免疫缺陷关系密切,是导致病毒持续感染及肿瘤免疫逃逸的重要机制之一[4-6]。T淋巴细胞上的PD-1与PD-L1可以通过细胞之间的接触互相结合,抑制T细胞的增生和I型细胞因子的产生[7],从而降低了机体特异性T细胞的免疫功能,诱导产生免疫耐受,导致病毒的持续感染。本研究通过流式细胞仪的检测发现AIDS患者在治疗前CD+4T细胞上的PD-1/PD-L1表达频率显著高于健康对照组,HIV病毒核酸富含尿嘧啶的RNA序列可作为toll样受体的识别配体,被单核及树突细胞TLR7/8识别,启动了依赖于髓样分化蛋白88(MyD88)的TLR信号,诱导B7-H1表达[8],HIV-1 Nef蛋白p38蛋白激酶(MAPK)途径诱导B7-H1配体PD-1表达[9],这可能是AIDS患者外周血PD-1/PD-L1高表达的重要因素,与此同时,我们发现抗病毒治疗后PD-1的表达频率比治疗前显著下调,治疗24周时AIDS患者外周血PD-L1的表达比治疗前也有降低,但差异无统计学意义,与Rosignoli等[10]研究结果有所不同,这种差异有可能与入组的人数、种族、抗病毒治疗的时机、剂量、疗程等有关。
曹清华等[11]等较早的研究发现HIV-1感染者外周血中调节性T细胞表面PD-1表达与疾病进展相关。而洪坤学等[12]进一步证实HIV感染者CD+8T细胞表面PD-1在CD+4T细胞计数<200细胞/μl的HIV感染者中的表达水平显著高于细胞数>500细胞/μl的感染者,本研究结果也发现CD+4T细胞基数高的患者在治疗前其PD-1/PD-L1的表达水平均比基数低的患者要低,同时CD+4T细胞基数较高的患者,在经24周治疗后其外周血CD+4T细胞上PD-1和PD-L1的下调百分率要高于CD+4T细胞基数低的患者,此结果说明在抗病毒治疗过程中CD+4T细胞基数高的患者机体较基数低的患者具有较高的特异性T淋巴细胞免疫效应,使体内特异性细胞免疫功能的恢复较快。PD-L1表达水平在抗病毒24周时与治疗前相比其下调不显著,此结果考虑可能与观察例数少或周期较短有关,尽管如此,我们发现无论是PD-1还是PD-L1的表达水平在治疗前后与CD+4T细胞计数均呈显著正相关,与病毒载量呈明显负相关,提示PD-1/PD-L1负性抑制途径在疾病进展中起着一定的作用。
综上所述,HIV外周血PD-1/PD-L1表达水平与疾病进展密切相关,尽管现在仍有许多不明地方有待解决,但相信随着PD-1/PD-L1调节机制及其抗病毒免疫关系的进一步阐明,该通路信号可作为很有治疗前景的靶位。
Table 2 PD-1/PD-L1 expression in AIDS
patients with different CD+4 counts
2.3 治疗前后PD-1、PD-L1细胞的表达水平与CD+4T细胞数目、HIV RNA的相关性分析
CD+4(cell/μl)
例数
PD-1
PD-L1
治疗前
24周治疗
治疗前
24周治疗
1~100 12 1.22±0.26 0.93±0.21 0.65±0.19 0.58±0.16
101~200 14 1.13±0.22 0.84±0.16 0.63±0.17 0.53±0.15
201~350 19 0.96±0.19 0.59±0.13 0.58±0.13 0.47±0.15
Figure 1 Correlation between PD-1 expression level and
CD+4T lymphocyte count before and after HAART
图2 治疗前后病毒载量与PD-1表达水平的相关性
Figure 2 Correlation between PD-1 expression level and
HIV RNA viral load before and after HAART
注:(1)“▽”为治疗前;(2)“○”为治疗后;(3)“ ”治疗前;(4)“-”治疗后。
图3 治疗前后CD+4细胞数与PD-L1表达水平的相关性
Figure 3 Correlation between PD-L1 expression level and
CD+4T lymphocyte counts before and after HAART
图4 治疗前后病毒载量与PD-L1表达水平的相关性
Figure 4 Correlation between PD-L1expression level and
HIV RNA viral load before and after HAART
3 讨论
[2] Blackburn SD, Shin H, Haining WN, et al.Coregulation of CD8+ T cell exhausting by multiple inhibitory receptors during chronic viral infection[J].Nat Immunol, 2009, 10(1):29-37.
[3] Aubert RD, Kamphorst AO, Sarkar S, et al.Antigen-specific CD4 T-cell help rescues exhausted CD8 Tcells during chronic viral infection[J].Proc Natl Acad Sci USA, 2011, 108(52):21182-21187.
[4] Xicheng Wang, Zheng Zhang, Shuye Zhang, et al.B7-H1 up-regulation impairs myeloid DC and correlates with disease progression in chronic HIV-1 infection[J].Eur J Immunol, 2008, 38(11):3226-3236.
[5] Liang XS, Zhou Y, Li CZ, et al.Natural course of chronic hepatitis B is characterized by changing patterns of programmed death type-1 of CD8-positive T cells[J].World J Gastroenterol, 2010, 16(5):618-624.
[6] Nakamoto N, Kaplan DE, Coleclough J, et a1.Functional restoration of HCV-specific CD8 T cells by PD-1 blockade is defined by PD-1 expression and compartmentalization[J].Gastroenterology, 2008, 134(7):1927-1937.
[7] Seo SK, Seo HM, Jeong HY, et al.Co-inhibitory role if T-cell-associated B7-H1 and B7-DC in the T-cell immune response[J].Immunol Lett, 2006, 102(2):222-228.
[8] Meier A, Bagchi A, Sidhu HK, et al.Upregulation of PD-L1 on monocytes and dendritic cells by HIV-1 derived TLR ligands[J].AIDS, 2008, 22(5):655-658.
[9] Muthumani K, Choo AY, Shedlock DJ, et al.Human immunodeficiency virus type 1 Nef induces programmed death 1 expression through a p38 mitogen-activated protein kinase-dependent mechanism[J].J Virol, 2008, 82(23):11536-11544.
[10] Rosignoli G, Cranage A, Burton C, et al.Expression of PD-L1, a marker of disease status, is not reduced by HAART in aviraemic patients[J].AIDS, 2007, 21(10):1379-1381.
[11] Cao QH, Xue YL, Wang Y. Correlation between regulated T cell PD-1 expression and disease progress[J].Chinese Journal of Cellular and Molecular Immunology, 2009, 25(11):1020-1022.(in Chinese) 曹清华, 薛以乐, 王盈.HIV-1感染者CD4+CD25nt/hiCD127lo调节性T细胞PD-1表达水平与疾病进展的关系[J].细胞与分子免疫学杂志, 2009, 25(11):1020-1022.
[12] Hong KX Liu Z, Jia MM, et al. Research on CD8+ T lymphocyte PD-1 expression level in HIV infected people[J]. China Tropical Medicine, 2012, 12(8):909-912.(in Chinese) 洪坤学, 刘真, 贾明明, 等.HIV-1感染者CD8+ T细胞表面PD-1表达水平的研究[J].中国热带医学, 2012, 12(8):909-912.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 杨越明 | |
| 许文芳 | |
| 吴勇 | |
| PubMed | |
| Article by YANG Yue-ming | |
| Article by XU Wen-fang | |
| Article by WU Yong | |