2. Intitute for Communicable Disease Prevention and Control, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3. Cancer Hospital affiliated to Shanxi Medical University, Taiyuan 030013, Shanxi, China
2. 中国疾病预防控制中心传染病预防控制所, 北京 102206;
3. 山西医科大学附属肿瘤医院 山西省肿瘤研究所病因室, 山西 太原 030013
-
1 材料与方法
- 1.1 材料
- 1.2 方法
- 1.2.1 菌株培养与灭活
- 1.2.2 脾淋巴细胞悬液的制备与分组
- 1.2.3 细胞毒性检测(LDH释放法)
- 1.2.4 ELISA检测细胞因子
- 1.2.5 流式细胞仪检测细胞内TNF-α产量
- 1.3 统计学分析
- 2.1 猪链球菌和姜黄素对脾细胞的毒性检测
- 2.2 猪链球菌对脾细胞因子的影响
- 2.3 姜黄素对猪链球菌诱导脾细胞分泌的细胞因子的影响
- 2.4 姜黄素对猪链球菌诱导的促炎和抗炎细胞因子比例的影响
- 2.5 流式细胞仪检测TNF-α阳性的细胞数量
猪链球菌是一种人畜共患病原菌,可引起猪的脑膜炎、关节炎、支气管炎和败血症,也可引起人的脑膜炎、败血症、中毒性休克综合征,甚至死亡[1]。2005年我国四川省发生由2型序列7型(ST 7)猪链球菌引起的暴发流行,造成200多人感染,其中28%为中毒性休克综合征[2]。猪链球菌ST 7由高致病性的ST 1单位点突变而来,其丝裂原效应和促炎性细胞因子产生能力更强[3]。
姜黄素是从草本植物姜黄的根茎中提炼出来的一种植物多酚,为天然色素,毒性低,具有抗炎、抗氧化的功能,因而在风湿性关节炎等自身免疫性疾病,术后等急性炎症,炎症性肠病等慢性疾病,肿瘤等方面具有药理作用[4]。同时姜黄素还在幽门螺杆菌、淋球菌和金黄色葡萄球菌等急性感染中发挥作用。姜黄素抗微生物感染的作用与其抑制炎症因子的产生有关。 四川省猪链球菌感染的中毒性休克综合征患者疾病早期促炎性细胞因子剧烈升高,病死率高达62%。因此本研究拟通过用2005年四川省疫情中的中毒性休克样综合征患者的ST 7菌株SC84刺激培养小鼠脾细胞建立研究炎症反应的体外感染模型,并给予姜黄素干预,观察炎症因子的变化,获得体外研究数据探讨姜黄素是否能改善猪链球菌感染引起的中毒性休克。
1 材料与方法1.1 材料
清洁级C57BL/6近交系小鼠,雌性, 6~8周,购自北京大学医学部-北京华阜康生物科技股份有限公司。血清型2型猪链球菌SC84四川省疫情中的中毒性休克样综合征患者的分离株。哥伦比亚血琼脂基础培养基购自广州市迪景微生物科技有限公司;Todd-Hewitt 肉汤培养基购自英国;姜黄素购自Sigma公司;RPMI 1640培养基和胎牛血清购自GIBCO公司;细胞毒性检测试剂盒购自Promega公司;小鼠细胞因子的ELISA检测试剂盒与流式细胞检测试剂盒均购自BD公司。
1.2 方法1.2.1 菌株培养与灭活
菌株在哥伦比亚血琼脂基础培养基上37 ℃过夜生长。接种单个菌落于10 ml Todd-Hewitt 肉汤培养基(THB),37 ℃ 100 r/min摇动培养8 h。取300 μl 培养液与30 ml THB 在37 ℃ 5%CO2 的培养箱静置培养15 h。细菌用PBS洗2次后重悬于PBS中。稀释后接种于血琼脂培养板计算菌落形成单位(cfu)/ml。菌株于56 ℃水浴1 h灭活,然后在血琼脂培养板上过夜培养检查是否灭活彻底。灭活的细菌存储于4 ℃备用。
1.2.2 脾淋巴细胞悬液的制备与分组颈椎脱臼法处死小鼠,无菌分离脾脏,合并两只脾脏为一组,用40 μm细胞滤网研磨,收集研磨液离心后弃上清,用RPMI 1640重悬,加入红细胞裂解液(Gey's solution)后,用RPMI 1640洗涤2次,用含浓度为5%胎牛血清、2 mmol/L L-谷氨酰胺、25 mmol/L HEPES的RPMI 1640重悬细胞,台盼蓝染色计数活细胞浓度。将4×106个的细胞接种于24孔培养板。分为猪链球菌组(感染量MOI为100)、猪链球菌+姜黄素组(15 μmol/L姜黄素)和阴性对照组。在37 ℃、5%CO2细胞培养箱培养相应时间后离心(1400 r/min,8 min, 4 ℃)收集上清,冻存于-80 ℃冰箱,用于酶联免疫吸附试验(ELISA)检测。
1.2.3 细胞毒性检测(LDH释放法)细胞分别培养24 h和48 h, 终止前1 h于最大量释放孔加入细胞裂解液,分自然释放量组,试验组和最大释放量组。分别取50 μl上清于96孔板,设复孔,再加入50 μl底物混合物,充分混匀,封板避光作用30 min后终止,酶标仪读取490 nm处吸光度(A)值;计算公式如下:

收集不同组24 h的上清用于肿瘤坏死因子TNF-α和血清白细胞介素-6(IL-6)的检测;收集48 h的上清检测IL-2、IL-4、IL-10、IL-12、IL-1β和IFN-γ,实验步骤按试剂盒说明书进行。根据标准品A值,求出标准曲线回归方程,将样品A值带入标准曲线并乘以相应的稀释倍数,计算出相应细胞因子浓度。
1.2.5 流式细胞仪检测细胞内TNF-α产量细胞培养24 h,终止前4 h在每孔细胞中加入豆蔻酰佛波醇乙酯(PMA)(终浓度5 ng/ml)与Ionomycin(终浓度为500 ng/ml)培养1 h后,每孔加蛋白转运抑制剂(Gorgi stop),继续孵育3 h。然后收集培养24 h的细胞,用PBS洗1次后每管加Fc Block 4 ℃反应15 min后,进行胞外染色,所有样品加入CD3e-FITC抗体进行细胞表面染色,4 ℃避光放置30 min后每管加染色缓冲液清洗细胞,离心后加入固定和破膜液重悬细胞,再清洗缓冲液洗2次细胞, 用TNF-α-PE抗体胞内染色,4 ℃避光放置30 min后清洗1次,将细胞重悬于染色缓冲液中后混匀,流式细胞仪收集10 000个细胞,计算CD+3 T细胞亚群中TNF-α 阳性细胞的百分比。
1.3 统计学分析应用SPSS 17.0软件进行统计分析,数据以均数±标准差(x ±s)表示,进行配对样本t检验,P≤0.05表示差异有统计学意义。
2 结果2.1 猪链球菌和姜黄素对脾细胞的毒性检测
乳酸脱氢酶(LDH)是评价细胞受损的间接指标,正常状态时存在于细胞内,当细胞受到损伤时释放至胞外。由表1可见,本实验所用的灭活猪链球菌和姜黄素剂量24 h和48 h均无细胞毒作用,表明本研究观察到的灭活猪链球菌和姜黄素对脾细胞功能的影响均与细胞毒性无关。
表1 猪链球菌和姜黄素对脾细胞的毒性作用Table 1 Cytotoxicity of Streptococcus suis and curcumin to splenocytes
| 组别 | 24 h A值 (x±s) | 24 h LDH (%) | 48 h A值 (x±s) | 48 h LDH (%) |
| 猪链球菌 | 1.05±0.24 | 0.00 | 1.30±0.12 | 0.00 |
| 猪链球菌+姜黄素 | 1.08±0.21 | 0.00 | 1.33±0.12 | 0.55 |
| 姜黄素 | 1.08±0.20 | 0.00 | 1.32±0.07 | 0.00 |
| 阴性对照 | 1.09±0.24 | 0.00 | 1.32±0.08 | 0.00 |
| 最大释放量 | 3.04±0.08 | 100.00 | 3.16±0.07 | 100.00 |
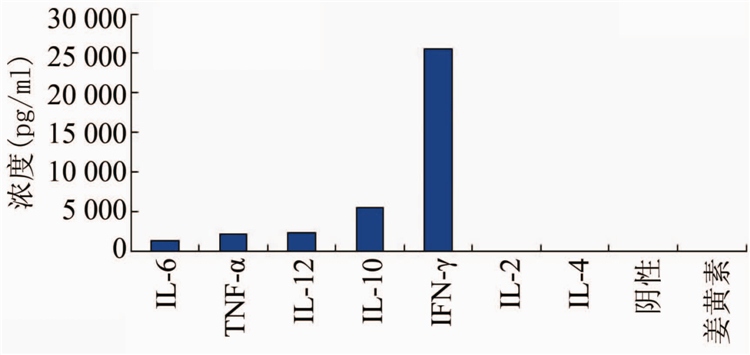
猪链球菌能够诱导脾细胞产生IL-6、TNF-α、IL-12和IL-10以及较高水平的IFN-γ,较低水平的IL-1β ,未能检测到的IL-2和 IL-4,阴性组和姜黄素组各细胞因子皆未检测到。
图1 猪链球菌诱导的细胞因子水平Figure 1 Production of cytokines induced by Streptococcus suis
2.3 姜黄素对猪链球菌诱导脾细胞分泌的细胞因子的影响
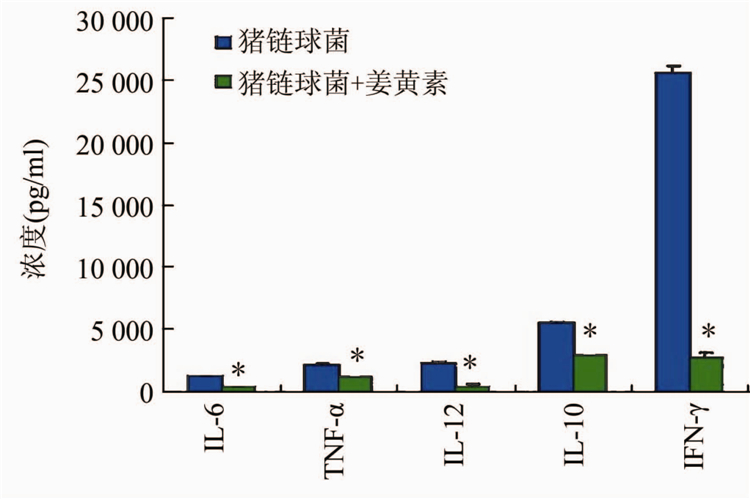
姜黄素能够显著抑制猪链球菌诱导的多种细胞因子包括IL-6、TNF-α、IL-12、 IFN-γ、IL-10和 IL-1β ,虽然抑制作用不是细胞因子特异的,但对IFN-γ的抑制效果最显著。
注:*表示姜黄素干预组差和猪链球菌组比较差异均有统计学意义,P<0.05。图2 姜黄素对猪链球菌诱导的细胞因子的抑制作用
Figure 2 Inhibition effect of curcumin on production of TNF-α induced by Streptococcus suis
2.4 姜黄素对猪链球菌诱导的促炎和抗炎细胞因子比例的影响
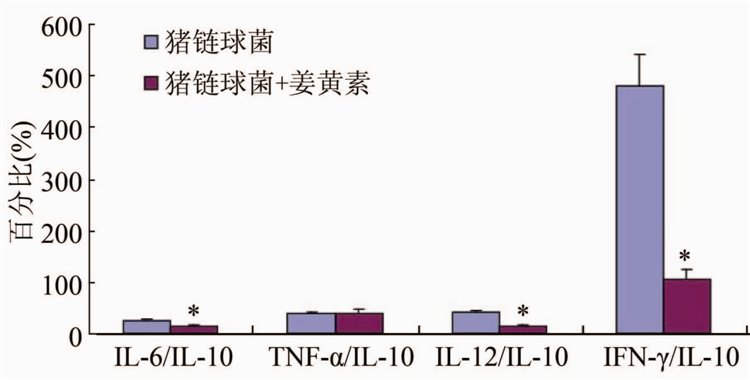
虽然姜黄素抑制多种促炎因子的同时也抑制了抗炎因子IL-10,观察促炎与抗炎因子比例发现姜黄素可引起IL-6/IL-10和IL-12/IL-10显著降低,IFN-γ/ IL-10 降低最显著, TNF-α/IL-10变化不显著(图3)。该结果表明姜黄素具有拮抗猪链球菌诱导的炎症反应特征。
注:*表示姜黄素干预组差和猪链球菌组比较促炎因子 和IL-10比例差异有统计学意义,P<0.05。图3 姜黄素对猪链球菌诱导的促炎因子和IL-10比例的影响
Figure 3 Effect of curcumin on proportion of pro-inflammatory cytokines and IL-10 induced by Streptococcus suis
2.5 流式细胞仪检测TNF-α阳性的细胞数量
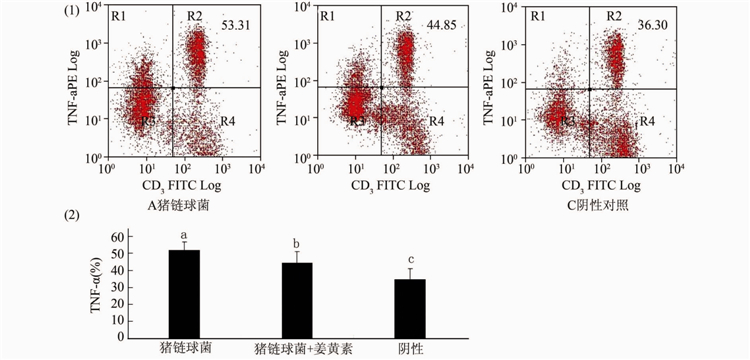
与阴性对照组相比,猪链球菌刺激脾细胞后,产生TNF-α的T细胞比例明显增多,姜黄素能够明显抑制TNF-α阳性的T细胞构成比(图4)。
注:(1)数值表示CD+3 T细胞内TNF-α阳性细胞所占的百分比。流式图是3次独立实验的代表图,条形图为统计图。(2)不同字母表示差异有统计学意义,P<0.05。图4 姜黄素降低猪链球菌诱导的TNF-α阳性T细胞的比例
Figure 4 Proportion of Streptococcus suis induced TNF-α positive T cell reduced by curcumin
猪链球菌基于荚膜抗原分为33个血清型,其中血清2型被认为是毒力最强的菌株,能引起人的脑膜炎。2005年四川省暴发的猪链球菌感染首次导致大规模的中毒性休克综合征,起病急,症状较重,可导致多系统功能受损。血清2型序列7型SC84菌株为该疫情的分离株,该疫情由相同型别菌株引起,早期能导致患者炎症因子大量升高,与疾病迅速进展密切相关。以往研究表明活的猪链球菌与PBMC作用2 h即有较高细胞毒性,本次实验需要培养较长时间,加之56 ℃ 60 min作用不影响2型猪链球菌的细胞因子的诱导能力[5],因而用灭活的猪链球菌建立感染模型,结果表明在我们采用的浓度下无细胞毒性。本实验中能够诱导出TNF-α、IFN-γ、IL-6、IL-12和IL-1β,与 Ye 等[2]报道的患者血清中炎症因子相一致。这些因子在中毒性休克中发挥重要作用。超抗原也能诱导出这些Th1因子,在引起中毒性休克综合征中有重要作用。此外还诱导出抗炎因子IL-10,与Zheng等[3]报道的小鼠感染模型一致,没有检测到IL-2和IL-4。早期大量促炎因子与单一抗炎因子的失平衡导致疾病进展迅速,组织损伤较重。小鼠感染模型可用来评估血清2型猪链球菌诱导的细胞因子产生[6]。脾是对血源抗原产生免疫应答的主要场所,含有混合的免疫细胞:T细胞、B细胞、巨噬细胞和树突状细胞。受抗原刺激后,T细胞和巨噬细胞活化,释放炎症介质引起炎症反应。本次用脾细胞诱导出与患者和小鼠一致的细胞因子,提示可以用体外感染脾细胞模型来研究猪链球菌引起的中毒性休克综合征中的炎症因子。
对猪链球菌引起的早期炎症因子升高的干预可预防疾病进一步进展。姜黄素作为一种天然抗炎药物在多种微生物感染中发挥抗炎功效。以往的研究表明姜黄素在15 μmol/L时可显著降低促炎因子的产生。本实验中该浓度姜黄素降低了TNF-α、IFN-γ、IL-6、IL-12和IL-1β的产生。TNF-α是导致毒性休克的重要因素,Schaefers 等[7]报道姜黄素能降低兔金黄色葡萄球菌毒性休克综合征毒素引起的病死率,且存活兔的血清中未能检测到TNF-α。IL-1β和IL-6促进急性期反应。最新的研究表明IFN-γ是血清2型SC84菌株高致病性的重要介导因子[8]。IL-12诱导Th1细胞的分化和分泌IFN-γ,降低IL-12可进一步降低IFN-γ。姜黄素降低这些细胞因子与其能够通过抑制I-κB激酶的活性阻断NF-κB的活化有关。虽然发现姜黄素也降低了IL-10的产生,但姜黄素引起很多促炎因子/IL-10降低,提示抑制的整体效应。TNF/IL-10无变化可能与检测时间有关,TNF-α是感染早期释放的因子,产量随感染时间延长而减低。姜黄素对不同刺激因素导致的IL-10作用报道不一,有报道姜黄素能够降低兔心脏缺血再灌注后血浆中的IL-10[9];也有报道姜黄素对血吸虫引起的小鼠感染血清中的IL-10未有明显改变[10];还也报道姜黄素增加油酸诱导的大鼠急性肺损伤肺泡灌洗液的IL-10[11];其确切作用和机制有待深入研究。本研究还证实了姜黄素降低促炎因子的产量可能与降低了产生TNF-α的T细胞数目有关,对进一步研究姜黄素拮抗猪链球菌诱导的炎症反应和抑制机制提供线索和思路。
综上所述,姜黄素能减少猪链球菌诱导的TNF-α、IFN-γ、IL-6、IL-12和IL-1β的产生,使促炎因子与IL-10的比例降低,提示对中毒性休克的炎症反应有一定的干预作用。姜黄素对猪链球菌中毒性休克的干预作用需要动物实验进一步证实。
[2] Ye CY, Zhu XP, Jing HQ, et al. Streptococcus suis sequence type 7 outbreak, Sichuan, China[J]. Emerg Infect Disea, 2006, 12(8):1203-1208.
[3] Zheng H, Ye C, Segura M, et al. Mitogenic effect contributes to increased virulence of Streptococcus suis sequence type 7 to cause streptococcal toxic shock-like syndrome[J]. Clin Experiment Immunol, 2008, 153(3):385-391.
[4] Jurenka JS. Anti-inflammatory properties of curcumin, a major constituent of Curcuma longa: a review of preclinical and clinical research[J]. J Clin Therap, 2009, 14(2):141-153.
[5] Segura M, Vadeboncoeur N, Gottschalk M. CD14-dependent and-independent cytokine and chemokine production by human THP-1 monocytes stimulated by Streptococcus suis capsular type 2[J]. Clin Experiment Immunol, 2002, 127(2):243-254.
[6] Dominguez-Punaro MC, Segura M, Plante MM, et al. Streptococcus suis serotype 2, an important swine and human pathogen, induces strong systemic and cerebral inflammatory responses in a mouse model of infection[J]. J Immunology, 2007, 179(3):1842-1854.
[7] Schaefers MM, Breshears LM, Anderson MJ, et al. Epithelial proinflammatory response and curcumin-mediated protection from staphylococcal toxic shock syndrome toxin-1[J]. PLoS One, 2012, 7(3):e32813.
[8] Lachance C, Gottschalk M, Gerber PP, et al. Exacerbated type Ⅱ interferon response drives hypervirulence and toxic shock by an emergent epidemic strain of Streptococcus suis[J]. Infect Immun, 2013, 81(6):1928-1939.
[9] Yeh CH, Chen TP, Wu YC, et al. Inhibition of NFkappaB activation with curcumin attenuates plasma inflammatory cytokines surge and cardiomyocytic apoptosis following cardiac ischemia/reperfusion[J]. J Surg Res, 2005, 125(1):109-116.
[10] Allam G. Immunomodulatory effects of curcumin treatment on murine schistosomiasis mansoni[J]. Immunobiology, 2009, 214(8):712-727.
[11] Zhu RF, Zhou M, He JL, et al. Protective effect of curcumin on oleic-induced acute lung injury in rats[J]. China Journal of Chinese Materia Medica, 2008, 33(17):2141-2145.(in Chinese) 朱瑞芳, 周敏, 何建林, 等. 姜黄素对大鼠油酸型急性肺损伤的保护作用[J].中国中药杂志, 2008, 33(17):2141-2145.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 温晓婷 | |
| 黄元铭 | |
| 王智昊 | |
| 韩存芝 | |
| PubMed | |
| Article by WEN Xiao-ting | |
| Article by HUANG Yuan-ming | |
| Article by WANG Zhi-hao | |
| Article by HAN Cun-zhi | |