Molecular genetic analysis of an arginine dihydrolase-negative Vibrio fluvialis strain
WU Rui, LIANG Pu, LU Xin, KAN Biao, LIANG Wei-li
State Key Laboratory for Communicable Disease Prevention and Control, Institute for Communicable Disease Prevention and Control, Chinese Center for Disease Control and Prevention, Beijing 102206, China
Abstract
Objective Utilizations of arabinose, arginine, lysine and ornithine are the major biochemical tests used to differentiate Vibrio fluvialis from its close species. In this study, we preformed a molecular genetic analysis on an arginine dihydrolase-negative V. fluvialis strain Ma-2531. Methods Polymerase chain reaction (PCR) was performed by using multiple primers specific to the arc operon gene cluster, along with the sequence analysis of the amplicon. Meanwhile, we measured the growth curve and pH variation of the cultures of Ma-2531 and EF85003 which was arginine dihydrolase positive. Results Primer pairs arc-F/arc-R, arc-F/arc-rev and arc-ck-up/arc-R gave negative amplifications which are specific to arcBCA sequence. The primer pairs, arc1-up/arc1-dn and arc72695-up/arc75219-dn, annealing to the flanking sequence of arcBCA gave the expected amplicons, respectively. Sequence analysis of the product of arc1-dnRev/arc72695-upRev revealed the existence of the transposase IS4, resulting in the deletion of an 8.6 kb fragment containing the arcBCAD gene cluster and the up-flanking sequence (the carbamoyl aspartate aminotransferase regulatory subunit gene and the catalytic subunit gene). No differences in the growth curve and pH change were observed between Ma-2531 and EF85003. Conclusion The transposition of transposase IS4 caused the negative phenotype of arginine dihydrolase in V. fluvialis Ma-2531, but it might be a random and rare event, resulting diversity of biochemical metabolism in V. fluvialis.
一株精氨酸双水解酶阴性河弧菌的分子遗传学分析
吴睿, 梁璞, 卢昕, 阚飙, 梁未丽
中国疾病预防控制中心传染病预防控制所, 北京 102206
收稿日期:2014-1-22
基金项目:国家自然科学基金(No. 81071410);“十二五”国家科技重大专项课题(No. 2013ZX10004-101002)
通讯作者:梁未丽,Tel:010-58900744,Email:liangweili@icdc.cn
摘要
目的 赖氨酸、鸟氨酸脱羧酶阴性、精氨酸双水解酶阳性和阿拉伯糖发酵实验是区分河弧菌和其他非凝集弧菌的特征性化学指标。本研究对发现的1株精氨酸双水解酶阴性的河弧菌Ma-2531进行了分子遗传学分析。方法 利用多对特异性引物对精氨酸双水解酶代谢通路的arc操纵子区基因簇进行普通聚合酶链反应(PCR)扩增,并对产物进行测序分析,同时比较Ma-2531和精氨酸双水解酶阳性菌株EF85003的生长曲线和培养液pH值的变化。结果 针对arcBCA基因簇序列的3对引物arc-F/arc-R、arc-F/arc-rev和arc-ck-up/arc-R均为阴性扩增,而其上下游序列特异性的引物对arc1-up/arc1-dn和arc72695-up/arc75219-dn分别扩增出预期大小的目的条带。arc1-dnRev/arc72695-upRev 引物对的扩增产物序列分析显示该扩增片段包含transposase IS4序列,进一步的对比分析表明包括精氨酸双水解酶系统arcBCAD基因簇及上游的天冬氨酸氨甲酰转移酶调节亚基和催化亚基编码基因在内的约8.6 kb的大片段发生了缺失。生长曲线和pH值测定显示菌株Ma-2531和EF85003没有明显差异。结论 菌株Ma-2531中插入序列的转座导致了该菌株精氨酸双水解酶这一鉴定生化指标阴性的结果,但这种变化应只是随机和罕见的,使河弧菌生化代谢表现出多样性。
内容大纲
-
1 材料与方法
- 1.1 菌株来源及鉴定
- 1.2 试剂和仪器
- 1.3 PCR检测
- 1.4 精氨酸双水解酶生化表型检测
- 1.5 生长曲线和pH值的测定
- 2.1 精氨酸双水解酶表型
- 2.2 精氨酸双水解酶通路相关基因的检测
- 2.3 生长曲线和pH值的测定
作为一种嗜盐的革兰阴性兼性厌氧细菌,河弧菌在无盐培养基上一般不能生长或生长不良,在1%~6%甚至8%NaCl培养基上能良好生长。河弧菌的生化表型特征与气单胞菌属相似,API 20E生化鉴定条的结果常不确定,盐耐受试验有助于区分两者,因为气单胞菌不能在6%NaCl培养基上生长[9]。河弧菌与弗尼斯弧菌(V. furnissii)的差别仅在于其发酵葡萄糖而不产气[10]。精氨酸双水解酶、赖氨酸和鸟氨酸脱羧酶及阿拉伯糖发酵实验常被用作区分河弧菌和霍乱弧菌及其他不凝集弧菌的种特异性鉴定所需的4个基础生化指标[6]。河弧菌表现为精氨酸双水解酶阳性、阿拉伯糖发酵阳性、赖氨酸和鸟氨酸脱羧酶阴性。
精氨酸双水解酶系统通过3个酶促反应将精氨酸经瓜氨酸转变为鸟氨酸、CO2和NH3。首先在精氨酸脱亚氨酶(arginine deiminase, arcA编码)的作用下,精氨酸+H2O生成瓜氨酸和NH3;在鸟氨酸氨基甲酰转移酶(ornithine carbamoyltransferase)的催化下瓜氨酸+Pi生成鸟氨酸和磷酸氨甲酰,最后在氨基甲酸激酶(carbamate kinase)的作用下磷酸氨甲酰+ADP 生成ATP、CO2和NH3。该系统的编码基因为arc操纵子,包括arcA、arcB、arcC三个基因分别编码精氨酸脱亚氨酶、鸟氨酸氨基甲酰转移酶和氨基甲酸激酶,在不同种的细菌中其组织结构和排列方式有所不同,如在猪链球菌(Streptococcus suis)中为arcABC结构[11],而在弗尼斯弧菌中为arcBCA 结构[12]。我们在前期工作中发现1株精氨酸双水解酶阴性的河弧菌Ma-2531[13],本研究进一步探索了决定该阴性表型的分子遗传学基础。
1 材料方法
1.1 菌株来源及鉴定 菌株Ma-2531分离自马鞍山1例腹泻患者粪便标本,EF85003分离自新疆1例腹泻患者粪便标本。API 20E生化鉴定条和针对河弧菌toxR基因保守序列及16S~23S rDNA间隔序列的2对特异性引物toxR-F/toxR-R[14]和 VFLU-F/VFLU-R[15]鉴定为河弧菌,标准菌株CICC21612购自中国食品药品检定研究院(NIFDC),作为阳性对照。
1.2 试剂和仪器
聚合酶链反应(PCR)扩增特异性引物由上海生工生物技术有限公司合成,PCR扩增的酶及相应试剂,DL5000 Marker 购自大连宝生物工程有限公司;API 20E生化鉴定条为法国bioMérieux sa公司产品,精氨酸双水解酶生化鉴定管(073130和0713140)购自广东环凯。PCR扩增仪为MJ公司的PTC200,凝胶成像仪为Bio-Rad Gel Doc XR系统。酶联检测仪为奥地利Tecan的Infinite M200 Pro。pH计为德国Mettler Toledo 的FiveEasy。
1.3 PCR检测
1.3.1 引物
种特异性鉴定引物参照文献 进行,精氨酸双水解酶代谢基因簇检测引物根据弗尼斯弧菌NCTC 11218的基因组序列[12]和河弧菌相关序列KC569550[13]通过软件Oligo 6.0设计,序列见表1。
1.3.2 模板制备
菌株划线接种于LB琼脂平板,37 ℃培养过夜,次日用灭菌牙签挑取单菌落于60 μl灭菌去离子水中,煮沸10 min后冰浴10 min,12 000 r/min离心5 min,取上清作为PCR扩增的模板。
1.3.3 扩增参数
94 ℃预变性5 min,94 ℃ 30 s,55~60 ℃ 45 s,72 ℃ 1 min,共33个循环;最后72 ℃延伸10 min。
1.3.4 琼脂糖凝胶电泳
1 g琼脂糖加100 ml 0.5×TBE,煮沸溶解,冷却至58 ℃左右,加5 μl 核酸染料GoldView,混匀后制胶。PCR产物取5 μl上样电泳,Bio-Rad Gel Doc XR系统读取图像。
1.4 精氨酸双水解酶生化表型检测
挑取Ma-2531和EF85003的新鲜菌落分别接种于LB 37 ℃振荡培养18 h,用吸管吸取2滴上述菌悬液加入西林瓶内(开启西林瓶前,用75%酒精棉球消毒西林瓶表面,无菌条件撕开铝盖后打开西林瓶胶塞),加灭菌液体石蜡8滴覆盖培养基表面,培养18~24 h后观测结果。每株被检菌同时接种试验管和对照管各1支。
结果判定标准:阳性为试验管呈蓝绿色,对照管呈黄色;阴性为试验管与对照管均呈黄色。
1.5 生长曲线和pH值的测定
将Ma-2531和EF85003的新鲜菌落分别接种于LB 中37 ℃振荡培养过夜,次日按 1 ∶ 500的比例加入100 ml LB液体培养基中,按时间间隔测其生长曲线和pH值的变化。酸耐受试验中将LB培养液用浓盐酸调至pH 5.40,同上接种过夜培养物,培养8 h和24 h后测定培养液的pH值变化。
表1 引物序列及扩增产物大小
Table 1 Primer sequences and the size of amplification products
| 引物名称 | 引物序列(5′~3′) | 产物大小(bp) | 退火温度(℃) | 来源 |
| arc-F | AGT TTA TGC GTC TGG CTT G | 3427 | 56 | 本研究 |
| arc-R | ATG AGT AAG TTA TAC GTA GG | |||
| arc-rev | GCT TCG GCC CAC ATA ATA A (paired with arc-F) | 2170 | 56 | 本研究 |
| arc-ck-up | TTA CCA CCT AAT GCG ACG A (paired with arc-R) | 1235 | 56 | 本研究 |
| arc1-up | CCG AAG CAA CGA CTA ACC CGA | 1278 | 58 | 本研究 |
| arc1-dn | AAC GCC TGC GGT AAG AAA GTC | |||
| arc72695-up | TTA GAT GAA CAG ACC GCC AAA | 2524 | 60 | 本研究 |
| arc75219-dn | GCT TGA GCT GAT GGG CAA AGA | |||
| arc1-dnRev | GAC TTT CTT ACC GCA GGC GTT | 1500 | 55 | 本研究 |
| arc72695-upRev | TTT GGC GGT CTG TTC ATC TAA | |||
| toxR-F | GAC CAG GGC TTT GAG GTG GAC GAC | 217 | 65 | [12] |
| toxR-R | AGG ATA CGG CAC TTG AGT AAG ACT C | |||
| VFLU-F | ATA AAG TGA AGA GAT TCG TAC C | 278 | 60 | [13] |
| VFLU-R | GTA TTC CTG AAT GGA ATA CAC |
2 结果
2.1 精氨酸双水解酶表型 API 20E生化鉴定条显示菌株EF85003精氨酸双水解酶阳性,而Ma-2531精氨酸双水解酶阴性,鉴于精氨酸双水解酶阳性为河弧菌的特征性鉴定指标之一,API 20E表型结果易受菌株生长等多因素的影响,加之文献中也未有精氨酸双水解酶阴性的河弧菌株报道,我们用精氨酸双水解酶生化鉴定管进行了进一步的验证,以EF85003为阳性对照,证实Ma-2531的精氨酸双水解酶阴性,见图1。
图1 Ma-2531和EF85003精氨酸双水解酶生化表型
Figure 1 Biochemical phenotype of arginine dihydrolase
of Ma-2531 and EF85003 注:1:Ma-2531(control); 2: Ma-2531(test); 3:EF85003 (control);4: EF85003 (test)。
2.2 精氨酸双水解酶通路相关基因的检测
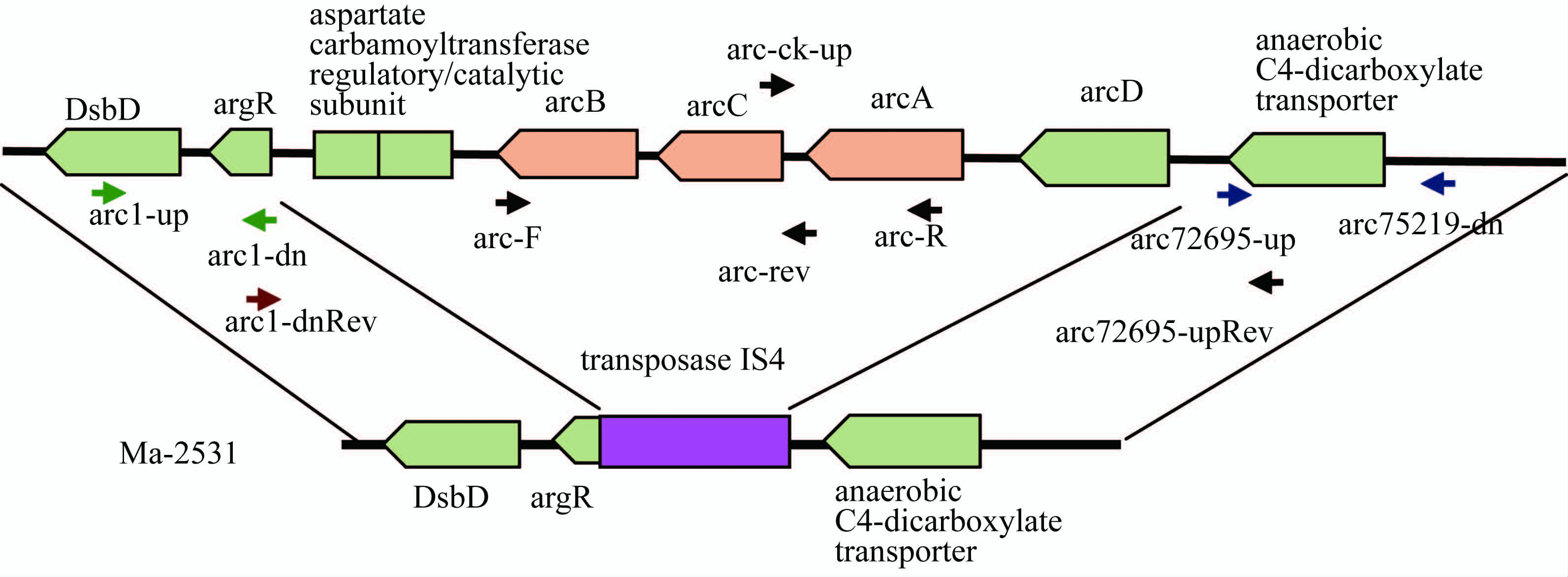
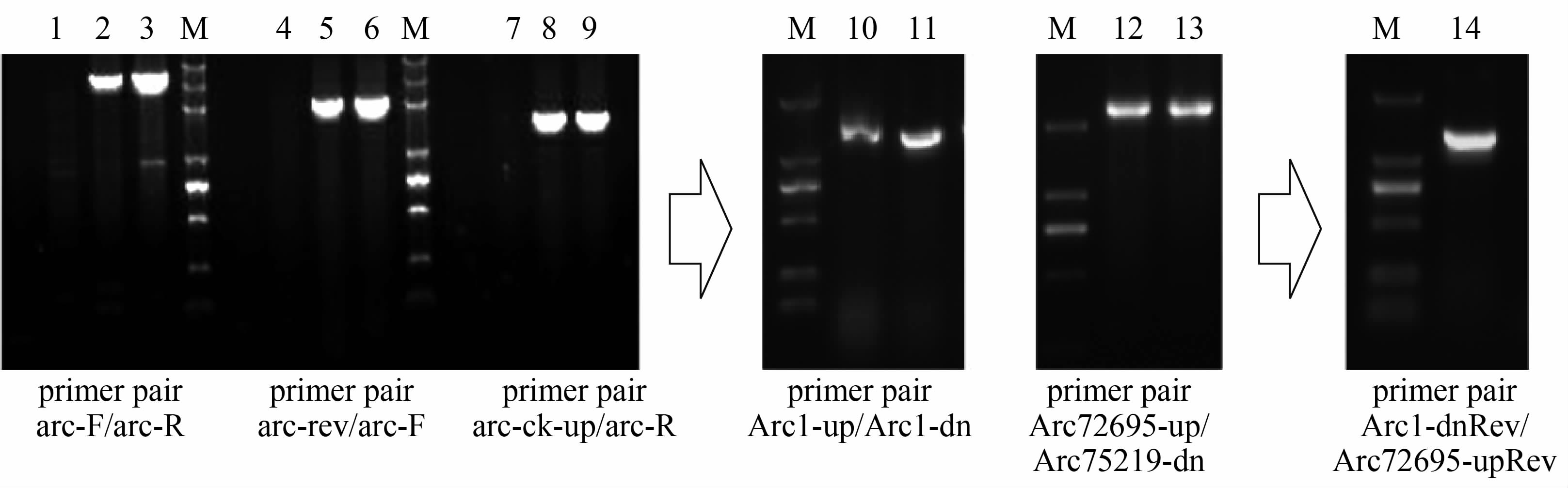
河弧菌与弗尼斯弧菌非常近源,二者精氨酸双水解酶表型一致,根据其全基因组序列和河弧菌序列KC569550, 我们设计不同的引物组合对Ma-2531进行arc相关基因的检测,各引物相对位置见图2,PCR扩增结果见图3。
图2 Ma-2531的arcBCA操纵子结构示意图和PCR扩增引物相对位置
Figure 2 Structure diagram of arcBCA operon and positions of PCR primers
图3 河弧菌arc操纵子序列PCR扩增结果
Figure 3 PCR amplification of arc operon in V. fluvialis 注: 1, 4, 7, 10, 12, 14: strain Ma-2531; 2, 5, 8: strain JS50; 3, 6, 9,11, 13: strain CICC21612。
针对arcBCA编码基因的引物对arc-F/arc-R、 arc-F/arc-rev和arc-ck-up/arc-R对Ma-2531的扩增结果均为阴性,对照菌株均给出预期大小的特异性扩增条带,说明arcBCA基因簇在Ma-2531中的缺失。笔者针对arc 操纵子两侧的序列设计了引物arc1-up/arc1-dn和arc72695-up/arc75219-dn 进行扩增,结果Ma-2531扩增出和对照菌株一致的条带,说明存在相关序列,然后分别以arc1-dn和arc72695-up的反向互补序列作为上下游引物arc1-dnRev及arc72695-upRev对Ma-2531进行扩增,获得1500 bp的扩增条带,测序分析表明,该扩增片段包含transposase IS4 的序列和argR 5′部分序列及arcD基因后间隔区的部分序列。该结果证实在菌株Ma-2531中由于transposase IS4的插入导致了包括精氨酸双水解酶系统arcBCA基因簇及上游的天冬氨酸氨甲酰转移酶调节亚基和催化亚基编码基因在内的约8.6 kb大片段的缺失, 从而导致Ma-2531精氨酸双水解酶阴性的生化表型。
2.3 生长曲线和pH值的测定
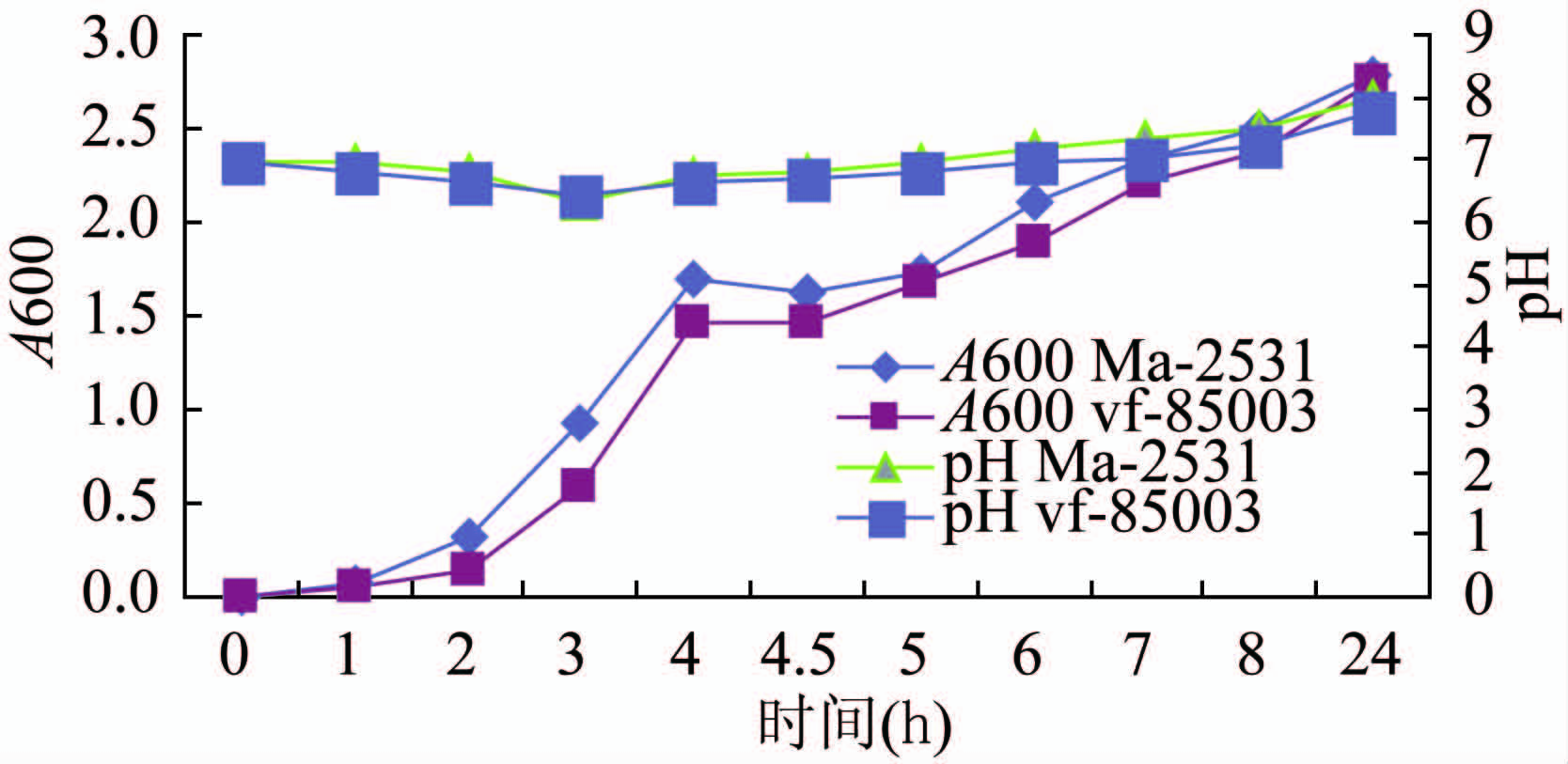
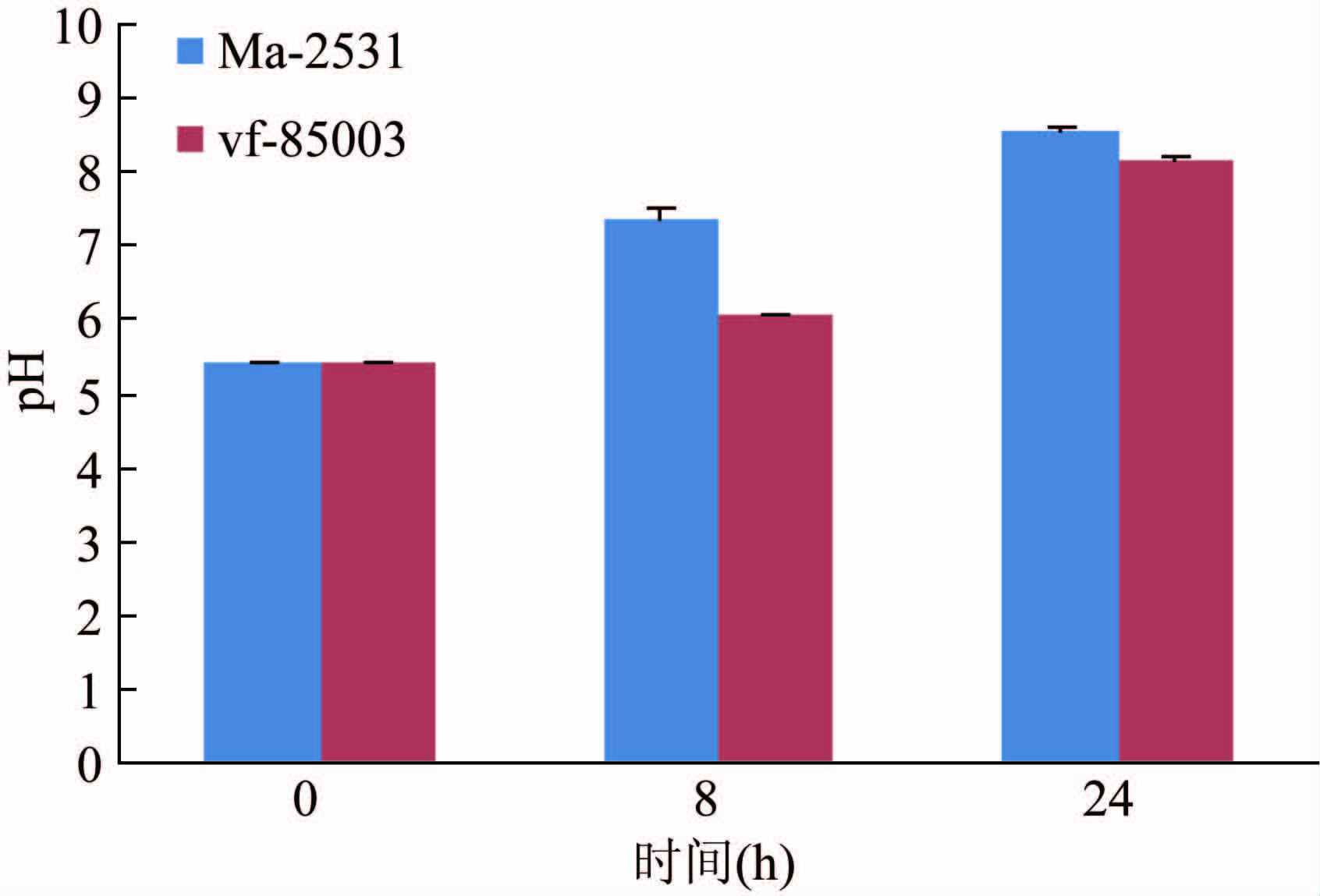
文献报道链球菌和嗜水气单胞菌的精氨酸双水解酶系统有助于细菌细胞对酸性环境的抗性,通过水解精氨酸产生NH3,逆转酸性的不良生长环境[11]。为此,笔者比较了精氨酸双水解酶系统阴性和阳性菌株Ma-2531及EF85003在液体LB中pH值和生长曲线变化(图4~5),从图中可看出无论是生长曲线,还是正常(pH 7.0)及酸性(pH 5.4)培养条件下的pH值变化,二者均呈现相同的趋势,说明精氨酸双水解酶系统的缺失不影响Ma-2531的生长和对酸性环境的抵抗,提示在河弧菌中可能存在其他的代偿机制能抵御培养液的酸化,但也不能排除2株菌株遗传背景差异所带来的影响。
图4 Ma-2531和EF85003在液体LB中生长速度(A600)和pH值的变化
Figure 4 Growth and pH change of V. fluvialis Ma-2531 and EF85003
图5 酸耐受试验中Ma-2531和EF85003 pH值的变化
Figure 5 pH change of V. fluvialis Ma-2531 and EF85003 in acidic LB media (Initial pH=5.4) 注:LB培养液,初始pH为5.4。
3 讨论
精氨酸双水解酶又称精氨酸脱亚氨酶(arginine dihydrolase)、瓜氨酸亚氨酶(citrulline iminase)、或精氨酸脱亚氨酶(L-arginine deiminase),是弧菌科细菌鉴别的重要生化指标之一。河弧菌精氨酸双水解酶一般为阳性,而精氨酸双水解酶阴性河弧菌的出现增加了通过生化表型实验来鉴定河弧菌的难度和不确定性,由transposase IS4插入导致的精氨酸双水解酶阴性的河弧菌为首次报道。鉴于转座子的可移动性,不排除其在自然界或感染宿主体内环境中在不同菌株间转移,从而造成新的表型特征菌株的出现。细菌通过精氨酸双水解酶系统水解精氨酸作为能量来源[16],在猪链球菌中该系统还被认为是一潜在的毒力因子,有助于菌株对酸性环境中的抵抗,提升生物适应性[11]。本研究中也比较了精氨酸双水解酶系统正常和缺失的2株菌的生长曲线和培养液pH值变化,没有发现差别,除菌株遗传背景差异的影响外,实验中选择LB这种富营养的培养液可能也起了屏蔽作用,在后续研究中笔者拟使用低营养成分培养基(minimal medium)和人工构建精氨酸双水解酶系统缺失的菌株,在相同遗传背景下进一步研究精氨酸双水解酶系统在河弧菌的致病和环境生存中的生理意义。
参考文献
[1] Furniss AL, Lee JV, Donovan TJ. Group F, a new Vibrio?[J]. Lancet, 1977,2(8037):565-566.
[2] Huq MI, Alam AK, Brenner DJ, et al. Isolation of Vibrio like group, EF-6, from patients with diarrhea[J]. J Clin Microbiol, 1980,11(6):621-624.
[3] Lee JV, Shread P, Furniss AL, et al. Taxonomy and description of Vibrio fluvialis sp. nov. (synonym group F vibrios, group EF6)[J]. J Appl Bacteriol, 1981,50(1):73-94.
[4] Bhattacharjee S, Bhattacharjee S, Bal B, et al. Is Vibrio fluvialis emerging as a pathogen with epidemic potential in coastal region of eastern India following cyclone Aila?[J]. J Health Poput Nutr, 2010,28(4):311-317.
[5] Allton DR, Forgione MA Jr, Gros SP, et al. Cholera like presentation in Vibrio fluvialis enteritis[J]. South Med J,2 006,99(7):765-767.
[6] Chowdhury G, Pazhani GP, Dutta D, et al. Vibrio fluvialis in Patients with Diarrhea, Kolkata, India[J]. Emerg Infect Dis, 2012,18(11):1868-1871.
[7] Cabrera Rodriguez LE, Monroy SP, Morier L, et al. Severe otitis due to Vibrio fluvialis in a patient with AIDs: first report in the world[J]. Rev Cubana Med Trop, 2005,57(2):154-155.
[8] Lai CH, Hwang CK, Chin C, et al. Severe watery diarrhoea and bacteraemia caused by Vibrio fluvialis [J]. J Infect, 2006,52(3):e95-98.
[9] FDA FaDA. Vibrio//In Bacteriological Analytical Manual online[M]. 8th ed. DC: FDA, 2001.
[10] Brenner DJ, Hickman Brenner FW, Lee JV, et al. Vibrio furnissii (formerly aerogenic biogroup of Vibrio fluvialis ), a new species isolated from human feces and the environment[J]. J Clin Microbiol, 1983,18(4):816-824.
[11] Fulde M, Willenborg J, de Greeff A, et al. ArgR is an essential local transcriptional regulator of the arcABC operon in Streptococcus suis and is crucial for biological fitness in an acidic environment[J]. Microbiol, 2011,157(Pt 2):572-582.
[12] Lux TM, Lee R, Love J. Complete genome sequence of a free living Vibrio furnissii sp. nov. strain (NCTC 11218)[J]. J Bacteriol, 2011,193(6):1487-1488.
[13] Liang P, Cui X, Du X, et al. The virulence phenotypes and molecular epidemiological characteristics of Vibrio fluvialis in China[J]. Gut Pathog, 2013,5(1):6.
[14] Chakraborty R, Sinha S, Mukhopadhyay AK, et al. Species specific identification of Vibrio fluvialis by PCR targeted to the conserved transcriptional activation and variable membrane tether regions of the toxR gene[J]. J Med Microbiol, 2006,55(Pt 6):805-808.
[15] Lee SK, Wang HZ, Law SH, et al. Analysis of the 16S-23S rDNA intergenic spacers (IGSs) of marine vibrios for species specific signature DNA sequences[J]. Mar Pollut Bull, 2002,44(5):412-420.
[16] Schofield PJ, Costello M, Edwards MR, et al. The arginine dihydrolase pathway is present in Giardia intestinalis[J]. Int J Parasitol, 1990,20(5):697-699.
[2] Huq MI, Alam AK, Brenner DJ, et al. Isolation of Vibrio like group, EF-6, from patients with diarrhea[J]. J Clin Microbiol, 1980,11(6):621-624.
[3] Lee JV, Shread P, Furniss AL, et al. Taxonomy and description of Vibrio fluvialis sp. nov. (synonym group F vibrios, group EF6)[J]. J Appl Bacteriol, 1981,50(1):73-94.
[4] Bhattacharjee S, Bhattacharjee S, Bal B, et al. Is Vibrio fluvialis emerging as a pathogen with epidemic potential in coastal region of eastern India following cyclone Aila?[J]. J Health Poput Nutr, 2010,28(4):311-317.
[5] Allton DR, Forgione MA Jr, Gros SP, et al. Cholera like presentation in Vibrio fluvialis enteritis[J]. South Med J,2 006,99(7):765-767.
[6] Chowdhury G, Pazhani GP, Dutta D, et al. Vibrio fluvialis in Patients with Diarrhea, Kolkata, India[J]. Emerg Infect Dis, 2012,18(11):1868-1871.
[7] Cabrera Rodriguez LE, Monroy SP, Morier L, et al. Severe otitis due to Vibrio fluvialis in a patient with AIDs: first report in the world[J]. Rev Cubana Med Trop, 2005,57(2):154-155.
[8] Lai CH, Hwang CK, Chin C, et al. Severe watery diarrhoea and bacteraemia caused by Vibrio fluvialis [J]. J Infect, 2006,52(3):e95-98.
[9] FDA FaDA. Vibrio//In Bacteriological Analytical Manual online[M]. 8th ed. DC: FDA, 2001.
[10] Brenner DJ, Hickman Brenner FW, Lee JV, et al. Vibrio furnissii (formerly aerogenic biogroup of Vibrio fluvialis ), a new species isolated from human feces and the environment[J]. J Clin Microbiol, 1983,18(4):816-824.
[11] Fulde M, Willenborg J, de Greeff A, et al. ArgR is an essential local transcriptional regulator of the arcABC operon in Streptococcus suis and is crucial for biological fitness in an acidic environment[J]. Microbiol, 2011,157(Pt 2):572-582.
[12] Lux TM, Lee R, Love J. Complete genome sequence of a free living Vibrio furnissii sp. nov. strain (NCTC 11218)[J]. J Bacteriol, 2011,193(6):1487-1488.
[13] Liang P, Cui X, Du X, et al. The virulence phenotypes and molecular epidemiological characteristics of Vibrio fluvialis in China[J]. Gut Pathog, 2013,5(1):6.
[14] Chakraborty R, Sinha S, Mukhopadhyay AK, et al. Species specific identification of Vibrio fluvialis by PCR targeted to the conserved transcriptional activation and variable membrane tether regions of the toxR gene[J]. J Med Microbiol, 2006,55(Pt 6):805-808.
[15] Lee SK, Wang HZ, Law SH, et al. Analysis of the 16S-23S rDNA intergenic spacers (IGSs) of marine vibrios for species specific signature DNA sequences[J]. Mar Pollut Bull, 2002,44(5):412-420.
[16] Schofield PJ, Costello M, Edwards MR, et al. The arginine dihydrolase pathway is present in Giardia intestinalis[J]. Int J Parasitol, 1990,20(5):697-699.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 吴睿 | |
| 梁璞 | |
| 卢昕 | |
| 阚飙 | |
| 梁未丽 | |
| PubMed | |
| Article by WU Rui | |
| Article by LIANG Pu | |
| Article by LU Xin | |
| Article by KAN Biao | |
| Article by LIANG Wei-li | |